
回顾性分析首都医科大学附属北京同仁医院儿科2012年1月至2024年1月收治的确诊儿童嗅神经母细胞瘤(ONB)的5例患儿临床资料。男2例,女3例,年龄6.2(5.7~15.8)岁,首发临床症状主要为鼻塞、鼻分泌物增多、头痛、视力下降等;病理分级Ⅱ级2例,Ⅲ级1例,Ⅳ例2例;改良Kadish分期B期1例,C期2例,D期2例。所有患儿均接受了手术、化疗和放疗。5例患儿中4例存活,1例死亡,随访时间22.3(10.4~56.4)个月,无一例复发。儿童ONB经手术、化疗、放疗为主的综合治疗可获得较好疗效和预后,但需长期随访。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
嗅神经母细胞瘤(ONB)是鼻颅底罕见的恶性肿瘤,起源于嗅黏膜的神经上皮成分或嗅基板的神经外胚叶成分。ONB的发病高峰为50~60岁,儿童期发病罕见。本研究对5例儿童ONB患者的临床、影像学、病理资料等进行了回顾性分析和归纳,报道如下。
1. 研究对象:病例系列研究。2012年1月至2024年1月首都医科大学附属北京同仁医院共收治100例ONB患者,本研究纳入其中在儿科病房收治的18岁以下患者。本研究通过北京同仁医院伦理委员会批准(批件号:trec2024-ky038),并豁免知情同意。
2. 资料收集:建立统一的病例报告表,记录患儿年龄、性别、现病史、既往史、家族史、临床表现、肿瘤指标、影像学检查、病理结果、治疗方式等,同时电话随访患儿预后情况。
3. 诊断标准:ONB的诊断依靠临床、影像学、鼻内镜、病理形态及免疫组织化学染色等多方面综合进行诊断,其中病理免疫组织化学诊断为诊断金标准。ONB典型形态特点为伴有分叶状生长模式、不等量原纤维样细胞质和神经突起的小圆细胞肿瘤。
4. 分期分级方法:ONB尚无统一的分期系统,通常使用Hyams分级系统进行病理分级,使用Morita改良Kadish分期进行肿瘤分期。另外,Dulguerov分期系统由TNM系统改良而来。Hyams分级系统依据病理学特征,如有丝分裂活性和坏死等特征,将肿瘤分为Ⅰ~Ⅳ级[1]。Morita改良Kadish系统分期的分期依据为局部肿瘤的解剖学受累程度[2]。
5. 统计学分析:使用SPSS 21.0统计软件进行数据分析。计数资料以例数表示,正态分布的计量资料以表示,非正态分布的计量资料以M(范围)或M(Q1,Q3)表示。
1. 基本资料:共5例ONB患儿,男2例,女3例,发病年龄6.2(5.7~15.8)岁;发病至就诊时间为1(0~151)d,就诊至确诊时间为18(5~61)d;其中2例患儿病程中存在误诊,误诊为“鼻息肉”。首发临床症状分别为鼻塞4例、鼻腔分泌物增多2例、头痛2例、视力下降2例、眼球突出1例、嗅觉下降1例。发病和侵犯部位包括鼻腔鼻窦(5例)、视神经(3例)、颅骨(3例)、颅脑(2例)、眼眶(2例)、眼肌(2例)、脊髓(1例)、鼻翼(1例),存在远处淋巴结转移2例。见表1。
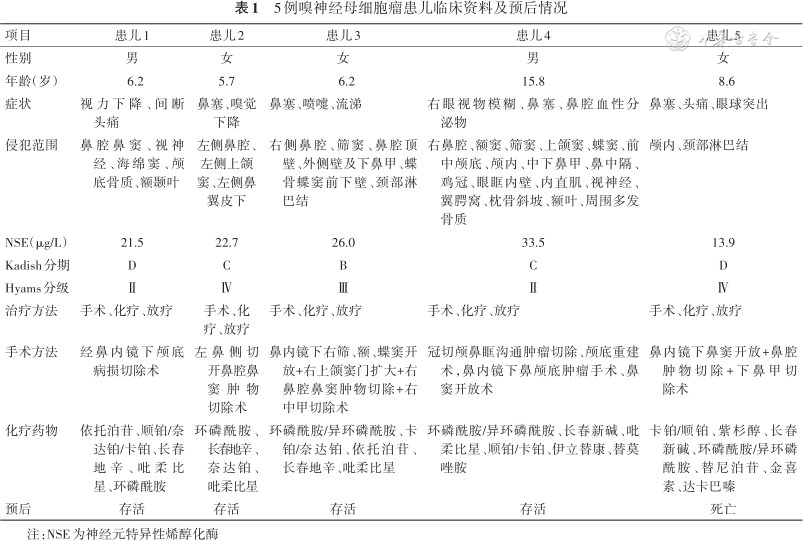
5例嗅神经母细胞瘤患儿临床资料及预后情况
5例嗅神经母细胞瘤患儿临床资料及预后情况
| 项目 | 患儿1 | 患儿2 | 患儿3 | 患儿4 | 患儿5 |
|---|---|---|---|---|---|
| 性别 | 男 | 女 | 女 | 男 | 女 |
| 年龄(岁) | 6.2 | 5.7 | 6.2 | 15.8 | 8.6 |
| 症状 | 视力下降、间断头痛 | 鼻塞、嗅觉下降 | 鼻塞、喷嚏、流涕 | 右眼视物模糊、鼻塞、鼻腔血性分泌物 | 鼻塞、头痛、眼球突出 |
| 侵犯范围 | 鼻腔鼻窦、视神经、海绵窦、颅底骨质、额颞叶 | 左侧鼻腔、左侧上颌窦、左侧鼻翼皮下 | 右侧鼻腔、筛窦、鼻腔顶壁、外侧壁及下鼻甲、蝶骨蝶窦前下壁、颈部淋巴结 | 右鼻腔、额窦、筛窦、上颌窦、蝶窦、前中颅底、颅内、中下鼻甲、鼻中隔、鸡冠、眼眶内壁、内直肌、视神经、翼腭窝、枕骨斜坡、额叶、周围多发骨质 | 颅内、颈部淋巴结 |
| NSE(μg/L) | 21.5 | 22.7 | 26.0 | 33.5 | 13.9 |
| Kadish分期 | D | C | B | C | D |
| Hyams分级 | Ⅱ | Ⅳ | Ⅲ | Ⅱ | Ⅳ |
| 治疗方法 | 手术、化疗、放疗 | 手术、化疗、放疗 | 手术、化疗、放疗 | 手术、化疗、放疗 | 手术、化疗、放疗 |
| 手术方法 | 经鼻内镜下颅底病损切除术 | 左鼻侧切开鼻腔鼻窦肿物切除术 | 鼻内镜下右筛、额、蝶窦开放+右上颌窦门扩大+右鼻腔鼻窦肿物切除+右中甲切除术 | 冠切颅鼻眶沟通肿瘤切除、颅底重建术,鼻内镜下鼻颅底肿瘤手术、鼻窦开放术 | 鼻内镜下鼻窦开放+鼻腔肿物切除+下鼻甲切除术 |
| 化疗药物 | 依托泊苷、顺铂/奈达铂/卡铂、长春地辛、吡柔比星、环磷酰胺 | 环磷酰胺、长春地辛、奈达铂、吡柔比星 | 环磷酰胺/异环磷酰胺、卡铂/奈达铂、依托泊苷、长春地辛、吡柔比星 | 环磷酰胺/异环磷酰胺、长春新碱、吡柔比星、顺铂/卡铂、伊立替康、替莫唑胺 | 卡铂/顺铂、紫杉醇、长春新碱、环磷酰胺/异环磷酰胺、替尼泊苷、金喜素、达卡巴嗪 |
| 预后 | 存活 | 存活 | 存活 | 存活 | 死亡 |
注:NSE为神经元特异性烯醇化酶
2. 影像学资料:患儿术前均进行CT及MRI检查。MRI通常显示为混杂信号,增强扫描可强化,不均匀,见图1A~1D。正电子发射计算机断层成像(PET/CT)肿瘤表现为代谢增高的软组织影,见图1E。
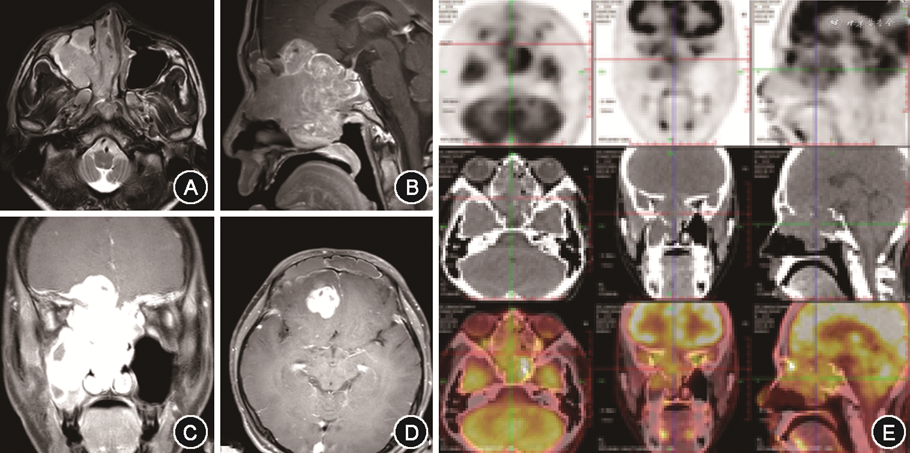

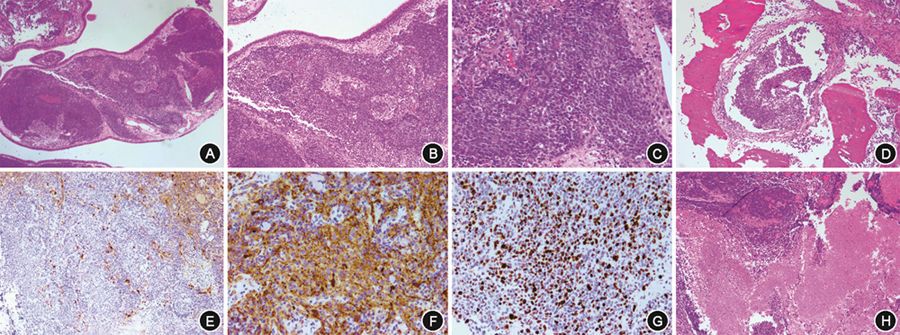
3. 病理学检查结果:5例患儿术后病理均明确诊断ONB,免疫组化结果见表2。患儿4存在BRG-1表达缺失,病理及免疫组化结果见图2。
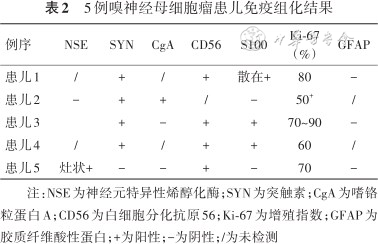
5例嗅神经母细胞瘤患儿免疫组化结果
5例嗅神经母细胞瘤患儿免疫组化结果
| 例序 | NSE | SYN | CgA | CD56 | S100 | Ki-67(%) | GFAP |
|---|---|---|---|---|---|---|---|
| 患儿1 | / | + | / | + | 散在+ | 80 | - |
| 患儿2 | - | + | + | / | - | 50+ | / |
| 患儿3 | + | - | + | + | 70~90 | - | |
| 患儿4 | / | + | / | + | + | 60 | / |
| 患儿5 | 灶状+ | - | - | + | - | 70 | - |
注:NSE为神经元特异性烯醇化酶;SYN为突触素;CgA为嗜铬粒蛋白A;CD56为白细胞分化抗原56;Ki-67为增殖指数;GFAP为胶质纤维酸性蛋白;+为阳性;-为阴性;/为未检测

4. 治疗及随访结果:5例ONB患儿的治疗方式见表1。均规律随访,末次随访时间2024年5月1日,4例患儿存活,1例患儿死亡,随访22.3(10.4~56.4)个月,无一例复发。死亡的患儿为2012年收治时已发生中枢神经系统广泛转移的患儿。
ONB是一种罕见的鼻颅底恶性肿瘤,曾被命名为“感觉神经母细胞瘤”“感觉神经细胞瘤及神经内分泌癌”,其起源于嗅黏膜嗅神经上皮的基底细胞,好发于嗅黏膜区,可呈浸润性生长,累及邻近的筛窦、上颌窦、蝶窦和额窦,也可向颅内和眼眶侵犯。ONB估计发病率为0.4/百万[3],占鼻腔、鼻窦恶性肿瘤的2%~6%,其起病隐匿,生物学行为多样,既可为缓慢生长的惰性肿瘤,又可为发生局部或远处转移的高侵袭性肿瘤。
ONB在各个年龄阶段发病均有报道,其中50~60岁为发病高峰,男性发病略多于女性,儿童罕见。临床表现一般与肿瘤侵犯的范围密切相关,多见嗅觉丧失、眼眶疼痛、眼球突出、视力下降、耳痛和中耳炎,少见症状还有视阵挛-肌阵挛-共济失调、抗利尿激素分泌异常综合征等[3]。ONB远处转移率为10%~30%,颈部淋巴结为其最常见的转移部位[4]。ONB的重要临床特征是肿瘤中心部位在鼻腔中上部及顶部,影像学检查可评估其侵犯范围,也是诊断和治疗的重要依据。因ONB向上破坏筛板或沿嗅神经向颅内扩展侵犯前颅窝,在影像上可表现为同时向鼻腔和颅内生长的“哑铃”状肿物。ONB的MRI表现多为T1加权像(T1WI)低信号、T2加权像(T2WI)等或高信号,增强扫描可强化;CT表现为鼻穹窿部顶部前2/3高密度影、均质性肿块,基底部位于筛板,中等强化[5]。本组患儿均为儿童/青春期患者,临床表现与文献报道相符,与常见的成人ONB症状相似;但因临床表现无特异性,常有误诊或延迟诊断,故面对鼻塞同时伴视力下降的患儿时,需警惕ONB的可能;ONB易早期发生颈部转移,需初诊时全面评估,以防漏诊。
ONB病理特征性形态为小圆细胞肿瘤伴有分叶状模式和不等量原纤维样细胞质相互交错的神经突起[1]。肿瘤细胞巢内神经原纤维基质背景、嗅黏膜内原位瘤变、S100蛋白阳性细胞包绕肿瘤细胞巢现象、有多向分化表现,以上均需高度怀疑ONB。基因相关检测表明,相当一部分ONB患者存在TP53、PIK3CA、NF1和CDKN2A基因突变,以及FGFR3和CCND1基因拷贝数改变或扩增[6]。本组患儿病理表现较典型,但患儿4存在BRG-1表达缺失,这在ONB患者中尚缺乏类似报道。SMARCA4基因的各类突变均会导致BRG-1表达缺失,SMARCA4缺陷型肿瘤目前已被定义为一类特殊的肿瘤类型而广受关注,对肿瘤患者的预后和治疗有很大影响。但目前尚缺少ONB与SMARCA4突变相关的报道,值得进一步关注和探索。
手术、放疗和(或)化疗均可用于治疗ONB,但尚无统一、成熟的治疗模式。需综合考虑ONB情况,根据分期分级,采用手术、联合放疗或化疗的综合治疗方案[7]。Kadish A期和低Hyams级别(Ⅰ~Ⅱ级)ONB可单纯手术切除,不联合放疗;Kadish B和C期或Hyams分级较高(Ⅲ~Ⅳ级)者,应手术联合放疗[8, 9]。儿童ONB与成人ONB治疗方式的差异体现在两个方面:首先,由于放疗在儿童中的应用受到限制,因此并未作为一线治疗方法;其次,化疗在儿童ONB的治疗中十分重要,多项研究证实化疗对于ONB淋巴结转移患儿以及复发患儿具有良好的治疗效果。本组患儿均接受手术、化疗和放疗,尤其是近年的病例预后均较好,也证实了综合治疗的效果。
ONB复发率为30%~60%,但复发间隔时间多较长,平均为6年[10, 11]。研究表明,高级别Hyams的ONB与远处复发存在相关性[12]。ONB总生存率较高,5年总生存率为57%~93%;复发ONB的5年生存率为27%~63%[13]。预后影响因子包括肿瘤侵犯范围、分期、病理分级和年龄[14, 15, 16]。本组患儿中目前无复发,但鉴于ONB复发的特殊性,患儿均计划进行定期随访和终身随访。本组患儿中虽涉及Ⅳ级、硬脑膜浸润等不良预后因素,但整体较成人ONB预后良好;然而,随访时间尚短,未来还需进行长时间的随访和评估,才能判断其真实的长期预后情况。
综上所述,临床中对于鼻腔中上部及顶部肿块,尤其向鼻腔和颅内生长的“哑铃”状肿物,需要特别注意ONB可能;虽然儿童ONB目前尚无统一的治疗模式,但应用包括手术、化疗、放疗在内的综合治疗方案,患儿仍可获得良好的疗效;由于ONB存在延迟复发的风险,应建立基于症状、内窥镜检查和影像学检查的长期随访机制。
顾华丽, 黄东生, 张伟令, 等. 儿童嗅神经母细胞瘤5例临床分析[J]. 中华医学杂志, 2024, 104(34): 3248-3251. DOI: 10.3760/cma.j.cn112137-20240611-01304.
所有作者声明不存在利益冲突



























