
本文报道1例Graves病伴胫前黏液性水肿患者的诊疗经过。该例患者经完善相关化验、检查及皮肤组织病理后明确诊断Graves病合并胫前黏液性水肿,予以病灶内局部复方倍他米松注射,皮损处外用糠酸莫米松乳膏+维A酸乳膏封包治疗,治疗12周后双下肢皮肤病变较前明显改善。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,67岁,2024年1月9日以“甲状腺功能亢进病史3年,双下肢结节样水肿2年余”为主诉入空军特色医学中心内分泌科治疗。患者2020年6月因“胆囊结石”就诊于当地医院查甲状腺功能提示甲状腺功能亢进,自诉确诊前1个月体重减轻10 kg,有手抖症状,不伴有易饥、多食、心悸等不适。诊断“甲状腺功能亢进症、Graves病”,予以甲巯咪唑10 mg 每日1次口服,未规律复查甲状腺功能。于当地医院多次调整抗甲状腺药物剂量,复查甲状腺功能控制仍较差,促甲状腺激素受体抗体(TRAb)>40 U/L,病程中频繁有甲状腺功能亢进及甲状腺功能减退交替出现。2021年12月无明显诱因出现双下肢胫前红斑,红斑面积逐渐扩大伴有皮肤增厚,约半年后双下肢开始出现结节样改变,由左足第1足趾向上逐步蔓延至足背及足踝部,右足相继出现类似皮肤改变。同时伴有双眼轻度畏光、流泪。否认家族史,否认药物、食物过敏史,无吸烟及饮酒史。入院查体:体温:36.5 ℃,脉搏:68次/min,呼吸:18次/min,血压:130/65 mmHg(1 mmHg=0.133 kPa)。双眼睑轻度肿胀,上睑运动可,右眼下睑挛缩2 mm,左眼下睑挛缩1 mm,双眼球结膜轻度水肿,无明显充血,双眼各方向运动到位,辐辏可,余眼征阴性。双眼球突出(左眼18 mm、右眼18 mm、测量间距106 mm)。双侧甲状腺Ⅰ度肿大,质中等,可触及震颤,听诊可闻及血管杂音。双下肢胫前皮肤增厚、肿胀,颜色暗红,双侧足背及踝部见多处结节融合呈非凹陷性水肿样改变,皮肤表面凹凸不平呈橘皮样,质地硬(图1A),无明显痛感。2024年1月10日本院实验室检查结果:三碘甲状腺原氨酸4.82 nmol/L(正常参考范围:0.92~2.38 nmol/L,下同)、甲状腺素244.32 nmol/L(69.71~163.95 nmol/L)、游离三碘甲状腺原氨酸11.55 pmol/L(3.53~7.37 pmol/L)、游离甲状腺素31.70 pmol/L(7.98~16.02 pmol/L)、促甲状腺激素<0.00 U/L(0.56~5.91 U/L)、甲状腺球蛋白91.20 mg/L(1.59~50.03 mg/L)、TRAb>40 U/L(<1.75 U/L)。血、尿、便常规、肝肾功能、电解质、骨代谢指标未见明显异常。2024年1月12日眼眶MRI:双侧眼眶及眼球对称,球后眶脂体增多,双侧内直肌及下直肌增厚。骨密度:骨量减少。2024年1月17日皮损组织病理检查:表皮网蓝状角化过度,皮突延长,基底细胞灶状液化变性,真皮浅中层胶原间隙明显增宽、水肿淡染,可疑黏液样物质沉积。IgG、C3、IgA、IgM均(-),黏液染色(+)(图2)。病理诊断:甲亢性胫前黏液性水肿(PTM)。
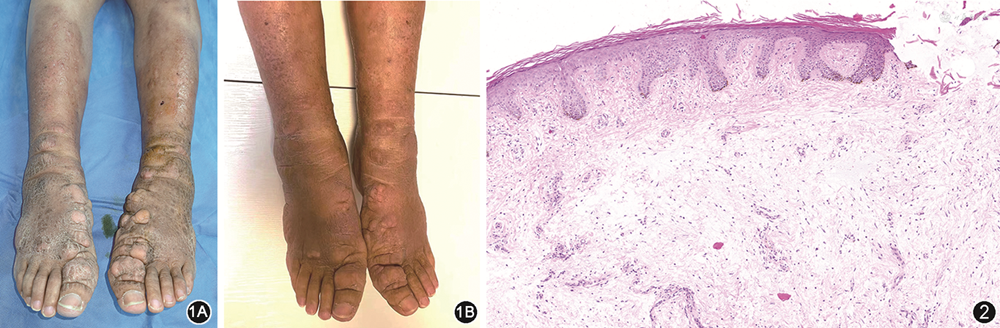

治疗及随访:使用复方倍他米松注射液(比利时Schering-Plough Labo N.V公司,国药准字J20140160)1 ml用5 ml生理盐水稀释,于皮肤结节凸起处多点注射,每2 cm径长区域给药0.5 ml,病灶内注射治疗1次。糠酸莫米松乳膏(德国拜耳公司,国药准字H19991418)+维A酸乳膏(重庆华邦制药,国药准字H50021817)(1∶1混合)适量均匀涂抹至皮损处,塑料薄膜封包20 min/d。治疗12周后2024年4月15日观察患者双下肢结节斑块厚度变小,皮肤肿胀较前明显改善,以双足踝部结节斑块厚度改善为著(图1B)。
PTM在Graves病患者中的发病率为0.5%~4.3%[1]。PTM患者几乎都存在甲状腺眼病,且血清TRAb水平远高于Grave病临床表现轻的患者和眼病严重但无PTM的患者[2]。PTM的病因不明,可能与甲状腺眼病的眶后表现有相似的病理生理,都与胰岛素样生长因子-1受体有关。临床表现为真皮非凹陷性水肿,为透明质酸的强亲水结合力导致的真皮淋巴管受压及胶原纤维碎裂所致[3]。
甲状腺相关皮肤病变在大多数情况下,皮肤病变会随着甲状腺功能的恢复而改善甚至消退。一项216例PTM患者的长期随访研究中显示,超过一半的轻度皮肤病患者没有接受任何治疗,在不到17年的时间里完全缓解,经过25年的随访,58%的重症患者接受局部治疗,70%的轻度患者未治疗病例部分或完全缓解[4]。既往研究显示,对于影响外观及功能问题或局部不适的PTM患者的治疗应首先考虑局部使用皮质类固醇治疗,病变越轻、范围越广、治疗效果越好[5]。替妥木单抗在治疗甲状腺相关性眼病(TED)的临床疗效已在较多文献报道中得到证实,多个国外文献报道提示接受治疗的TED患者PTM的症状改善显著,支持了这两种疾病之间潜在的共同病理生理学的观点[6]。对于严重皮肤病变,尽管有一些成功的手术案例报道,但鉴于复发率高,通常不建议手术切除。对于难治性PTM有报道应用注射奥曲肽治疗,其是一种胰岛素样生长因子-1拮抗剂,有益于改善难治性PTM[7]。局部透明质酸酶治疗PTM也有成功的案例[8]。另外应用局部压迫治疗严重水肿和象皮病的病例中也有效果[9]。
本文病例多次查TRAb水平较高,外院明确诊断为甲状腺功能亢进症、Graves病,甲状腺功能长期控制不佳,同时伴有甲亢相关性眼病。针对双下肢PTM,采取复方倍他米松注射液病灶内局部注射,随后每日外用糠酸莫米松乳膏+维A酸乳膏同时封包治疗,12周后观察双下肢皮肤病变较前明显改善。
综上,对于轻度PTM的患者可积极纠正甲状腺功能,针对轻度皮损可不予特殊处理。严重PTM可考虑类固醇皮质激素治疗,病变改善后应逐渐减少皮质类固醇使用剂量及频次,避免不良反应出现。
李庞敏, 朱迪, 王良宸, 等. Graves病伴胫前黏液性水肿1例[J]. 中华医学杂志, 2024, 104(34): 3268-3269. DOI: 10.3760/cma.j.cn112137-20240425-00980.
所有作者声明不存在利益冲突



























