
探讨曲妥珠单抗和帕妥珠单抗联合紫杉类药物和铂类药物(TCbHP)方案新辅助治疗人表皮生长因子受体2(HER2)阳性乳腺癌的效果及安全性。
回顾性病例系列研究。回顾性分析2019年6月至2021年12月河北省11家三级甲等医院接受21 d TCbHP方案新辅助治疗并完成后续手术的HER2阳性乳腺癌患者的临床资料,统计分析总体病理完全缓解(tpCR)率、≥3级不良反应发生率和既定方案完成率。
共纳入78例患者,均为女性,中位年龄[M(Q1,Q3)]54.0岁(48.5岁,57.5岁)。tpCR率为64.1%(50/78)。亚组分析显示,HER2免疫组织化学法(IHC)+++组tpCR率高于HER2 IHC++且荧光原位杂交阳性组[68.6%(48/70)比25.0%(2/8)],差异有统计学意义(χ2=4.18,P=0.041);激素受体阴性组tpCR率高于激素受体阳性组[81.8%(27/33)比51.1%(23/45)],差异有统计学意义(χ2=7.80,P=0.005);使用白蛋白结合型紫杉醇组tpCR率高于多西他赛组[72.3%(34/47)比48.3%(14/29)],差异有统计学意义(χ2=4.46,P=0.035)。78例患者≥3级不良反应发生率为12.8% (10/78),既定方案完成率为92.3%(72/78)。
TCbHP方案新辅助治疗HER2阳性乳腺癌患者效果确切,安全性及耐受性良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乳腺癌中15%~20%为人表皮生长因子受体2(HER2)阳性乳腺癌。新辅助治疗是HER2阳性乳腺癌综合治疗体系的重要组成部分。NeoSphere及PEONY研究奠定了曲妥珠单抗联合帕妥珠单抗(HP)在HER2阳性乳腺癌新辅助靶向治疗中的基石地位[1,2]。后续的TRAIN-2、KRISTINE、TRYPHENA等前瞻性临床试验显示,HP联合紫杉类药物和铂类药物(TCbHP)方案可将总体病理完全缓解(tpCR)率提高到60%左右[3,4,5]。权威指南一致推荐TCbHP方案为HER2阳性乳腺癌新辅助治疗首选或优选方案。本研究收集河北省多家三级甲等医院接受TCbHP方案新辅助治疗的HER2阳性乳腺癌患者的临床资料,分析该方案在真实世界临床实践中的疗效、安全性及耐受性,为该方案合理应用提供更全面的依据。
本研究为回顾性病例系列研究。纳入标准:病理证实为HER2阳性浸润性乳腺癌;无远处转移;接受TCbHP方案新辅助治疗并完成后续的手术治疗;可获得完整临床资料。排除标准:非浸润性乳腺癌和HER2阴性浸润性乳腺癌;存在远处转移;接受其他新辅助治疗方案;不能获得完整临床资料。回顾性分析2019年6月至2021年12月河北省11家三级甲等医院符合纳入、排除标准的HER2阳性乳腺癌患者的临床资料。本研究经保定市第一中心医院医学伦理委员会批准(批准文号:[2021]088号)。
按照我国乳腺癌HER2检测指南(2019版)[6]判定HER2结果:免疫组织化学法(IHC)+++直接判定为HER2阳性,IHC++时采用荧光原位杂交(FISH)行HER2基因扩增分析。激素受体(HR)阳性定义为雌激素受体(ER)和(或)孕激素受体(PR)阳性。ER和PR表达结果的判读根据乳腺癌ER、PR检测指南,即阳性细胞数≥1%为阳性[7]。
研究终点:(1)tpCR率,定义为乳腺原发灶无浸润性癌残留且区域淋巴结阴性,即ypT0/isypN0;(2)≥3级不良反应发生率,参照不良反应通用术语标准(CTCAE)5.0版分为5级;(3)既定治疗方案完成率。
采用SPSS 20.0软件进行统计学分析。计量资料呈偏态分布,用M(Q1,Q3)表示;计数资料用频数(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
共纳入78例患者,均为女性,中位年龄54.0岁(48.5岁,57.5岁)。患者均采用21 d TCbHP方案新辅助治疗,化疗药物剂量按照指南规定计算,其中卡铂的中位剂量为600 mg(500 mg,700 mg),普遍低于根据曲线下面积(AUC)为5或6计算的标准剂量。紫杉类药物中使用白蛋白结合型紫杉醇47例,多西他赛29例,溶剂型紫杉醇2例。新辅助治疗8个周期2例,6个周期72例,5个周期1例,4个周期3例。手术方式选择改良根治术72例,保乳根治术4例,乳房全切+前哨淋巴结切除术1例,根治术1例。末次化疗至手术的中位时间为21 d(19 d,28 d)。术后病理评估采用多点取材方法70例,采用残余肿瘤负荷(RCB)评估系统8例。术后辅助全身治疗采用HP双靶治疗53例,HP联合内分泌治疗21例,恩美曲妥珠单抗(T-DM1)1例,HP联合化疗2例,其他治疗1例。患者其他临床病理特征见表1。
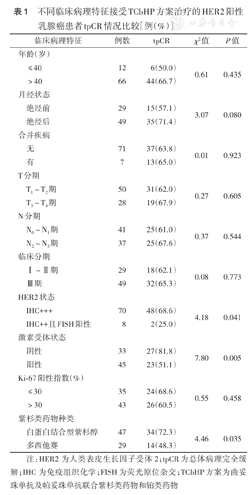
不同临床病理特征接受TCbHP方案治疗的HER2阳性乳腺癌患者tpCR情况比较[例(%)]
不同临床病理特征接受TCbHP方案治疗的HER2阳性乳腺癌患者tpCR情况比较[例(%)]
| 临床病理特征 | 例数 | tpCR | χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | ||||
| ≤ 40 | 12 | 6(50.0) | 0.61 | 0.435 |
| >40 | 66 | 44(66.7) | ||
| 月经状态 | ||||
| 绝经前 | 29 | 15(57.1) | 3.07 | 0.080 |
| 绝经后 | 49 | 35(71.4) | ||
| 合并疾病 | ||||
| 无 | 71 | 37(63.8) | 0.01 | 0.923 |
| 有 | 7 | 13(65.0) | ||
| T分期 | ||||
| T1~T2期 | 50 | 31(62.0) | 0.27 | 0.605 |
| T3~T4期 | 28 | 19(67.9) | ||
| N分期 | ||||
| N0~N1期 | 41 | 25(61.0) | 0.37 | 0.544 |
| N2~N3期 | 37 | 25(67.6) | ||
| 临床分期 | ||||
| Ⅰ~Ⅱ期 | 29 | 18(62.1) | 0.08 | 0.773 |
| Ⅲ期 | 49 | 32(65.3) | ||
| HER2状态 | ||||
| IHC+++ | 70 | 48(68.6) | 4.18 | 0.041 |
| IHC++且FISH阳性 | 8 | 2(25.0) | ||
| 激素受体状态 | ||||
| 阴性 | 33 | 27(81.8) | 7.80 | 0.005 |
| 阳性 | 45 | 23(51.1) | ||
| Ki-67阳性指数(%) | ||||
| ≤ 30 | 35 | 24(68.6) | 0.55 | 0.458 |
| >30 | 43 | 26(60.5) | ||
| 紫杉类药物种类 | ||||
| 白蛋白结合型紫杉醇 | 47 | 34(72.3) | 4.46 | 0.035 |
| 多西他赛 | 29 | 14(48.3) |
注:HER2为人类表皮生长因子受体2;tpCR为总体病理完全缓解;IHC为免疫组织化学;FISH为荧光原位杂交;TCbHP方案为曲妥珠单抗及帕妥珠单抗联合紫杉类药物和铂类药物
78例患者tpCR率为64.1%(50/78)。亚组分析显示,HER2 IHC+++、HR阴性、应用白蛋白结合型紫杉醇患者的tpCR率分别高于HER2 IHC++且FISH+、HR阳性、应用多西他赛的患者,差异均有统计学意义(均P<0.05)(表1)。
78例患者≥3级不良反应发生率为12.8%(10/78),均为中性粒细胞减少。恶心、呕吐、脱发等不良反应均为1~2级。
78例患者既定方案完成率为92.3%(72/78),6例因不能耐受不良反应而提前终止化疗(均已完成4个周期化疗)。
真实世界的临床实践与设计严谨的临床试验之间在患者人群特征、药物种类、药物具体剂量、不良反应处理等方面存在一定的差异,因而临床试验结果可能在临床实践中有所不同。真实世界研究更能反映临床实践的实际情况,是对随机对照研究很好的补充和验证,可为临床诊疗提供更为全面的证据。
基于TRAIN-2、TRYPHAENA、KRISTINE等研究结果,TCbHP方案被多个指南推荐为HER2阳性乳腺癌新辅助治疗的首选或优选方案,3项研究的tpCR率分别为68.0%、66.2%、55.7%[3,4,5]。本研究tpCR率为64.1%,与上述研究结果相似。真实世界研究中TCbHP方案的tpCR率相差较大,国内小样本研究中TCbHP方案的tpCR率为73.9%[8],NEOPETRA研究中tpCR率仅为48.6%[9]。上述研究结果的差异可能与样本数偏少、病例选择偏倚(部分研究中HR阴性患者比例偏高)等因素有关。
本研究亚组分析发现,HER2 IHC+++患者的tpCR率高于HER2 IHC++且FISH阳性患者(P<0.05),与其他研究结果一致[10,11]。HER2蛋白表达水平影响HP新辅助靶向治疗效果的原因可能包括以下3个方面,(1)HER2 IHC+++患者肿瘤细胞的增殖高度依赖HER2信号通路:有研究发现,HER2 IHC+或++患者肿瘤细胞表面的HER2蛋白数量为50万~100万个,而HER2 IHC+++的肿瘤细胞表面约为200万个[12]。曲妥珠单抗与帕妥珠单抗分别结合HER2胞外结构域Ⅳ区及Ⅱ区,两者联合应用可同时抑制同源二聚体和异源二聚体的形成,充分阻断HER2信号转导通路,抑制肿瘤细胞增殖。(2)ER信号通路的影响:有研究发现ER通路和HER2通路之间存在相互作用,两种信号通路之间的串扰可能影响抗HER2治疗的效果[13]。多项研究表明IHC++患者的HR阳性率高于IHC+++患者。(3)基因扩增并不意味着编码蛋白的高表达:基因到编码蛋白需经历转录、翻译、修饰等复杂的过程,受到多种因素的影响。已有研究发现存在FISH阳性但HER2 IHC 0/+的现象[14]。
本研究中卡铂剂量普遍低于标准剂量,可能对治疗效果有一定的影响。但本研究患者约60%应用白蛋白结合型紫杉醇,可能在一定程度上弥补了卡铂剂量偏低对疗效的影响。GeparSepto-GBG 69研究显示,在早期乳腺癌的新辅助治疗中,应用白蛋白结合型紫杉醇比溶剂型紫杉醇能获得更高的pCR率和无浸润性疾病生存(iDFS)率[15,16]。本研究发现应用白蛋白结合型紫杉醇患者的tpCR率高于应用多西他赛的患者(P=0.035)。
本研究中HR阴性患者的tpCR率高于HR阳性患者(P=0.005),与KRISTINE研究[4]及TRYPHAENA研究[5]结果一致。KRISTINE研究中,HR阴性患者的tpCR率为71.1%,高于HR阳性患者的46.4%。TRYPHENA研究中,HR阴性患者的tpCR率为83.8%,高于HR阳性患者的50%。考虑与ER通路和HER2通路之间的串扰有关。
本研究≥3级不良反应发生率为12.8%,低于TRYPHAENA研究(46.1%)[6]及TRAIN-2研究(60%)[4],可能与本研究中多数患者采用6个周期方案及卡铂剂量普遍低于根据AUC为5或6计算的标准剂量有关。此外,真实世界临床实践中,粒细胞集落刺激因子的预防性使用和强力止吐药物的应用较为普遍,可能也是不良反应发生率及程度低于临床试验的原因之一。本研究既定方案完成率为92.3%,仅6例因不良反应不能耐受提前终止化疗。
综上所述,在真实世界的临床实践中,TCbHP方案新辅助治疗HER2阳性乳腺癌患者的效果确切,安全性及耐受性良好,可以考虑作为HER2阳性乳腺癌新辅助治疗的优选方案。但本研究样本数偏少,可能对研究结果有一定的影响。此外,随访时间较短,远期疗效仍有待进一步随访观察。
徐东宏,吴向东,张世博,等. TCbHP方案新辅助治疗人表皮生长因子受体2阳性乳腺癌的效果和安全性[J].肿瘤研究与临床,2024,36(8):590-593. DOI:10.3760/cma.j.cn115355-20230825-00068.
所有作者声明无利益冲突



























