
探讨达芬奇机器人经肛微创手术(R-TAMIS)治疗直肠肿瘤的疗效。
回顾性选取2021年1月至2024年1月解放军总医院第一医学中心行R-TAMIS并定期随访的直肠肿瘤患者,分别于术后1、2、4周随访,随后每3个月随访1次,随访时间截至2024年1月20日。观察患者围手术期情况、术后组织病理学结果、随访情况。
共纳入17例患者,男10例,女7例,年龄为35~80(59±13)岁,11例患者采用达芬奇®Si机器人完成手术,6例患者采用达芬奇®Xi机器人完成手术,手术切除肿瘤距肛缘的高度[M(Q1,Q3)]为3.5(3.0,3.8)cm;总手术时间为55.0(50.0,55.0)min,平台安装时间为32.5(30.0,35.0)min,手术操作时间为22.5(20.0,27.5)min;术中出血量为9.2(5.0,10.0)ml;术后住院天数为3.2(3.0,3.8)d;住院费用为(29 447±4 765)元。有2例接受新辅助放化疗后获得临床完全缓解的患者在术后1周出现切口裂开,直肠腔内冲洗治疗4周后痊愈。所有的手术标本完整,切缘均为阴性。共随访44(31,73)周,无局部复发及远处转移。
达芬奇机器人经肛微创局部切除术可能是一种治疗直肠肿瘤的安全、可行的方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经肛门局部切除术的可行性及安全性一直困扰外科医生师。1983年,德国Gerhard Buess发明经肛门内镜显微手术(transanal endoscopic microsurgery,TEM)操作平台,用于治疗直肠息肉及早期直肠癌[1]。2010年,Albert等[2]发明了软质的单孔腔镜平台用于直肠息肉切除,并命名为经肛微创手术(transanal minimally invasive surgery,TAMIS)。尽管TEM及TAMIS相较于传统经肛手术切除范围更广,手术效果更佳,但TEM受限于其对体位及肿瘤大小的要求[3],而TAMIS在获得相较于TEM更广阔的视野空间[4]的基础上受制于传统腹腔镜器械及有限的直肠操作空间。因此学者提出使用达芬奇机器人进行经肛门自然腔道手术[5, 6, 7],尽管机器人已广泛应用于腹部手术,但在经肛门手术中应用仍处于起步阶段[8]。2011年,Atallah等[6]在尸体上成功施行机器人经肛微创手术(robotic minimally invasive transanal surgery,R-TAMIS)后,2012年,Atallah等[9]又报告了首例R-TAMIS用于早期直肠癌的治疗,国内外学者陆续对该手术方式进行探索。尽管国外已有所研究,但由于费用高昂,且无专用操作平台,目前国内对该研究的开展较少,其相关疗效及不良事件发生率尚不明确,本研究则是对肛门机器人手术的可行性、安全性的进一步探索。
本研究为病例系列研究,回顾性选取2021年1月至2024年1月于解放军总医院第一医学中心行R-TAMIS并定期随访的患者为研究对象。本研究遵循《赫尔辛基宣言》对伦理的一般要求,通过中国人民解放军总医院伦理委员会审批(审批号:S2022-207-01),所有患者接受本研究前均签署知情同意书。
1. 纳入标准:(1)年龄≥18周岁;(2)体弱、合并重大疾病或保肛意愿强烈者;(3)直肠腺瘤,直径≤3 cm,距肛缘≤15 cm,病理示腺瘤性息肉、直肠神经内分泌瘤,高级别上皮内瘤变,浸润深度黏膜下层及以上;(4)直肠癌,直径≤3 cm,距肛缘≤15 cm,直肠超声内镜、盆腔增强CT、直肠增强MRI示临床分期≤cT1N0M0,经消化内镜专家评估无法行内镜下切除;(5)低位直肠癌,距肛缘≤5 cm,初始评估cT1-4N0M0,接受新辅助放化疗后重新评估为≤ycT1N0M0,无淋巴结转移,无远处转移,经消化内镜专家评估无法行内镜下切除;(6)无绝对手术禁忌的伴发疾病。
2. 排除标准:(1)术前存在穿孔、出血、梗阻等;(2)孕妇;(3)确诊时远处脏器转移或腹膜种植的患者;(4)确诊时合并包括结肠在内的其他部位肿瘤的患者;(5)研究者判定其他原因不适合参加本研究的受试者;(6)临床信息不全的患者;(7)无法进行随访的患者。
1. 术前准备:术前行结肠镜、超声内镜、直肠增强MRI、胸部CT、腹部CT、肿瘤标记物等检查,所有患者均签署知情同意书,手术均由同一位高级职称的外科医师完成。
2. 手术过程:常规术前及麻醉准备后,扩开肛门至4指,置入自制肛门微创操作平台[10],连接CO2气腹机建立气腔,维持压力在8~12 mmHg(1 mmHg=0.133 kPa)。将达芬奇机器人(加利福尼亚州桑尼维尔市Intuitive Surgical,Inc公司)置于患者一侧,连接机器人镜头及2个操作臂。调整镜头使其位于12点位,2个机械臂分别在4点、8点位。应用单极电剪刀沿肿瘤周边约1 cm标记切除范围。由肿瘤一侧垂直切开黏膜,直至脂肪组织,完整切除病变。可吸收线缝合创面。将标本固定在刻度纸板上,标记切缘(图1)。患者全麻清醒后即可下地活动,进流食,无相关并发症。术后病理示T分期为T1b以上者,则行补救手术,即全直肠系膜切除术(total mesorectal excision,TME)。术后第1、2、4周随访,继续观察创面愈合情况,随后每3个月随访1次,随访时间截止至2024年1月20日。根据国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[11],对于局部切除的肿瘤,每3~6个月进行1次结肠镜、直肠增强MRI、胸腹部CT和肿瘤标志物检查。对于切除的良性疾病,患者在6个月时进行结肠镜检查,然后在1年时进行结肠镜检查。主要终点是R-TAMIS成功后直肠肿瘤的局部复发。术后随访从R-TAMIS手术当天至2024年1月20日。
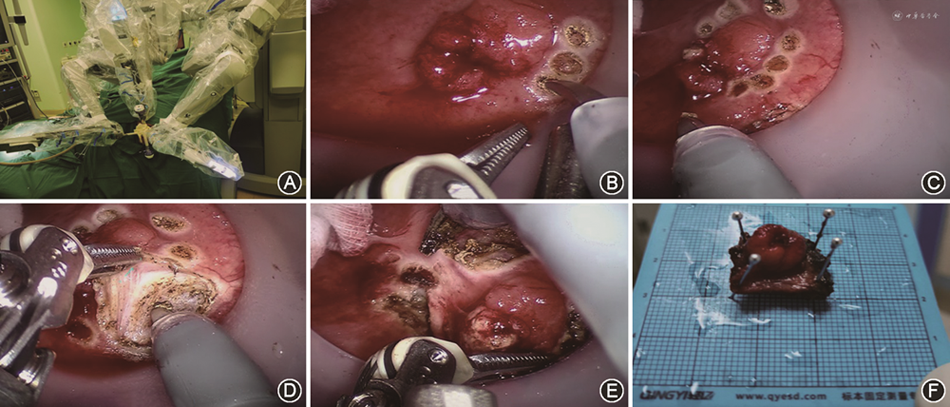

3. 观察指标:记录患者的人口统计学数据、术前诊断、肿瘤的位置及大小、手术操作系统、总手术时间(操作平台建立至手术结束的时间)、平台安装时间(操作平台的建立和机械臂连接的时间)、手术操作时间(术者在控制台操作的时间)、术中出血量、术后住院时间、住院费用、并发症、术后病理标本质量及分期、随访等资料。
应用SPSS 26.0统计软件进行分析。符合正态分布的计量资料以表示;偏态分布的计量资料以M(Q1,Q3)表示;计数资料用例表示。
共纳入17例患者,男10例,女7例,年龄为35~80(59±13)岁,11例患者采用达芬奇®Si机器人完成手术,6例患者采用达芬奇®Xi机器人完成手术,患者一般情况详见表1。
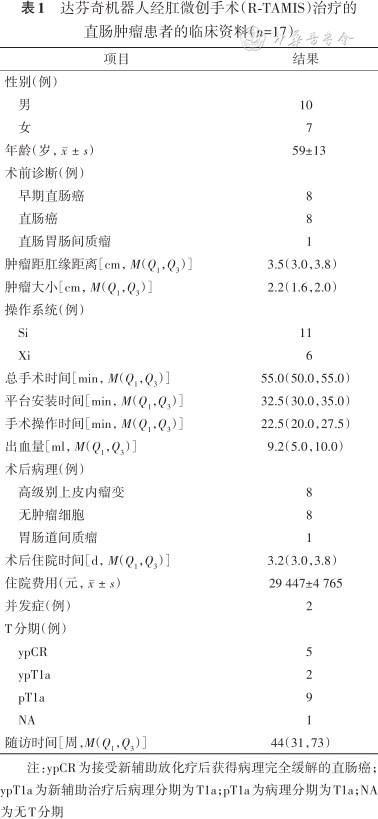
达芬奇机器人经肛微创手术(R-TAMIS)治疗的直肠肿瘤患者的临床资料(n=17)
达芬奇机器人经肛微创手术(R-TAMIS)治疗的直肠肿瘤患者的临床资料(n=17)
| 项目 | 结果 |
|---|---|
| 性别(例) | |
| 男 | 10 |
| 女 | 7 |
| 年龄(岁,) | 59±13 |
| 术前诊断(例) | |
| 早期直肠癌 | 8 |
| 直肠癌 | 8 |
| 直肠胃肠间质瘤 | 1 |
| 肿瘤距肛缘距离[cm,M(Q1,Q3)] | 3.5(3.0,3.8) |
| 肿瘤大小[cm,M(Q1,Q3)] | 2.2(1.6,2.0) |
| 操作系统(例) | |
| Si | 11 |
| Xi | 6 |
| 总手术时间[min,M(Q1,Q3)] | 55.0(50.0,55.0) |
| 平台安装时间[min,M(Q1,Q3)] | 32.5(30.0,35.0) |
| 手术操作时间[min,M(Q1,Q3)] | 22.5(20.0,27.5) |
| 出血量[ml,M(Q1,Q3)] | 9.2(5.0,10.0) |
| 术后病理(例) | |
| 高级别上皮内瘤变 | 8 |
| 无肿瘤细胞 | 8 |
| 胃肠道间质瘤 | 1 |
| 术后住院时间[d,M(Q1,Q3)] | 3.2(3.0,3.8) |
| 住院费用(元,) | 29 447±4 765 |
| 并发症(例) | 2 |
| T分期(例) | |
| ypCR | 5 |
| ypT1a | 2 |
| pT1a | 9 |
| NA | 1 |
| 随访时间[周,M(Q1,Q3)] | 44(31,73) |
注:ypCR为接受新辅助放化疗后获得病理完全缓解的直肠癌;ypT1a为新辅助治疗后病理分期为T1a;pT1a为病理分期为T1a;NA为无T分期
肿瘤距肛缘的高度为3.5(3.0,3.8)cm,肿瘤大小为2.2(1.6,2.0)cm,总手术时间为55.0(50.0,55.0)min,平台安装时间为32.5(30.0,35.0)min,手术操作时间为22.5(20.0,27.5)min,术中出血量为9.2(5.0,10.0)ml,无中转手术的患者,所有患者均顺利出院,术后住院天数为3.2(3.0,3.8)d,住院费用为(29 447±4 765)元。接受新辅助放化疗(neodajuvant chemoradiotherapy,NCRT)后获得临床完全缓解(clinical complete remission,cCR)的2例患者,术后1周时其手术创面裂开,给予直肠腔内冲洗治疗4周后,复查结肠镜提示创面痊愈。
17例患者中,高级别上皮内瘤变8例,直肠癌病理完全缓解(pathological complete response,pCR)8例,直肠胃肠间质瘤1例,所有手术标本均显示完整,切缘均为阴性。
随访44(31,73)周,无出血、穿孔、尿潴留、肠梗阻等严重并发症,无局部复发和远处转移。
本团队前期已成功应用达芬奇®Si和Xi机器人进行了多例R-TAMIS治疗直肠肿瘤[10,12]。迄今为止,本研究是国内文献中数量较多的机器人经肛门手术入路临床经验的报道。
目前,本团队应用达芬奇®Si/Xi机器人平台,共完成了17例R-TAMIS。术中发现总手术时间的长短主要取决于平台建立及机械臂连接时间,而术者操作时间相对稳定。本研究中,总手术时间为55.0(50.0,55.0)min,其中平台安装时间为32.5(30.0,35.0)min,手术操作时间为22.5(20.0,27.5)min。Hompes等[5]对16例R-TAMIS围手术期情况进行了报道,与平台安装时间36.0(18.0,75.0)min相比,手术时间108.0(40.0,180.0)min多于平台安装时间;该研究与本研究结果相反,考虑可能与研究者对各操作时间的定义、计算时间起止的方法以及是否有专用操作平台有关。本研究中手术标本均完整,切缘均为阴性,仅2例直肠癌患者在术后1周创面裂开。这与Jakobsen等[13]报道的切缘阳性率及并发症发生率相似。患者术后平均住院时间为3.2(3.0,3.8)d,术后随访无局部复发及远处转移。本研究进一步表明,R-TAMIS是安全、可行的。
TME手术是直肠癌手术的金标准,但其高并发症和功能减退问题促使外科医师寻求更个性化的治疗方法[14, 15]。一直以来,消化内科医师积极倡导超级微创手术原则之一,即为保器官、保功能[16]。R-TAMIS因其精准度和低并发症率,特别适用于T1a直肠癌的治疗[14]。有研究显示,5.4%~11.0%的切除术标本不完整或切缘阳性,局部复发率为6%~7%[17, 18, 19, 20, 21]。机器人具有3D清晰的手术视野、多个操作维度,使手术变得更加精细,避免标本破碎的发生。本研究中标本均完整,切缘均阴性,随访44(31,73)周,无局部复发和远处转移,提示R-TAMIS在切除良性直肠肿瘤和早期直肠癌上是安全有效的。局部进展期直肠癌患者在接受NCRT后,约有36%的患者达到cCR,15%~27%患者达到病理完全缓解[22, 23, 24],75%的cCR患者未达到完全缓解[25, 26, 27],完整切除病变并对其进行病理学检查是评估NCRT效果的金标准。R-TAMIS切除病变以确定TME手术之前的患者的T分期[28],则是超级微创理念的具体体现。
R-TAMIS在直肠手术领域的应用,特别是Tomassi等[29]在深达14 cm的上段直肠区域进行R-TAMIS,填补了腹腔镜与结肠镜治疗直肠疾病的“空白区”;而且R-TAMIS能够在不调整患者体位的情况下完成各象限手术,这是其相较于传统腹腔镜手术的优势;此外,直肠肿瘤的全层切除,需要在狭小、有限的空间内,能够进行多角度操作。
R-TAMIS的机器人平台的特点是使外科医师在狭窄直肠腔的限制下,较容易地进行复杂的手术,这是腹腔镜器械无法实现的[5,6,9,28, 29, 30]。EndoWrist™的运动可提高机械壁腔内灵活性,使术者能够在有限的空间内从病变周围任何一处进行切除,提高了外科医师肛门肿瘤切除的精准度[6,9,29]。达芬奇®SP机器人使操作平台及机器臂碰撞等问题迎刃而解[31, 32];特别是软体机器人(the Flex® Robotic System)[33, 34]将打破消化内科与结直肠外科的部分界限,进一步深化超级微创理念[35]。
综上,本研究成功应用达芬奇机器人完成17例R-TAMIS手术,证实该术式安全可行,具有操作舒适、标本质量高、并发症低等优点。机器人经肛微创手术适用于直肠肿瘤切除,特别是T1a直肠癌,且机器人平台的特点使其在狭窄直肠腔内较容易地进行复杂手术。本研究为回顾性研究,可能会导致研究结果出现偏倚性,后续将扩大病例样本量进行前瞻性研究。
邹贵军, 马睿, 刘晓雅, 等. 达芬奇机器人经肛微创手术治疗直肠肿瘤的疗效[J]. 中华医学杂志, 2024, 104(35): 3328-3333. DOI: 10.3760/cma.j.cn112137-20240421-00944.
所有作者声明不存在利益冲突



























