
自闭症谱系障碍(ASD)是一种常见于儿童的复杂神经发育障碍疾病,其特征包括社交互动障碍、沟通困难和重复性行为等。近年来对于ASD与肠道菌群失衡之间关系进行了一系列研究,发现正常发育个体与ASD患者在肠道菌群组成上的差异较为显著。本文综述了ASD患者肠道菌群的特征,并讨论了ASD患者肠道菌群失衡对小胶质细胞介导的免疫系统的影响,以及肠道菌群代谢物通过微生物-肠-脑轴对中枢神经系统的影响,从而增加了ASD疾病的易感性。此外,基于肠道菌群对ASD干预策略,主要是针对粪菌移植在ASD的干预和治疗中的研究进展进行讨论,为ASD早期干预和治疗提供新思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自闭症谱系障碍(ASD)是一种发生在儿童时期的神经发育障碍,发病率逐年上升。其病因复杂,遗传因素、环境因素及免疫因素均可能是ASD的潜在发病原因。肠道菌群与ASD之间存在密切联系,并受到广泛的关注。肠道菌群是存在于哺乳动物肠道中的复杂的微生物群落[1]。在生命体中,肠道菌群和中枢神经系统(CNS)间通过微生物-肠-脑(MGB)轴联系影响CNS的发育及神经系统的功能,从而诱发CNS相关的疾病[2, 3]。有大量研究证实,ASD患者的肠道菌群在数量和多样性上与正常发育个体存在显著差异[4]。近年来,研究者一直致力于探索如何通过调整肠道菌群来对ASD进行早期干预和治疗。粪菌移植(FMT)作为一种干预策略,其通过恢复肠道菌群平衡,对改善ASD相关症状可能具有积极作用[5]。此外,研究发现通过调节MGB轴的相互作用可能对ASD的发展具有重要影响。这些研究成果为开发ASD的新治疗策略提供了理论基础。
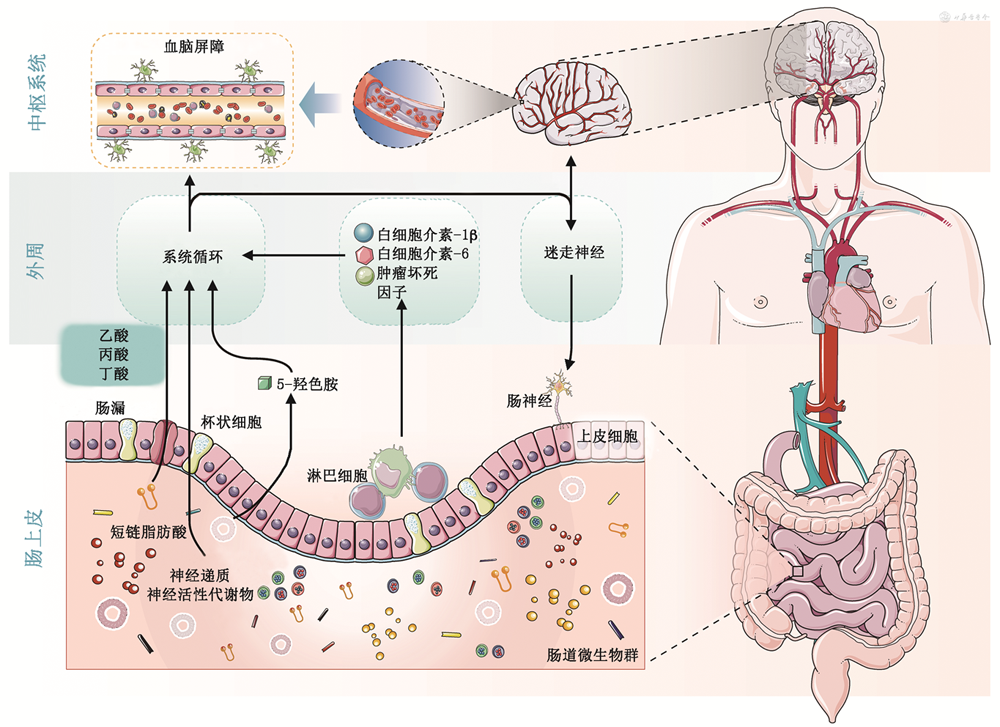
在人的肠道内存在着大量的微生物,包括细菌、真菌、病毒、古细菌等,数量可达10万亿个,重量相当于人体肝脏(约1.2 kg),其基因数目约为人体自身的100倍。因此肠道菌群被称为“人体的第二基因组”,ASD患者患有肠道功能异常相关症状的发病率超过91%,远远高于正常个体[6]。研究发现,ASD患者和正常发育个体肠道菌群存在很大的差异[7]。相较正常个体,ASD患者的肠道菌群丰度增加,在门水平包括拟杆菌门、厚壁菌门、变形菌门、无壁菌门;属水平包括拟杆菌属、副拟杆菌属、粪杆菌属、梭状芽孢杆菌、考拉杆菌属等。部分肠道菌群的丰度有减少,在门水平主要为放线菌门、厚壁菌门等;在属水平包括粪球菌属、双歧杆菌属等[6]。无差异的微生物菌群,在门水平包括蓝藻、梭杆菌门、疣状微生物等;在属水平包括布劳特氏菌属等。这些结果表明ASD患者体内的肠道菌群处于失衡状态,益生菌有所下降[6]。肠道菌群失衡会出现胃肠道功能的紊乱,同时也诱发小胶质细胞功能失调,引发免疫异常及神经炎症[8]。
在ASD患者中肠道菌群的失衡对CNS的生长发育有显著的影响。Vargas等[9]通过ASD死者大脑病理解剖研究发现,ASD患者的整个大脑皮层和小脑小胶质细胞过度增殖,CNS表现异常的免疫反应,出现神经炎症。CNS是从胚胎时期开始发育(大概3周时),小胶质细胞作为CNS中的常驻细胞,在发育早期可释放一些神经营养因子,从而调节神经元的增殖、分化和凋亡[10]。小胶质细胞的生长发育受到局部微环境的变化的影响,当小胶质细胞处于“静息状态”,可参与神经系统的发育过程,如髓鞘的形成等[11]。但当外周环境发生变化或局部损伤产生炎症时,如肠道菌群的失衡,小胶质细胞的成熟及其功能发挥受到严重影响[12]。肠道菌群的失衡可改变外周环境的发生,通过血脑屏障(BBB)进入CNS[13, 14],小胶质细胞可快速感知这些变化,释放炎症因子[如白细胞介素(IL)-6、肿瘤坏死因子α、IL1β、γ干扰素等],从而介导神经炎症[15, 16]。此外,小胶质细胞增殖后具备吞噬功能,主要分为M1和M2型两种形态,M1型主要是产生神经炎症,M2型主要是通过IL-4或者IL-13的存在而被激活,从而产生免疫反应[17]。通过使用抗炎剂如木犀草素和地司敏来抑制IL-6的活性,可减轻ASD小鼠模型子代的自闭行为,这项研究也证实了神经炎症会导致自闭样行为[18]。Davoli-Ferreira等[11]在ASD患者的大脑皮质区,特别是白质区,发现小胶质细胞活性异常增高。这些结果证实了肠道菌群失调会导致小胶质细胞功能的异常,从而导致免疫反应和神经炎症,二者均为诱导ASD的潜在因素。
在日常生活中,肠道菌群通过人体食物代谢产生多种生物活性化合物,包括短链脂肪酸(SCFAs)、胆汁酸、内毒素、氨类物质、酚类物质等[19, 20],这些物质通过MGB轴和大脑相互连通,从而影响CNS的功能。其中SCFAs,包括丁酸、丙酸、乙酸、戊酸等,存在于肠道中并维持肠道内免疫系统的平衡,与ASD的关系比较密切[21]。当肠道菌群失衡时,会导致SCFAs内各成分的失衡,继而引发外周环境的变化,从而影响CNS。研究发现,丁酸水平的升高可以抑制组蛋白去乙酰化酶(HDAC)的活性,通过MUC-2基因表达调节肠道的黏膜蛋白。此外,当丁酸盐通过BBB进入到CNS中,会抑制HDAC在各种神经元中的活性,从而影响胶质细胞的成熟。Wang等[22]通过构建宫内发育迟缓大鼠模型,验证了由肠道菌群失衡引起AHR/NF-κB信号失调介导了由咖啡因暴露引起的大鼠模型的海马小胶质细胞的过度激活从而引起免疫反应,诱发自闭样行为。Meng等[23]发现,ASD患儿体内的跨膜蛋白59的表达水平有所下降,影响小胶质细胞的功能,从而改变神经元活动,使大脑发育异常引起自闭样行为。这些证据证明肠道菌群失衡产生的代谢物的水平失衡均可以导致ASD的易感性升高。
肠道菌群失衡除了产生代谢产物通过小胶质细胞影响CNS以外,还可以通过迷走神经依赖的方式影响神经系统功能,肠道菌群会释放一些神经递质,如全血清素、多巴胺、γ氨基丁酸等。这些神经递质均可以通过迷走神经影响大脑的功能,从而引发神经系统疾病[24, 25, 26]。在既往的研究中,证实了乳酸菌属鼠李糖乳杆菌介导迷走神经可以改善焦虑样行为[27]。Sgritta等[28]通过双侧膈下迷走神经切断术验证了肠道菌群可以通过迷走神经改善自闭样行为。因此,肠道菌群的平衡对于神经发育和行为表现至关重要,成为干预治疗ASD的潜在策略(图1)。

FMT是一种干预策略,通过将筛选后的供体粪便微生物转移至患者体内,以重建患者肠道菌群[29]。这种方法可以通过胶囊、鼻胃管或灌肠等多种途径实施。在中国FMT的历史可追溯至4世纪,葛洪当时为治疗腹泻患者采用了“黄汤”[30]。这种干预策略在中国历史上持续了数百年,并在16世纪由李时珍进行了记载。FMT在现代的应用始于1958年,一位美国医师通过此技术成功治疗了4例患者,临床表现均是艰难梭菌感染。自此之后,FMT被广泛研究并应用于临床治疗,涵盖自身免疫性疾病、慢性胃肠道疾病以及代谢性疾病等。FMT对于平衡肠道菌群起着至关重要的作用,在神经系统疾病的治疗方面也具有潜在的应用前景[31]。例如帕金森病和多发性硬化的患者在接受FMT后,症状有所改善,进一步支持了FMT的积极效果[32]。
Li等[33]对中国西南地区的40例ASD患儿进行了FMT治疗,并进行了8周的随访调查,发现在FMT治疗后,ASD患者的胃肠道功能有所改善,相关的胃肠道功能的评级都展示了比较好的结果。此外患儿的自闭样行为也有所缓解(例如行为、情绪、行为等),但在社交技能上,在随访的第8~12周时发生逆转,与此同时胃肠道功能改善的效果也从12周开始下降[33]。Kang等[34]针对ASD患者开发了一种特定的FMT方案(在FMT治疗的前期先让患者口服万古霉素),对亚利桑那州的18例ASD患儿进行干预,这些患儿在接受了多次供体微生物群的FMT治疗后,胃肠道症状及ASD相关症状均得到显著改善。此外,患者的肠道菌群结构也出现了改善,特别是某些有益细菌的数量有所增加。患儿的行为症状也得到改善。在之后2年的随访中,这些患儿表现出良好的耐受性和持续的功能改善[35]。在ASD模型中也有FMT治疗的相关研究,Kang等[34]在ASD模型鼠中检测到了肠道菌群结构的变化,特别是乳酸菌属的丰度显著降低。通过将健康小鼠的粪便移植到ASD模型鼠中,乳酸菌属的水平得到改善,进而缓解了这些模型鼠的恐惧和自闭样行为。另有研究表明,FMT后ASD模型鼠的AKK菌的丰度增加,同时大脑中的炎症因子水平下降,自闭样行为有所减缓[36]。
综上,尽管FMT已被认为是治疗ASD及其伴随的胃肠道症状的有希望的方法,但这项技术在临床应用中仍面临一系列挑战[37]。主要的问题包括确保治疗的安全性,比如防止病原体传播和处理供体材料的安全性问题,以及FMT的作用机制尚不完全清晰,这影响了治疗的普遍接受和应用。此外,FMT的长期效果和潜在不良反应还没有得到充分的研究和文献支持,这增加了在更广泛临床环境中应用的复杂性。因此,需要更多的临床试验的推进和对治疗参数的优化,以及更加深入的机制研究,从而为患者提供更多的治疗选择和更好的治疗结果。
郭雅倩, 杨颖, 王艺伟, 等. 自闭症患者肠道菌群失衡研究进展[J]. 中华医学杂志, 2024, 104(35): 3363-3366. DOI: 10.3760/cma.j.cn112137-20240507-01063.
所有作者声明不存在利益冲突



























