
探讨心脏外科手术患者术后肺炎(POP)的危险因素。
回顾性队列研究。纳入2020年11月—2021年10月南京鼓楼医院心胸外科行心脏手术的1 107例患者的临床资料,其中男711、女396,年龄32~77[59(51,68)]岁。根据患者是否发生POP分为2组:POP组105,非POP组1 002例。观察指标:(1)分析心脏手术后患者POP的发病情况,比较2组患者的病死率。(2)纳入年龄、性别、体质量指数、术前营养不良、吸烟史、脑卒中史、合并高血压、合并糖尿病、序贯器官衰竭评分(SOFA)≥1分、射血分数、纽约心脏病协会(NYHA)分级Ⅲ/Ⅳ级、是否微创手术、手术类型(包括瓣膜手术、冠状动脉旁路移植术、主动脉手术及瓣膜手术联合冠状动脉旁路移植术)、体外循环时间、术中输血、术后机械通气时间、术后有无急性肾衰竭、重症监护室住院时间等因素,应用logistic回归分析筛选心脏外科手术患者POP的独立危险因素。
(1)心脏手术后患者POP的发生率为9.5%(105/1 107);POP组患者的病死率为15.2%(16/105),高于非POP组患者的病死率(1.1%,11/1 002),差异有统计学意义(χ2=70.41,P<0.001)。(2)单因素分析显示,2组患者年龄、术前营养不良、合并糖尿病、脑卒中史、SOFA≥1分、NYHA Ⅲ级或Ⅳ级、手术类型、体外循环时间、术中输血、术后急性肾衰竭、机械通气时间比较,差异均有统计学意义(P值均<0.05)。进一步多因素logistic回归分析结果显示,年龄>55岁(OR=4.107,95%CI:2.084~8.096,P<0.001)、术前营养不良(OR=4.681,95%CI:2.451~8.940,P<0.001)、合并糖尿病(OR=1.962,95%CI:1.048~3.673,P=0.035)、主动脉手术(OR=11.342,95%CI:5.064~25.401,P<0.001)、体外循环时间>135 min(OR=2.977,95%CI:1.726~5.136,P<0.001)和机械通气时间>20 h(OR=4.369,95%CI:2.610~7.312,P<0.001)是心脏外科手术后发生POP的独立危险因素。
心脏外科手术患者POP的发生率较高,且病死率高达15.2%;其发生与多种危险因素相关,年龄较大、术前营养不良、合并糖尿病、主动脉手术、体外循环和机械通气时间较长都是影响POP发生的独立危险因素,需要充分重视。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
术后肺炎(postoperative pneumonia,POP)是心脏外科手术患者术后最常见的院内感染,患病率达2%~20%,尤其是在术后第1周[1]。合并POP会增加疾病治疗难度,影响患者预后,病死率升高,还可能会增加ICU接诊量、患者再住院率、患者医疗费用和医疗资源消耗等,因此,学者们为确定心脏外科手术后肺炎的危险因素做了大量研究[1, 2, 3, 4, 5]。年龄、高血压、机械通气时间、体外循环时间、输血等都是心脏手术POP众所周知的危险因素[2, 3, 4]。了解POP的危险因素有助于制定更有效的预防策略,是早期识别、有针对性地预防和治疗,进而改善心血管手术患者的术后恢复和生活质量的重要依据。然而,耐药菌的出现和流行显著增加了POP的发生风险,患者的临床特征也各不相同[6];随着手术和麻醉技术的巨大进步,患者的基线特征和共病发生了很大的变化[6, 7];此外,心力衰竭住院患者中普遍存在营养不良,增加了患者再入院的风险,该因素却很少被纳入POP的相关研究中。近年来,关于这一课题的新的较大样本研究较少,鉴于此,本研究回顾性分析了1 107例心脏手术患者的临床资料,旨在对心脏手术患者POP的相关危险因素做进一步深入的探讨。
纳入标准:(1)行开胸体外循环心脏手术的患者,包括主动脉瓣置换术、二尖瓣置换术、二尖瓣置换术+主动脉瓣置换术、主动脉手术+主动脉瓣置换术、孤立性冠状动脉旁路移植术(coronary artery bypass graft,CABG)、瓣膜手术+CABG手术、胸主动脉手术等;(2)18~80岁的成年患者。排除标准:(1)术前已有明确感染,如体温≥38 ℃或白细胞计数超过正常上限;(2)有感染性心内膜炎、肺炎或任何传染病者;(3)有免疫疾病或结缔组织疾病者;(4)孕妇或哺乳期妇女;(5)临床资料记录不完善者。
回顾性队列研究。纳入2020年11月—2021年10月南京鼓楼医院心胸外科行心脏外科手术的1 107例患者的临床资料。其中,男711例、女396例,年龄32~77[59(51,68)]岁,瓣膜手术553例、CABG 197例、主动脉手术235例、瓣膜手术联合CABG 122例。根据患者术后是否发生POP分为2组:POP组105例和非POP组1 002例。
本研究获得南京鼓楼医院伦理委员会批准(2020-249-01),患者均签署手术知情同意书。
患者取平卧位,持续心电监测,静脉复合麻醉。建立体外循环:显露心脏,分开主动脉与肺动脉的间隙,露出上下腔静脉;切断上下腔静脉并插入引流管,将插管与人工心肺机连接。主动脉手术即对病变的主动脉进行切除、修补或替换,以治疗主动脉夹层、主动脉瘤等主要病变;瓣膜病则用生物瓣或机械瓣替代心脏瓣膜行心脏瓣膜置换术。
根据《术后肺炎预防和控制专家共识》将POP定义为手术后30 d内出现的肺部感染,其确诊标准必须同时符合以下3个条件[8]。(1)2次及以上的胸部X线片检查(如有呼吸窘迫综合征等肺部基础病变,1次检查即可),发现下列特征之一:新生或进展性肺部浸润阴影,实变,空洞形成。(2)满足下列特征之一:发热体温>38 ℃,白细胞计数>12×109 /L或<4×109 /L,70周岁以上无其他明显病因的老年患者出现神志改变。(3)同时具备下列2个条件:出现新的脓痰或痰液性质改变,呼吸道的分泌物增多;新出现的咳嗽、呼吸困难或呼吸频率更高,原有的咳嗽、呼吸困难或呼吸短促症状加重,出现肺部啰音或支气管呼吸音,气体交换状况变差,需要提高氧气的需求,需要辅助机械通气。
通过医院管理信息系统,从住院病历、手术记录、术后护理记录中收集患者以下信息:年龄、性别、BMI、术前营养不良、吸烟史、合并高血压、合并糖尿病、脑卒中史、序贯器官衰竭评分(sepsis-related organ failure assessment,SOFA)≥1分、射血分数、纽约心脏病学会(New York Heart Association,NYHA)分级Ⅲ/Ⅳ级、是否采用微创手术(包括右腋小切口和左、右前外侧切口)、手术类型(包括瓣膜手术、CABG、主动脉手术以及瓣膜手术联合CABG)、体外循环时间、术中是否输血、术后30 d内有无急性肾衰竭、术后机械通气时间、重症监护室住院时间。将以上因素纳入logistic 回归分析,逐步筛选心脏手术后患者POP的危险因素。
应用R 4.2.1软件进行数据分析。不服从正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。分类资料以例(%)表示,采用χ2检验。采用单因素、多因素logistic回归分析法分析POP的危险因素。以P<0.05为差异有统计学意义。
1 107例患者中POP的发生率为9.5%(105/1 107)。住院期间,POP患者病死率为15.2%(16/105),无POP患者病死率为1.1%(11/1 002),差异有统计学意义(χ2=70.41,P<0.001)。
结果显示,2组患者年龄、术前营养不良、合并糖尿病、脑卒中史、SOFA≥1分、NYHA Ⅲ/Ⅳ级、手术类型、体外循环时间、术中输血、术后急性肾衰竭、术后机械通气持续时间比较,差异均有统计学意义(P值均<0.05);2组患者性别、BMI、吸烟史、射血分数、微创手术、重症监护室住院时间比较,差异均无统计学意义(P值均>0.05)。见表1。
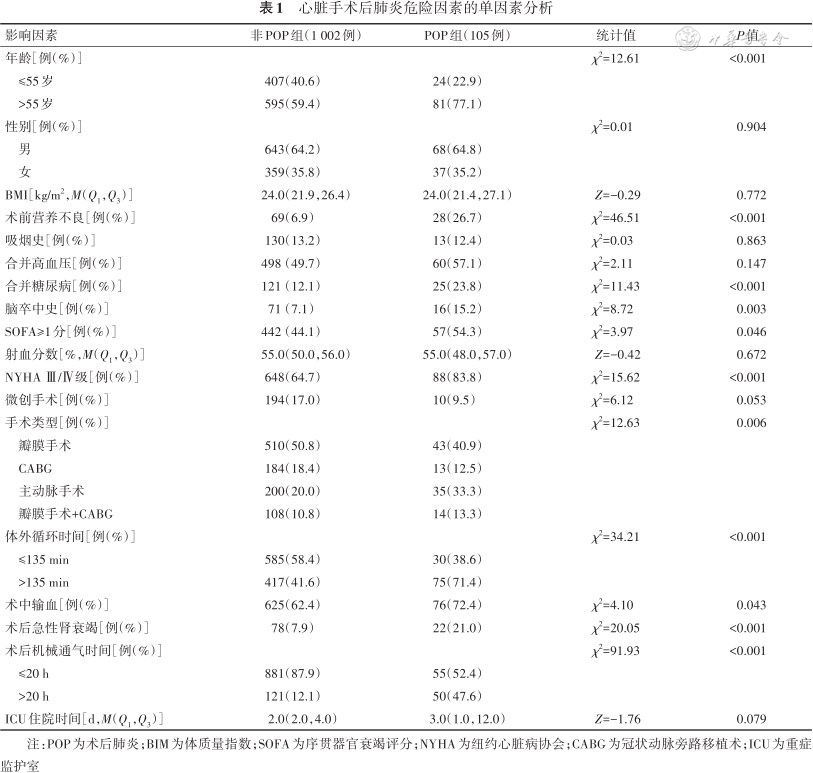
心脏手术后肺炎危险因素的单因素分析
心脏手术后肺炎危险因素的单因素分析
| 影响因素 | 非POP组(1 002例) | POP组(105例) | 统计值 | P值 |
|---|---|---|---|---|
| 年龄[例(%)] | χ2=12.61 | <0.001 | ||
| ≤55岁 | 407(40.6) | 24(22.9) | ||
| >55岁 | 595(59.4) | 81(77.1) | ||
| 性别[例(%)] | χ2=0.01 | 0.904 | ||
| 男 | 643(64.2) | 68(64.8) | ||
| 女 | 359(35.8) | 37(35.2) | ||
| BMI[kg/m2,M(Q1,Q3)] | 24.0(21.9,26.4) | 24.0(21.4,27.1) | Z=-0.29 | 0.772 |
| 术前营养不良[例(%)] | 69(6.9) | 28(26.7) | χ2=46.51 | <0.001 |
| 吸烟史[例(%)] | 130(13.2) | 13(12.4) | χ2=0.03 | 0.863 |
| 合并高血压[例(%)] | 498(49.7) | 60(57.1) | χ2=2.11 | 0.147 |
| 合并糖尿病[例(%)] | 121(12.1) | 25(23.8) | χ2=11.43 | <0.001 |
| 脑卒中史[例(%)] | 71(7.1) | 16(15.2) | χ2=8.72 | 0.003 |
| SOFA≥1分[例(%)] | 442(44.1) | 57(54.3) | χ2=3.97 | 0.046 |
| 射血分数[%,M(Q1,Q3)] | 55.0(50.0,56.0) | 55.0(48.0,57.0) | Z=-0.42 | 0.672 |
| NYHA Ⅲ/Ⅳ级[例(%)] | 648(64.7) | 88(83.8) | χ2=15.62 | <0.001 |
| 微创手术[例(%)] | 194(17.0) | 10(9.5) | χ2=6.12 | 0.053 |
| 手术类型[例(%)] | χ2=12.63 | 0.006 | ||
| 瓣膜手术 | 510(50.8) | 43(40.9) | ||
| CABG | 184(18.4) | 13(12.5) | ||
| 主动脉手术 | 200(20.0) | 35(33.3) | ||
| 瓣膜手术+CABG | 108(10.8) | 14(13.3) | ||
| 体外循环时间[例(%)] | χ2=34.21 | <0.001 | ||
| ≤135 min | 585(58.4) | 30(38.6) | ||
| >135 min | 417(41.6) | 75(71.4) | ||
| 术中输血[例(%)] | 625(62.4) | 76(72.4) | χ2=4.10 | 0.043 |
| 术后急性肾衰竭[例(%)] | 78(7.9) | 22(21.0) | χ2=20.05 | <0.001 |
| 术后机械通气时间[例(%)] | χ2=91.93 | <0.001 | ||
| ≤20 h | 881(87.9) | 55(52.4) | ||
| >20 h | 121(12.1) | 50(47.6) | ||
| ICU住院时间[d,M(Q1,Q3)] | 2.0(2.0,4.0) | 3.0(1.0,12.0) | Z=-1.76 | 0.079 |
注:POP为术后肺炎;BIM为体质量指数;SOFA为序贯器官衰竭评分;NYHA为纽约心脏病协会;CABG为冠状动脉旁路移植术;ICU为重症监护室
结果显示,年龄>55岁、术前营养不良、合并糖尿病、主动脉手术、体外循环时间>135 min和术后机械通气时间>20 h是POP的独立危险因素。见表2。
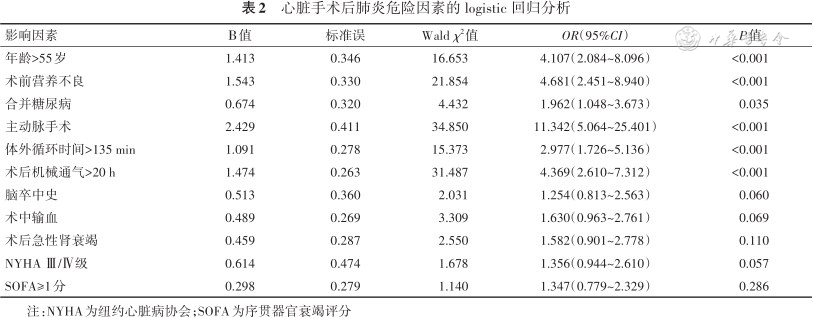
心脏手术后肺炎危险因素的 logistic 回归分析
心脏手术后肺炎危险因素的 logistic 回归分析
| 影响因素 | Β值 | 标准误 | Wald χ2值 | OR(95%CI) | P值 |
|---|---|---|---|---|---|
| 年龄>55岁 | 1.413 | 0.346 | 16.653 | 4.107(2.084~8.096) | <0.001 |
| 术前营养不良 | 1.543 | 0.330 | 21.854 | 4.681(2.451~8.940) | <0.001 |
| 合并糖尿病 | 0.674 | 0.320 | 4.432 | 1.962(1.048~3.673) | 0.035 |
| 主动脉手术 | 2.429 | 0.411 | 34.850 | 11.342(5.064~25.401) | <0.001 |
| 体外循环时间>135 min | 1.091 | 0.278 | 15.373 | 2.977(1.726~5.136) | <0.001 |
| 术后机械通气>20 h | 1.474 | 0.263 | 31.487 | 4.369(2.610~7.312) | <0.001 |
| 脑卒中史 | 0.513 | 0.360 | 2.031 | 1.254(0.813~2.563) | 0.060 |
| 术中输血 | 0.489 | 0.269 | 3.309 | 1.630(0.963~2.761) | 0.069 |
| 术后急性肾衰竭 | 0.459 | 0.287 | 2.550 | 1.582(0.901~2.778) | 0.110 |
| NYHA Ⅲ/Ⅳ级 | 0.614 | 0.474 | 1.678 | 1.356(0.944~2.610) | 0.057 |
| SOFA≥1分 | 0.298 | 0.279 | 1.140 | 1.347(0.779~2.329) | 0.286 |
注:NYHA为纽约心脏病协会;SOFA为序贯器官衰竭评分
POP被认为是导致心脏手术后患者死亡的一个重要原因,以往各家报道的心脏外科手术POP的发病率有很大的不同,为2%~20%[1, 2, 3, 4, 5]。在本研究中,心脏外科手术后患者POP的发生率为9.5%(105/1 107),在文献报道的范围内;POP组患者病死率为15.2%(16/105),高于无POP组患者的1.1%(11/1 002),与文献报告相近[5]。POP患者高病死率和术后急性肾衰竭等不良预后的显著增加,凸显了识别预测因子和高危患者的重要性,因此尽早诊断POP十分重要。
POP的发生与多种因素关系密切。我们的研究结果显示,患者年龄>55岁、术前营养不良、合并糖尿病、主动脉手术、体外循环时间>135 min和术后机械通气时间>20 h都是POP的独立危险因素。Ailawadi等[1]通过一项多中心前瞻性临床研究发现,心脏外科术后患者POP的发病与年龄相关,且存在量效关系。老年人群因衰老而出现多种器官功能病变,自身抵抗力及免疫力降低,增加了POP的发病概率。术前营养不良是心脏手术患者POP的独立危险因素之一,之前很少被纳入POP的相关研究中。Chermesh等[9]研究表明,营养不良的心脏病患者群体中术后病程复杂和重症监护室住院时间延长,这些因素会导致POP。所以,早期诊断和评估患者的营养状况,并积极有效地进行营养治疗,是提高心脏外科手术患者预后的关键。糖尿病患者的促炎症因子显著升高,对内皮造成破坏,进而引起肺血管的渗透性增强,引起肺部的结构与功能变化,从而损害了肺部的通气和弥散能力,引起了致病细菌的大量积聚[10]。Strobel等[7]的研究发现,糖尿病患者在接受CABG治疗后,发生POP的风险增加了1.3倍;Wang等[11]报道,糖尿病患者心脏手术后发生POP的风险增加到1.4倍,而在瓣膜置换患者的风险增加到2.1倍。因此,血糖控制对降低POP和其他不良结局的风险有重要意义。
由于不同的手术方式、手术时间和不同疾病的复杂性,不同手术类型之间的各种术后并发症的风险、住院时间和术后死亡的风险可能存在很大差异[11, 12]。主动脉手术是导致患者发生POP的一个重要原因,相对于单纯心脏手术,手术难度更大,手术时间也更长,比其他手术类型发生POP等术后并发症的风险要高得多。Hortal等[13]通过研究发现,升主动脉外科手术是POP的独立危险因子,其危险性比其他心血管手术高6.2倍。在Wang等[11]的分析中,斯坦福A型主动脉夹层后发生POP的概率为34.6%,在Yao等[14]的研究中高达36.9%。
研究表明,体外循环时间是POP的危险因素[1, 2, 3]。我们研究发现,体外循环持续135 min以上是心脏手术POP的独立危险因素,其原因可能是体外循环时间过长导致多个系统损伤。体外循环引起的缺血再灌注损伤及系统性炎性反应使肺顺应性降低,也是造成肺功能不全的重要原因;另外,由于血液成分与管路的接触,会不同程度地激发机体炎症反应[2, 3]。体外循环时间每增加1 min,POP风险就会增加1%[15]。体外循环在很多心脏手术中都是不可避免的,而降低术后并发症的发生率可以通过缩短体外循环时间达到。
在心脏外科手术中,应用呼吸机及机械通气是维持生命的重要手段,但持续的呼吸机辅助呼吸可导致POP的发生[16, 17, 18]。应用气管插管及机械通气可引起呼吸道黏膜组织的异常变化,造成呼吸道固有的屏障功能障碍,引起咳嗽反射下降、呕吐反应减退、纤毛动力下降、呼吸道黏膜屏障受损等,从而导致POP的发展。在我们研究中,POP组患者平均机械通气时间为19 h,非POP组中为8 h,机械通气时间越长,POP发生率越高。既往报道显示,每增加24 h的机械通气,POP的风险就会增加1%~3%,当满足拔管条件时,应尽快拔除气管插管[16, 17, 18]。此外,延长机械通气可导致膈肌萎缩[19],同样增加POP的风险,影响患者预后。因此,应密切关注患者呼吸功能的恢复状况,实施严格的通气策略,以缩短机械通气时间,改善预后。
在以往的研究中也报道了心脏手术后POP的其他一些独立危险因素,如NYHA Ⅳ级和术中输血。Hortal等[20]在多变量回归分析中发现,术前NYHA Ⅳ级被确定为心脏手术后POP的独立危险因素,可导致POP的风险增加2.2倍。Likosky等[21]研究发现,在CABG中,术中输血患者术后发生POP的风险增加3.4倍,且每增加1个单位的红细胞,风险就会显著增加,因此要尽量控制围术期失血量。本研究中单因素分析结果显示,非POP组和POP组患者的脑卒中、NYHA Ⅲ/Ⅳ级、SOFA≥1分、术中输血、术后急性肾衰竭比较,差异均有统计学意义,说明这些因素均有可能影响POP的发生,但需要更多样本进一步验证。
综上,心脏外科手术患者POP发生率较高(9.5%,105/1 107),且病死率高达15.2%(16/105);患者年龄较大、术前营养不良、有糖尿病史、主动脉手术、体外循环和术后机械通气时间较长都是影响其发生的独立危险因素。对于存在POP风险的患者,临床医师可以预先制定方案进行干预,如术前进行呼吸物理治疗和声门下分泌物引流[22, 23],积极、系统地进行术前口腔护理包括刷牙[24],均能有效降低POP的发生率及病死率。我们的研究也有一些局限性,数据来自单中心数据库,患者来源、样本量及心脏外科手术类型都有限,不排除可能存在选择偏倚;未来需要设计前瞻性、大样本的研究,以获得更准确的研究数据。
王阔, 范志伟, 王东进. 心脏外科手术后肺炎的危险因素分析[J]. 中华解剖与临床杂志, 2024, 29(9): 597-602. DOI: 10.3760/cma.j.cn101202-20240326-00109.
所有作者声明不存在利益冲突



























