
分析阿尔茨海默病(AD)和轻度认知障碍(MCI)患者脑电特征,并结合特征进行分类预测。
选取天津医科大学总医院神经内科就诊患者135例为研究对象,其中AD患者34例,MCI患者67例,健康对照(HC)34例,分别采集静息状态下脑电信号并进行预处理。提取多频段尺度的相对功率谱密度特征和样本熵特征,比较3组被试脑电特征的全脑差异,然后再细分脑区、单个导联深入分析。融合上述2种特征,通过支持向量机(SVM)对AD、MCI和HC进行分类预测。
额叶区域δ相对功率谱密度高于其他区域,枕叶和颞叶区域表现出相对更低的分布占比。θ频段相对功率谱密度在各个脑区的大小分布情况较为平均。α频段相对功率谱密度较高的导联均集中于枕叶。β频段的相对功率谱密度较高的导联则主要集中在顶叶和颞叶。除中央叶外,其余各个脑区及全脑,AD组的δ频段相对功率谱密度值均高于MCI组和HC组(均P<0.05、0.01)。AD组全脑及各个脑区的θ频段相对功率谱密度高于MCI组和HC组(均P<0.001)。AD组的α频段相对功率谱密度仅在颞叶低于其他组(均P<0.05)。AD组β频段的相对功率谱密度在全脑及各脑区高于其他组(P<0.05、0.01、0.001)。AD组与HC组中央叶的C3导联的δ频段相对功率谱密度差异比较有统计学意义(P<0.05)。AD组、MCI组和HC组颞叶γ频段相对功率谱密度均高于其他区域。AD组T3导联处γ频段相对功率谱密度明显低于T4导联处。AD组和MCI组的全脑平均及各个脑区平均样本熵均低于HC组(均P<0.05)。AD组C3导联处的样本熵低于MCI组(P<0.05)。相对功率谱密度、样本熵以及融合2种特征的实际数据分类评价指标(准确率、精确率、召回率和F1分数)与重排数据差异均有统计学意义(均P<0.001);当分类特征中融合了相对功率谱密度特征及样本熵特征时,分类预测效果最好,准确率达80%,精确率达78%,召回率为78%,F1分数为79%。
相对功率谱密度与样本熵分析能够从不同角度(线性与非线性)揭示AD、MCI患者脑电活动的异常,在分类预测时结合相对功率谱密度和样本熵特征,能够提高分类效果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
阿尔茨海默病(Alzheimer’s disease,AD)是一种以进行性记忆力减退、认知功能下降和人格改变为主要临床表现的中枢神经系统退行性疾病,其患病率会随年龄的增长逐渐上升,是老龄人口中发病率最高的疾病之一[1]。AD患者往往不具备正常的生活能力,给家庭、医疗系统甚至整个社会,造成了一系列负担[2]。目前,AD的发病机制尚不明确,且无特异性治疗手段。因此,AD患者的早期诊断具有重要的意义。轻度认知障碍(mild cognitive impairment,MCI)的特征是认知能力下降超出了与年龄和教育水平相匹配的正常范围,但未明显干扰日常生活活动[3]。MCI是介于健康对照(healthy control,HC)和AD的一种中间状态,MCI患者发展为痴呆的患病率是其相同年龄正常人的10倍[4]。对MCI的研究将有利于AD的早期干预和治疗。AD诊断的黄金标准是美国国家老龄化研究所和阿尔茨海默病协会于2018年提出AD患者体内生物标志物[如β淀粉样蛋白(β amyloid peptide,Aβ)、Tau蛋白]的改变[5]。然而,这种方法需要通过腰椎穿刺或正电子发射断层检查来完成,有创,费用昂贵,且高度依赖临床基础设施,显著限制了其在临床实践中的可用性。目前临床上应用较多的AD诊断方法是基于量表的早期筛查[6]。这种方法用于诊断AD,简单易行,但主观性较强,患者的受教育程度和医生的判断能力都会影响诊断的准确性。而脑电图(electroencephalogram,EEG)作为一种低成本、非侵入性的便携式技术,具有较高的时间分辨率,能够综合反映脑神经系统电生理活动的总体作用及功能状态,目前已经成为AD与MCI临床辅助诊断的一个重要工具[7]。
脑电功率谱算法将幅度随时间变化的脑波信号转换为功率随频率变化的谱图,可以直观地观察到脑电节律的变化与分布。Gaubert等[8]发现与HC组相比,AD患者脑电θ和δ频段活性增加、α和β频段活性降低。Baker等[9]发现MCI患者与HC组相比,同样出现了θ频段绝对功率升高的现象,并且AD患者的θ频段绝对功率高于MCI患者。功率谱分析虽然可以在一定程度上刻画脑电活动特征,用其方法提取的生物标志物在AD与MCI的诊断中也具有不错的特异性和敏感性,但由于EEG信号具有非线性动力学特征,而功率谱密度分析作为一种线性的分析方法,难以全面揭示大脑活动的本质特征。样本熵算法作为一种非线性的分析方法,可以用来反映EEG信号的复杂性或不规则程度。
本研究从线性与非线性2种角度,分别对AD组、MCI组和HC组受试者的静息态EEG信号进行相对功率谱密度与样本熵分析,通过组间比较,分析探讨AD与MCI患者的脑电特征,并通过支持向量机(support vector machine,SVM),融合相对功率谱密度和样本熵特征,对AD、MCI和HC进行分类,有望为临床提供AD和MCI的客观性鉴别及诊断依据。
所有研究对象(135例)均来自天津医科大学总医院神经内科就诊患者。本研究经天津医科大学总医院医学伦理委员会批准(伦理审批号IRB 2024-YX-019-01),所有受试者均知情同意。其中,AD患者34例,男18例,女16例,年龄(65.00±5.48)岁,受教育年限(12.83±3.11)年;MCI患者67例,男38例,女29例,年龄(63.00±7.32)岁,受教育年限(12.53±2.04)年;与患者年龄相匹配的HC 34例,男18例,女16例,年龄(62.00±3.24)岁,受教育年限(11.38±3.19)年。各组在年龄、性别和受教育年限方面比较差异均无统计学意义(均P>0.05)。AD组和MCI组的划分是根据2018年美国国家老龄化研究所AD的诊断标准[10]。
入组标准:AD组脑脊液Aβ检测呈现Aβ42降低,磷酸化tau检测tau蛋白增高;简易智能状态检查量表(mini-mental state examination,MMSE)评分<24分,蒙特利尔认知评估量表(montreal cognitive assessment scale,MoCA)评分<19分;MCI组MMSE评分24~27分,MoCA评分19~25分;HC组不存在主观及客观认知功能减退,并且MMSE评分≥28分,MoCA评分≥26分。
排除标准:(1)存在脑血管疾病、焦虑抑郁所致的假性痴呆以及其他严重疾病;(2)使用抗精神病药、抗抑郁药、多巴胺阻滞剂等药物;(3)存在酗酒、脑外伤等。
本研究方法流程见图1。
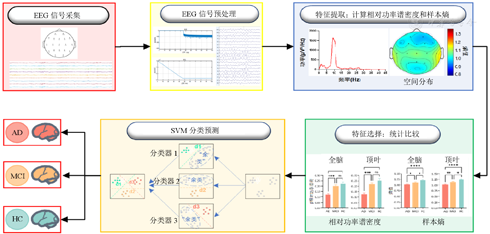

注:EEG—脑电图;AD—阿尔茨海默病;MCI—轻度认知障碍;HC—健康对照;SVM—支持向量机
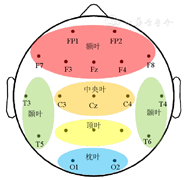
EEG信号采集使用日本光电Neurofax2130型32导数字化脑电系统。电极安放位置按照国际标准导联10~20电极系统,实验中记录19导头皮EEG信号。将19导电极分为5个脑区,额叶(FP1、FP2、F3、F4、F7、F8、Fz)、颞叶(T3、T4、T5、T6)、顶叶(P3、P4、Pz)、枕叶(O1、O2)和中央叶(C3、C4、Cz)。电极空间分布及脑区划分示意图见图2。

以Cz作为参考电极,采样率为200 Hz,A/D转换精度为12 bit,电极阻抗小于5 kΩ。记录各组被试在安静闭目状态下的19导脑电信号,选取其中无明显干扰且基线平稳的240 s信号进行分析。本研究所有信号处理均基于Matlab(2023a)软件自编程序完成。脑电信号预处理包括带通滤波(滤波范围1~45 Hz),陷波50 Hz工频干扰,去除基线漂移;并手动去除明显伪迹。在本研究中,将脑电频率划分为δ(1~4 Hz)、θ(4~8 Hz)、α(8~13 Hz)、β(13~30 Hz)、γ(30~45 Hz)5个频段进行分析。
本研究对预处理后的脑电信号采用Welch周期图法估计EEG功率谱密度,采用Hanning窗,窗宽1 s,兼顾频率分辨率的同时,得到具有较小方差的频谱估计[11]。基于得到的功率谱密度,分别计算各个频带的相对功率谱密度。相对功率谱密度衡量的是第i个频段的功率谱密度之和与全部频段的功率谱密度之和的比值,如下式所示:
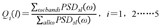
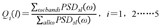
其中,Qi(l)为数据l在频段i的相对功率谱密度,PSDsl(ω)为采用Welch周期图法求得的脑电信号l的绝对功率谱密度,ω为频率。
样本熵算法是在近似熵算法的基础上改进而来的。
将分段后长度(N)为1 000的脑电时间序列{x(i)∶(1≤i≤N)},按照顺序排列成一组m维矢量。
Xm(i)={x(i),x(i+1)……x(i+m-1)},i=1,2……N-m+1
 定义为任意矢量Xm(i)与Xm(j)之间距离小于r的概率,计算公式如下:
定义为任意矢量Xm(i)与Xm(j)之间距离小于r的概率,计算公式如下:
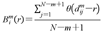
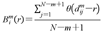
其中,θ(x)为阶跃函数,r为容限,m为嵌入维度, 是矢量Xm(i)与Xm(j)之间的距离,计算公式如下:
是矢量Xm(i)与Xm(j)之间的距离,计算公式如下:
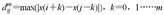
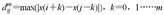
对所有 求平均,得到模板匹配总数Bm(r),计算公式如下:
求平均,得到模板匹配总数Bm(r),计算公式如下:
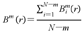
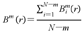
当嵌入维数提高到m+1时,模板匹配总数为:
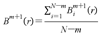
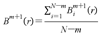
此时,原EEG时间序列的样本熵(SampEn)为:
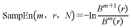
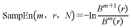
其中,SampEn为样本熵,其值受N、r和m的影响,r的推荐取值范围为0.1×SD~0.2×SD,其中SD为原数据的标准差,N建议为1 000[12]。因此,本研究选择N=1 000,r=0.2×SD,m=1。
SVM是一种基于结构风险最小化思想,按监督学习的方式对数据进行二元分类或多元分类的广义线性分类器[13]。SVM的工作原理是在特征空间中寻找类别间距离最大的一个超平面,该平面由不同类之间最近的点组成的支持向量来决定。多分类SVM是在二分类SVM的基础上得来的,常用的方法有一类对一类法和一类对余类法[14]。对M类数据分类问题,前者则对每两类构造一个SVM,共需M(M-1)/2个分类器,后者通过构造M个SVM分别将各个类与剩余的类分开。
本研究采用一类对余类法,基于AD、MCI和HC的组间相对功率谱密度、组间样本熵的统计比较结果,将其中对上述3组进行两两比较,至少有一对差异具有统计学意义的项作为分类特征(共得到102项分类特征,其中相对功率谱特征77项、样本熵特征25项)。
将数据集按7∶3随机分为训练集和测试集。根据已知的分类结果,定义AD的标签为1,MCI为2,HC为3。在训练分类模型时,选择径向基函数作为核函数,使用分类集训练分类模型。基于训练好的分类模型,对测试集进行分类预测,并应用准确率、精确率、召回率和F1分数4种模型评估指标,对模型进行评估[15]。为保证分类结果的有效性及排除数据选取对分类结果的影响,设置数据集1(实际数据,分类特征与标签对应),进行999次随机划分选取训练集和测试集;数据集2(重排数据,分类特征与标签随机打乱重排,重排次数999次)。
在选择分类特征时分为以下3种情况:仅选择相对功率谱密度特征、仅选择样本熵特征以及同时结合上述2类特征,对上述3种分类特征选择情况分别建立SVM分类预测模型,来对AD、MCI和HC组进行分类。
应用Graphpad Prism 9.3软件进行数据处理,对AD、MCI和HC的全脑、分脑区和各导联的各频段相对功率谱密度值以及样本熵值进行One-way ANOVA分析;对每组的T3与T4导联处γ频段相对功率谱值进行Paired t检验分析。对实际数据和重排数据的SVM分类结果采用two-way ANOVA分析。计量数据均采用均数±标准差( ±s)表示。以P<0.05为差异具有统计学意义。
±s)表示。以P<0.05为差异具有统计学意义。
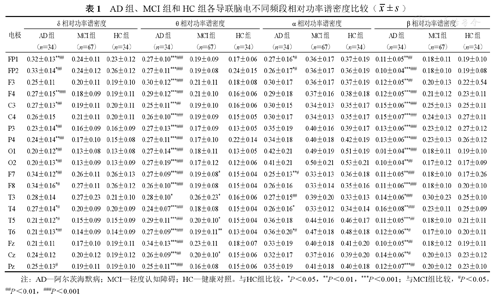
由表1可知,AD组与HC组中央叶的δ相对功率谱密度差异比较无统计学意义(均P>0.05),但位于中央叶的C3导联差异比较却有统计学意义(P<0.05);AD组与MCI组、HC组额叶的α相对功率谱密度差异比较均无统计学意义(均P>0.05),但FP1、FP2、F7导联差异比较有统计学意义(P<0.05、0.01)。
AD组、MCI组和HC组各导联脑电不同频段相对功率谱密度比较( ±s)
±s)
AD组、MCI组和HC组各导联脑电不同频段相对功率谱密度比较( ±s)
±s)
| 电极 | δ相对功率谱密度 | θ相对功率谱密度 | α相对功率谱密度 | β相对功率谱密度 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AD组(n=34) | MCI组(n=67) | HC组(n=34) | AD组(n=34) | MCI组(n=67) | HC组(n=34) | AD组(n=34) | MCI组(n=67) | HC组(n=34) | AD组(n=34) | MCI组(n=67) | HC组(n=34) | |
| FP1 | 0.32±0.13**## | 0.24±0.11 | 0.23±0.12 | 0.27±0.10*** | 0.19±0.09 | 0.17±0.06 | 0.27±0.16*# | 0.36±0.17 | 0.37±0.19 | 0.11±0.05**## | 0.18±0.11 | 0.19±0.10 |
| FP2 | 0.33±0.14*## | 0.24±0.12 | 0.26±0.12 | 0.27±0.11*** | 0.19±0.08 | 0.24±0.15 | 0.26±0.17*# | 0.36±0.17 | 0.36±0.19 | 0.10±0.04*** | 0.18±0.10 | 0.19±0.08 |
| F3 | 0.25±0.11 | 0.20±0.11 | 0.19±0.10 | 0.30±0.12*** | 0.21±0.11 | 0.18±0.08 | 0.30±0.17 | 0.36±0.17 | 0.37±0.19 | 0.12±0.05**## | 0.20±0.13 | 0.22±0.54 |
| F4 | 0.27±0.15** | 0.18±0.09 | 0.19±0.11 | 0.29±0.12*** | 0.21±0.10 | 0.16±0.06 | 0.29±0.18 | 0.37±0.16 | 0.38±0.18 | 0.12±0.05*** | 0.21±0.12 | 0.23±0.11 |
| C3 | 0.27±0.13*## | 0.19±0.11 | 0.20±0.11 | 0.25±0.11***## | 0.19±0.10 | 0.16±0.06 | 0.30±0.15 | 0.34±0.13 | 0.35±0.17 | 0.15±0.06*** | 0.25±0.13 | 0.25±0.11 |
| C4 | 0.26±0.15 | 0.21±0.11 | 0.20±0.11 | 0.26±0.10*** | 0.19±0.09 | 0.15±0.05 | 0.30±0.17 | 0.34±0.13 | 0.35±0.17 | 0.15±0.07*** | 0.24±0.13 | 0.27±0.11 |
| P3 | 0.23±0.14*## | 0.16±0.09 | 0.16±0.09 | 0.27±0.13*** | 0.17±0.09 | 0.13±0.05 | 0.35±0.19 | 0.40±0.16 | 0.39±0.17 | 0.13±0.06*** | 0.23±0.12 | 0.27±0.12 |
| P4 | 0.24±0.14**## | 0.17±0.10 | 0.15±0.08 | 0.27±0.11*** | 0.17±0.10 | 0.22±0.14 | 0.34±0.18 | 0.40±0.18 | 0.42±0.19 | 0.13±0.06*** | 0.23±0.13 | 0.26±0.12 |
| O1 | 0.20±0.12*## | 0.13±0.08 | 0.13±0.08 | 0.27±0.14***### | 0.18±0.11 | 0.13±0.05 | 0.42±0.21 | 0.49±0.19 | 0.51±0.19 | 0.01±0.04***### | 0.18±0.11 | 0.19±0.10 |
| O2 | 0.20±0.13*## | 0.13±0.09 | 0.13±0.09 | 0.27±0.19***### | 0.17±0.12 | 0.12±0.06 | 0.41±0.21 | 0.50±0.21 | 0.53±0.21 | 0.10±0.04**## | 0.17±0.12 | 0.17±0.09 |
| F7 | 0.34±0.12*## | 0.26±0.11 | 0.26±0.13 | 0.27±0.09***### | 0.19±0.08* | 0.15±0.04 | 0.25±0.13**# | 0.33±0.13 | 0.36±0.18 | 0.11±0.05**### | 0.18±0.10 | 0.17±0.26 |
| F8 | 0.34±0.16*# | 0.27±0.11 | 0.26±0.12 | 0.26±0.10***### | 0.19±0.08 | 0.15±0.04 | 0.26±0.16 | 0.33±0.14 | 0.35±0.16 | 0.11±0.06***### | 0.18±0.10 | 0.20±0.10 |
| T3 | 0.28±0.14 | 0.27±0.23 | 0.21±0.10 | 0.28±0.10* | 0.26±0.23* | 0.16±0.06 | 0.27±0.15## | 0.39±0.20 | 0.33±0.13 | 0.14±0.06*### | 0.30±0.23 | 0.25±0.10 |
| T4 | 0.27±0.14*# | 0.20±0.09 | 0.20±0.09 | 0.24±0.07***### | 0.18±0.08 | 0.15±0.04 | 0.26±0.16* | 0.33±0.12 | 0.34±0.14 | 0.16±0.08**### | 0.23±0.11 | 0.25±0.09 |
| T5 | 0.21±0.12*# | 0.15±0.09 | 0.15±0.09 | 0.29±0.11***### | 0.20±0.10* | 0.15±0.04 | 0.36±0.18 | 0.44±0.16 | 0.46±0.17 | 0.11±0.05***## | 0.18±0.10 | 0.21±0.11 |
| T6 | 0.21±0.13*## | 0.14±0.09 | 0.14±0.09 | 0.27±0.09***### | 0.19±0.11** | 0.13±0.04 | 0.36±0.20*# | 0.47±0.18 | 0.48±0.18 | 0.12±0.06**# | 0.17±0.10 | 0.20±0.11 |
| Fz | 0.21±0.11 | 0.17±0.10 | 0.19±0.11 | 0.34±0.13***### | 0.23±0.11 | 0.18±0.07 | 0.33±0.19 | 0.40±0.18 | 0.41±0.20 | 0.10±0.05**## | 0.18±0.12 | 0.19±0.11 |
| Cz | 0.24±0.12 | 0.20±0.12 | 0.19±0.12 | 0.26±0.09***## | 0.20±0.10* | 0.15±0.06 | 0.32±0.17 | 0.37±0.16 | 0.39±0.20 | 0.14±0.06**# | 0.20±0.13 | 0.23±0.12 |
| Pz | 0.25±0.13# | 0.19±0.11 | 0.19±0.10 | 0.25±0.11***### | 0.16±0.08 | 0.15±0.06 | 0.35±0.19 | 0.41±0.18 | 0.40±0.18 | 0.12±0.07***## | 0.20±0.12 | 0.23±0.10 |
注:AD—阿尔茨海默病;MCI—轻度认知障碍;HC—健康对照。与HC组比较,*P<0.05,**P<0.01,***P<0.001;与MCI组比较,#P<0.05,##P<0.01,###P<0.001
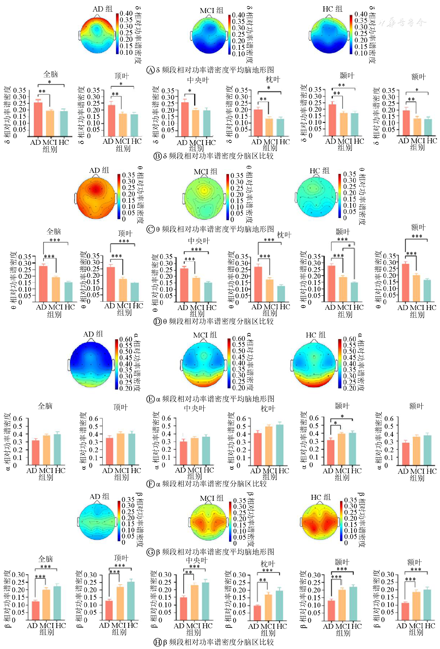
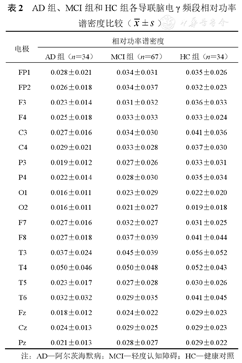
由图3A可知,AD组、MCI组和HC组额叶区域δ相对功率谱密度高于其他区域,枕叶和颞叶区域表现出相对更低的分布占比。由图3B可知,除中央叶外,其余各个脑区及全脑,AD组的δ频段相对功率谱密度值均高于MCI组和HC组(均P<0.05、0.01)。由图3C可知,θ频段相对功率谱密度在各个脑区的大小分布情况较为平均。由图3D可知,AD组全脑及各个脑区的θ频段相对功率谱密度高于MCI组和HC组(均P<0.001);而MCI组和HC组之间,除颞叶之外(P<0.05),其他各脑区及全脑差异无统计学意义(均P>0.05)。由图3E可知,AD组、MCI组和HC组α频段相对功率谱密度较高的导联均集中于枕叶。由图3F可知,AD组的α频段相对功率谱密度仅在颞叶低于其他组(均P<0.05),而在全脑及其他脑区,3组间差异比较无统计学意义(均P>0.05)。由图3G可知,β频段的相对功率谱密度较高的导联则主要集中在顶叶和颞叶。由图3H可知,AD组β频段的相对功率谱密度在全脑及各脑区高于其他组(P<0.05、0.01、0.001),MCI组和HC组间差异比较无统计学意义(均P>0.05)。
 ±s)
±s)
注:蓝色表示最小相对功率谱密度,红色表示最大相对功率谱密度;AD—阿尔茨海默病;MCI—轻度认知障碍;HC—健康对照。*P<0.05,**P<0.01,***P<0.001
 ±s)
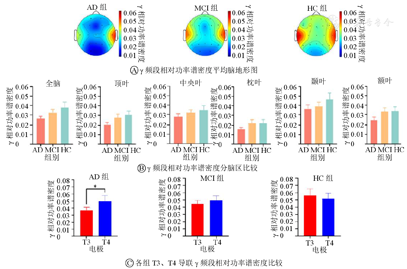
±s)由表2可知,3组的所有导联相对功率谱密度之间比较差异均无统计学意义(均P>0.05)。由图4A可知,AD组、MCI组和HC组颞叶γ频段相对功率谱密度均高于其他区域。由图4B可知,无论是全脑还是分脑区,3组中两两之间差异比较均无统计学意义(均P>0.05)。但从地形图可以发现AD组T3导联处γ频段相对功率谱密度明显低于T4导联处。于是进一步分别对每组T3、T4导联γ频段相对功率谱密度进行paired t检验,由图4C可知,AD组T3、T4导联γ频段相对功率谱密度差异比较有统计学意义(P<0.05)。
AD组、MCI组和HC组各导联脑电γ频段相对功率谱密度比较( ±s)
±s)
AD组、MCI组和HC组各导联脑电γ频段相对功率谱密度比较( ±s)
±s)
| 电极 | 相对功率谱密度 | ||
|---|---|---|---|
| AD组(n=34) | MCI组(n=67) | HC组(n=34) | |
| FP1 | 0.028±0.021 | 0.034±0.031 | 0.035±0.026 |
| FP2 | 0.026±0.018 | 0.034±0.037 | 0.032±0.023 |
| F3 | 0.023±0.014 | 0.031±0.032 | 0.036±0.033 |
| F4 | 0.025±0.018 | 0.033±0.033 | 0.033±0.024 |
| C3 | 0.027±0.016 | 0.034±0.030 | 0.041±0.036 |
| C4 | 0.029±0.021 | 0.033±0.028 | 0.037±0.030 |
| P3 | 0.019±0.012 | 0.027±0.026 | 0.033±0.031 |
| P4 | 0.022±0.014 | 0.028±0.030 | 0.035±0.034 |
| O1 | 0.016±0.011 | 0.023±0.029 | 0.022±0.020 |
| O2 | 0.016±0.011 | 0.021±0.027 | 0.019±0.018 |
| F7 | 0.027±0.016 | 0.032±0.027 | 0.031±0.025 |
| F8 | 0.027±0.018 | 0.037±0.039 | 0.041±0.044 |
| T3 | 0.037±0.024 | 0.045±0.039 | 0.056±0.052 |
| T4 | 0.050±0.046 | 0.050±0.048 | 0.052±0.043 |
| T5 | 0.023±0.017 | 0.027±0.028 | 0.030±0.026 |
| T6 | 0.032±0.032 | 0.029±0.035 | 0.041±0.045 |
| Fz | 0.018±0.012 | 0.024±0.022 | 0.029±0.023 |
| Cz | 0.024±0.013 | 0.029±0.025 | 0.029±0.023 |
| Pz | 0.021±0.013 | 0.028±0.027 | 0.029±0.022 |
注:AD—阿尔茨海默病;MCI—轻度认知障碍;HC—健康对照
 ±s)
±s)
注:蓝色表示最小相对功率谱密度,红色表示最大相对功率谱密度;AD—阿尔茨海默病;MCI—轻度认知障碍;HC—健康对照。*P<0.05
 ±s)
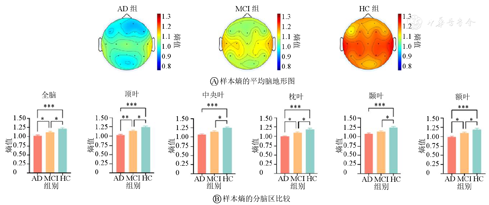
±s)由图5A可知,与HC组相比,AD组和MCI组全脑熵值均较低,且MCI组的熵值高于AD组。无论是AD、MCI患者,还是HC组,颞叶及中央叶熵值较高,额叶的熵值较低,并且左右脑熵值具有对称性。
 ±s)
±s)
注:蓝色表示最小熵值,红色表示最大熵值;AD—阿尔茨海默病;MCI—轻度认知障碍;HC—健康对照。*P<0.05,**P<0.01,***P<0.001
 ±s)
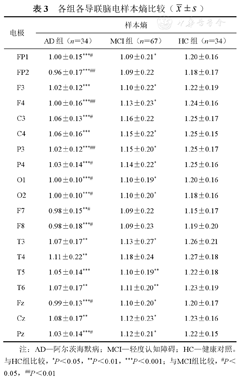
±s)由图5B可知,AD组和MCI组的全脑平均及各个脑区平均样本熵均低于HC组(均P<0.05、0.001),并且除中央叶和颞叶外(均P>0.05),AD组低于MCI组(P<0.05、0.01)。由表3可知,虽然位于中央叶的所有导联的平均样本熵在AD与MCI组之间差异均无统计学意义(均P>0.05),但AD组C3导联处的样本熵却低于MCI组(P<0.05)。
各组各导联脑电样本熵比较( ±s)
±s)
各组各导联脑电样本熵比较( ±s)
±s)
| 电极 | 样本熵 | ||
|---|---|---|---|
| AD组(n=34) | MCI组(n=67) | HC组(n=34) | |
| FP1 | 1.00±0.15***# | 1.09±0.21* | 1.20±0.16 |
| FP2 | 0.96±0.17***## | 1.09±0.22 | 1.18±0.17 |
| F3 | 1.02±0.12*** | 1.10±0.22* | 1.22±0.19 |
| F4 | 1.00±0.16***## | 1.13±0.23* | 1.24±0.16 |
| C3 | 1.06±0.13***# | 1.16±0.22 | 1.25±0.17 |
| C4 | 1.06±0.16*** | 1.15±0.22* | 1.25±0.15 |
| P3 | 1.02±0.12***## | 1.15±0.20* | 1.25±0.17 |
| P4 | 1.03±0.14***# | 1.14±0.22* | 1.25±0.16 |
| O1 | 1.00±0.10***# | 1.10±0.19* | 1.20±0.16 |
| O2 | 1.00±0.10***# | 1.10±0.20* | 1.18±0.16 |
| F7 | 0.98±0.15**# | 1.09±0.22 | 1.15±0.17 |
| F8 | 0.98±0.18***# | 1.09±0.23 | 1.19±0.20 |
| T3 | 1.07±0.17** | 1.13±0.27* | 1.26±0.21 |
| T4 | 1.11±0.22** | 1.18±0.24 | 1.27±0.18 |
| T5 | 1.05±0.14*** | 1.10±0.19** | 1.22±0.18 |
| T6 | 1.07±0.17** | 1.11±0.20** | 1.23±0.19 |
| Fz | 0.99±0.13***# | 1.10±0.20* | 1.20±0.17 |
| Cz | 1.08±0.17** | 1.12±0.23* | 1.23±0.16 |
| Pz | 1.03±0.14***# | 1.12±0.21* | 1.22±0.15 |
注:AD—阿尔茨海默病;MCI—轻度认知障碍;HC—健康对照。与HC组比较,*P<0.05,**P<0.01,***P<0.001;与MCI组比较,#P<0.05,##P<0.01
如图6所示,相对功率谱密度、样本熵以及融合2种特征的实际数据分类评价指标(准确率、精确率、召回率和F1分数)与重排数据差异均有统计学意义(均P<0.001),提示3种情况均能对AD、MCI和HC进行分类;进一步研究发现同时使用相对功率谱密度特征和样本熵特征的分类效果优于单独使用其中某一类特征时的分类效果(均P<0.05)。当分类特征中融合了相对功率谱密度特征及样本熵特征时,分类预测效果最好,准确率达80%,精确率达78%,召回率为78%,F1分数为79%。
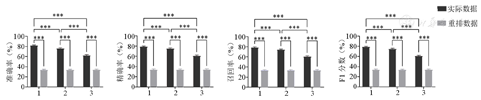
 ±s)
±s)
注:1—相对功率谱密度+样本熵;2—相对功率谱密度;3—样本熵;实际数据表示分类特征与组别类型标签对应,重排数据表示分类特征与组别类型标签随机打乱重排。***P<0.001
 ±s)
±s)本研究对34例AD患者、67例MCI患者、34例HC 19导联静息状态下的脑电信号,采用相对功率谱密度和样本熵2种方法,寻找AD、MCI患者异常的脑电特征,并通过三分类SVM算法,融合相对功率谱密度和样本熵2种特征对AD、MCI和HC组进行分类。
相对功率谱密度分析结果显示:AD组全脑及绝大部分脑区(除中央叶的δ频段外)的δ、θ频段相对功率谱密度均高于MCI组与HC组;同时,全脑及所有脑区的β频段相对功率谱密度均低于MCI组与HC组,与文献报道内容一致[16,17,18]。这种改变可能与AD患者的基底前脑胆碱能神经元萎缩有关[19]。α节律的活动被认为与认知功能下降相关,Jelic等[20]发现AD患者额叶、颞叶、顶叶和枕叶的α相对功率谱密度均小于HC。在本研究中,AD组的α相对功率谱密度仅在颞叶及分布于额叶的部分导联(FP1、FP2、F7)处低于MCI和HC组(P<0.05),在全脑及其他脑区差异无统计学意义(P>0.05)。这种差异可能与被试的病情、数量以及相对能量的计算方法有关。
γ节律常见于许多大脑区域,与记忆和注意力等认知功能相关,并被认为是老年人认知能力下降的标志物[21,22]。同时,异常的γ频带活动常与神经疾病有关[23,24]。本研究发现,AD组T3、T4导联处的γ相对功率谱密度存在差异,而在MCI和HC组,则未发现类似情况,这种现象可能与AD患者颞叶的异常电活动有关。
本研究还发现,对于相对功率谱密度分析,MCI组与HC组之间仅颞叶区θ相对功率谱密度差异具有统计学意义(P<0.05);位于优势半球颞叶区的所有导联(T3、T5)均高于HC组对应位置处(P<0.05)。说明MCI组优势半球脑电活动,尤其是颞叶较HC组的改变更为显著。颞叶是负责社会性信息加工的主要脑区之一,θ频段振荡增加通常与认知功能的下降有关,上述差异可能反映了MCI进展相关的潜在神经病理学改变[25]。
熵作为一种衡量时间序列中新信息发生率的非线性动力学参数,能够衡量时间序列的动力学行为的复杂性。样本熵分析结果显示,随着认知功能的降低,静息态脑电信号的样本熵值亦出现同向改变(AD<MCI<HC),说明脑电信号样本熵值的改变可以从一定角度反映大脑功能的变化。相对功率谱分析并未能够找到太多MCI组脑电活动的异常,而通过样本熵分析则发现,MCI组全脑及各个脑区的样本熵值均低于HC组。这说明样本熵分析能够从脑电信号的非线性动力学角度反映出相对功率谱分析所不能刻画的脑电活动特性。另外从地形图可以看出无论是AD、MCI患者,还是HC组,额叶区熵值均较低。Hogan等[26]对不同认知能力不同的被试静息态脑电进行熵分析,发现熵值对于信息处理需求的增加十分敏感,当被试处于静息态时,额叶熵值较低,且与认知能力呈正相关,这与本研究结果相符。
本研究基于提取到的相对功率谱密度特征和样本熵特征,应用SVM算法从单一特征到融合2种特征分别构建分类器,对AD组、MCI组和HC组进行分类预测。结果表明相较于使用单一特征进行分类预测,融合EEG线性特征-相对功率谱密度,非线性动力学特征-样本熵,能够提高分类性能。
综上所述,本研究揭示了AD、MCI患者脑电各频段相对功率谱密度、样本熵的特点与HC的区别,证明了脑电特征分析在AD、MCI早期评估中的可行性与有效性,为临床上对于AD、MCI的辅助诊断提供支持。
所有作者均声明不存在利益冲突



























