黑素细胞性皮肤肿瘤发病率高,早期诊疗对于预后影响重大。反射式共聚焦显微镜(RCM)在黑素细胞性皮肤肿瘤的诊疗中已有应用,但一直缺少适用于皮肤肿瘤领域的统一诊疗指南或专家共识。由中国中西医结合学会皮肤性病专业委员会、中华医学会皮肤性病学分会、中国医师协会皮肤科医师分会相关领域的多位专家,结合临床经验、国内外相关文献及研究结果共同制订本共识。本共识阐述了正常皮肤的RCM特征、常用术语、成像规范及常见黑素细胞性皮肤肿瘤RCM表现及应用场景,供皮肤科医师在诊疗工作中参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
黑素细胞性皮肤肿瘤的发病率高[1],早期诊断和治疗对改善恶性黑色素瘤预后至关重要。传统确诊依赖组织病理活检,通常需要数天至数周才能得出诊断结果,且不适用于早期筛查。反射式共聚焦显微镜(reflectance confocal microscopy,RCM)作为一种非侵入性可视化技术,能实时展示表皮至真皮浅层不同层面细胞水平的变化,可用于辅助皮肤可疑肿瘤的诊断、分型、手术前定位、复发监测以及非侵入性治疗过程中的监测,从而减少不必要的活检次数,提高早期诊断与病情评估的精确度。但自RCM在中国应用以来,一直缺少适用于皮肤肿瘤领域的统一诊疗指南或专家共识,RCM在皮肤黑素细胞肿瘤方面的术语和描述也未标准化。鉴于此,本共识专家组在充分查阅国内外相关文献的基础上,提炼RCM特征描述要点并进行充分讨论,制订了本专家共识,以期提高RCM图像解读的准确性和一致性,提高皮肤黑素细胞肿瘤的早期检测率,降低误诊和漏诊风险,推广RCM在皮肤黑素细胞肿瘤诊疗中可靠且规范的应用。
本专家共识基于参与共识制订专家组深厚的临床实践经验以及对相关文献的系统综合评价,参考牛津大学循证医学中心分级系统(OCEBM)[2]并加以修改,对证据质量进行分级(表1),旨在更为直观地反映研究现状及应用价值。

证据质量等级及划分标准
证据质量等级及划分标准
| 证据等级 | 划分标准 |
|---|---|
| 1a | 基于随机对照试验的系统评价(同质性较好) |
| 1b | 单项随机对照试验研究 |
| 2a | 基于队列研究的系统评价(同质性较好) |
| 2b | 单项队列研究及低质量随机对照试验研究 |
| 3a | 基于病例对照研究的系统评价(同质性较好) |
| 3b | 单项病例对照研究 |
| 4 | 病例报道,低质量的队列/病例对照研究 |
| 5 | 专家意见 |
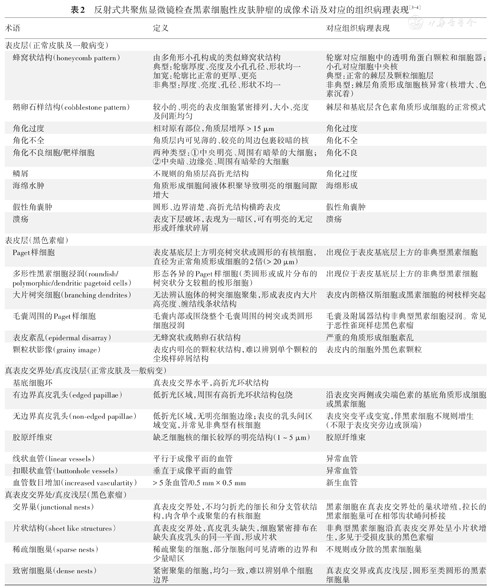
可见扁平的无核多角形细胞均匀排列成团,团块被深色裂隙(皮肤纹理)分隔开。细胞内角蛋白含量较高,也可出现无定形高折光团块(图1A)。
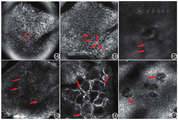

角质层下方13 ~ 20 μm,此处的角质形成细胞仍呈扁平多角形,深色的细胞核被富含角蛋白颗粒的细胞质包绕,形成类似蜂窝状结构(图1B)。
20 ~ 100 μm的深度,形态与颗粒层相似,但角质形成细胞更小(图1C)。
40 ~ 130 μm的深度,当色素沉着较多时,由于细胞质内黑色素颗粒的高折光性,出现由圆形至类圆形明亮细胞构成的鹅卵石样结构;色素沉着较少时,仍呈典型的蜂窝状结构(图1D)。
明亮的基底角质形成细胞通常围绕深色的真皮乳头形成边界清晰的环状结构,即"有边缘的真皮乳头"(图1E)。面部真表皮交界部位表皮突变平,可能无法呈现完美的环状结构。
多为弥漫深色区域,其间有较细的明亮带状或粗糙网状结构,为真皮中的胶原纤维。血管表现为深色管状结构,内含明亮的圆形血细胞(图1F),在成像过程中可见血细胞在血管中运动。
RCM检查黑素细胞性皮肤肿瘤的常用术语及对应的组织病理表现见表2[3,4]。
| 术语 | 定义 | 对应组织病理表现 |
|---|---|---|
| 表皮层(正常皮肤及一般病变) | ||
| 蜂窝状结构(honeycomb pattern) | 由多角形小孔构成的类似蜂窝状结构典型:轮廓厚度、亮度及小孔孔径、形状均一加宽:轮廓比正常的更厚、更亮非典型:厚度、亮度、孔径、形状不均一 | 轮廓对应细胞中的透明角蛋白颗粒和细胞器;小孔对应细胞中央核典型:正常的棘层及颗粒细胞层非典型:棘层角质形成细胞核异常(核增大、色素沉着) |
| 鹅卵石样结构(cobblestone pattern) | 较小的、明亮的表皮细胞紧密排列,大小、亮度及间距均匀 | 棘层和基底层含色素角质形成细胞的正常模式 |
| 角化过度 | 相对原有部位,角质层增厚> 15 μm | 角化过度 |
| 角化不全 | 角质层内可见薄的、较亮的周边包裹较暗的核 | 角化不全 |
| 角化不良细胞/靶样细胞 | 两种类型:①中央明亮、周围有暗晕的大细胞;②中央暗、边缘亮、周围有暗晕的大细胞 | 角化不良 |
| 鳞屑 | 不规则的角质层高折光结构 | 角化过度 |
| 海绵水肿 | 角质形成细胞间液体积聚导致明亮的细胞间隙增大 | 海绵形成 |
| 假性角囊肿 | 圆形、边界清楚、高折光结构横跨表皮 | 假性角囊肿 |
| 溃疡 | 表皮下层破坏,表现为一暗区,可有明亮的无定形或纤维状碎屑 | 溃疡 |
| 表皮层(黑色素瘤) | ||
| Paget样细胞 | 表皮基底层上方明亮树突状或圆形的有核细胞,直径为正常角质形成细胞的2倍(> 20 μm) | 出现位于表皮基底层上方的非典型黑素细胞 |
| 多形性黑素细胞浸润(roundish/polymorphic/dendritic pagetoid cells) | 形态各异的Paget样细胞(类圆形或成片分布的树突状分支较粗的梭形细胞) | 出现位于表皮基底层上方的非典型黑素细胞 |
| 大片树突细胞(branching dendrites) | 无法辨认胞体的树突细胞聚集,形成表皮内大片高亮度、缠结线条状结构 | 表皮内朗格汉斯细胞或黑素细胞的树枝样突起 |
| 毛囊周围的Paget样细胞 | 毛囊内部或围绕整个毛囊周围的树突或类圆形细胞浸润 | 毛囊及附属器结构非典型黑素细胞浸润。常见于恶性雀斑样痣黑色素瘤 |
| 表皮紊乱(epidermal disarray) | 无蜂窝状或鹅卵石状结构 | 严重的角质形成细胞紊乱 |
| 颗粒状影像(grainy image) | 表皮内明亮的颗粒状结构,难以辨别单个颗粒的尘埃样碎屑结构 | 表皮内的细胞外黑色素颗粒 |
| 真表皮交界处/真皮浅层(正常皮肤及一般病变) | ||
| 基底细胞环 | 真表皮交界水平,高折光环状结构 | |
| 有边界真皮乳头(edged papillae) | 低折光区域,周围有高折光环状结构包绕 | 沿表皮突两侧或尖端色素的基底角质形成细胞或黑素细胞 |
| 无边界真皮乳头(non-edged papillae) | 低折光区域,无明亮细胞边缘;表皮的乳头间区域变宽,并常见非典型有核细胞 | 表皮突变平或变宽,伴黑素细胞不规则增生(不限于表皮突旁边或顶端) |
| 胶原纤维束 | 缺乏细胞核的细长较厚的明亮结构(1 ~ 5 μm) | 胶原纤维束 |
| 线状血管(linear vessels) | 平行于成像平面的血管 | 异常血管 |
| 扣眼状血管(buttonhole vessels) | 垂直于成像平面的血管 | 异常血管 |
| 血管数目增加(increased vasculartity) | > 5条血管/0.5 mm × 0.5 mm | 新生血管 |
| 真表皮交界处/真皮浅层(黑色素瘤) | ||
| 交界巢(junctional nests) | 真表皮交界处,不均匀折光的细长和分支管状结构,内含单个或聚集的有核细胞 | 黑素细胞在真表皮交界处的巢状增殖,拉长的黑素细胞巢可在相邻齿状嵴间桥接 |
| 片状结构(sheet like structures) | 真表皮交界处,真皮乳头缺失,细胞紧密排布在缺失真皮乳头的同一平面,形成片状 | 非典型黑素细胞沿真表皮交界处呈小片状增生,多见于受损皮肤的黑色素瘤 |
| 稀疏细胞巢(sparse nests) | 稀疏聚集的细胞,部分细胞间可见清晰的边界和少量暗区 | 不规则或分散的黑素细胞巢 |
| 致密细胞巢(dense nests) | 紧密聚集的细胞,均匀一致,难以辨别单个细胞边界 | 真表皮交界或真皮浅层,圆形至类圆形的黑素细胞巢 |
在采集皮肤肿瘤RCM图像过程中,需遵循一定的规范以确保获取全面的信息。首先,所有的皮损都应采集1个"基本图像集",包含4个解剖水平的拼接图像和1个堆叠图像。每帧图像大小为0.5 mm × 0.5 mm,拼接图像最大可达8 mm × 8 mm。拼接图像应以皮损为中心,并包含至少1 mm的非皮损皮肤边缘。解剖水平包括表皮上层(颗粒层、棘层)、基底层、真表皮交界处以及真皮乳头层。如有必要,还需进一步采集深层组织图像。堆叠图像以皮肤表面为Z轴水平,初始采集深度为水平面以下10 μm,采集4 ~ 6帧图像,根据患者年龄、皮损的位置和大小调整采集深度间隔。非面部区域深度间隔为30 μm,面部区域为20 μm,老年人因皮肤变薄统一设为20 μm,对于皮肤特别薄的老年患者适当减小间隔。
此外,采集还需遵循以下原则,①对照原则:需同时观察正常皮肤和皮损部位,可先对皮损周围或对侧正常皮肤成像,再行皮损部位成像;②多处成像原则:每次成像应对至少2处皮损成像,以防遗漏;③反复成像原则:部分皮损可间隔多次成像,以长期观察疾病演变;④广度与深度扫描结合原则:可先行X轴及Y轴扫描,观察皮损与周围正常皮肤的区别,针对有特点的区域再行Z轴扫描,各解剖水平逐层采集。
(1)直径> 8 mm的病灶:因拼接图像的最大尺寸为8 mm × 8 mm,需要采集多个图像集来覆盖整个病灶区域。首个图像集应位于最长径的中心,各基本图像集之间至少有10%的重叠,且至少有1个图像集包含相邻的正常皮肤。
(2)表面不平坦的病灶:可以从病灶最高点设为Z轴零点开始采集,适当地增加堆叠图像的数量。可以在病灶较平坦的部分重设Z轴零点,以提高图像采集的效率。
(3)有溃疡、结痂、糜烂的病灶:由于溃疡、结痂、糜烂面的高折光,利用RCM观察容易遗漏诊断信息。当溃疡、结痂、糜烂面积超过20%时,应在病灶边缘采集额外的堆叠图像以充分显示病灶,面积超过50%时,建议直接进行活检以减少误诊风险。
(4)异常增厚、隆起的病灶:可能需要增加第1帧图像的深度和每帧之间的深度间隔。可以采集不同深度的高分辨率图像,包括分辨率开始降低的深部组织图像,以尽可能多地捕获病灶特征。
(5)疑似黑色素瘤的病灶:建议在表皮中部水平采集1帧额外的图像,以便全面评估是否存在Paget样细胞。还应对以下特征进行重点采集:细胞排列紊乱或异常区域、大而明亮的非典型细胞、Paget样细胞等。
证据等级:5
常见良性黑素细胞来源肿瘤的反射式共聚焦显微镜图像特点
常见良性黑素细胞来源肿瘤的反射式共聚焦显微镜图像特点
| 病名 | 基底层以上表皮 | 表皮真皮交界 | 真皮浅层 |
|---|---|---|---|
| 交界痣 | 正常蜂窝状结构 | 基底层见明亮、形态规则的高折光物质(痣细胞巢),色素环折光度较正常部位明显增加 | 正常 |
| 皮内痣 | 正常蜂窝状结构 | 基底细胞环形态完整 | 高折光的圆形或者椭圆形痣细胞巢位于真皮内;真皮浅层规则的色素团块聚集,未见细胞非典型及不典型性;或见真皮乳头层不融合、高折光、圆形的细胞聚集 |
| 复合痣 | 正常蜂窝状结构 | 痣细胞巢可同时位于基底层和真皮内,真皮浅层可见规则的色素团块聚集 | |
| 发育不良痣 | 表皮突向下延伸 | 真表皮交界处不均匀增厚,伴高亮度细胞团块样聚集。细胞体积增大,有一定异形性 | 正常 |
| Spitz痣 | 伴明亮的鹅卵石样结构聚集;亦可见表皮结构紊乱,蜂巢状结构消失,出现Paget样细胞 | 乳头间隙增宽,呈现网筛状结构 | 可见高折光团块样聚集,团块界限通常较清晰 |
| 蓝痣 | 正常蜂窝状结构 | 基底细胞环形态完整 | 真皮层上部见散在或团块状混杂聚集分布的高亮度梭形细胞及较大体积类圆形细胞;真皮乳头内可分布少量不规则色素颗粒。可伴有束状细长的纤维增生 |
| 晕痣 | 正常蜂窝状结构 | 表真皮交界处及真皮内可见单个或成巢高折光细胞;周边色素减退区基底层色素明显减少,部分基底细胞环色素缺失;真皮乳头及浅层血管周图可见不等量噬黑素细胞及炎症细胞浸润 | |
黑素细胞痣由于痣细胞的色素颗粒含量和位置不同,临床上可呈棕色、褐色、蓝黑色、黑色或可正常肤色、淡黄色或暗红色。
表皮结构无明显异常,正常角质形成细胞排列呈蜂窝状。基底层见明亮的形态规则的高折光物质(痣细胞巢),色素环折光度较正常部位明显增加;痣细胞巢主要位于表皮内(图2A)。
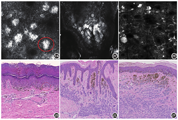

表皮结构基本正常,角质形成细胞排列呈蜂窝状。高折光的圆形或者椭圆形痣细胞巢位于真皮内。真皮浅层可见规则的色素团块聚集,未见细胞异形及不典型性。或见真皮乳头层不融合、高折光、圆形的细胞聚集(图2C)。
Spitz痣在组织病理上类似于恶性黑色素瘤,而实际上是一种来源于黑素细胞的后天性良性肿瘤,常表现为单个坚实丘疹或结节,多见于儿童[10]。
RCM特征:①表皮处,棘层可见角质形成细胞排列整齐,呈蜂窝状,伴明亮的鹅卵石样结构聚集,对应于组织病理中大量色素颗粒沉着;亦可见表皮结构紊乱,蜂窝状结构消失,出现Paget样细胞。与黑色素瘤相比较,Paget样细胞比例较少,且多为灶性分布的高亮度梭形或树突细胞。在无色素型皮损中,可见低亮度Paget样细胞(图3A)[11];②在真表皮交界处乳头间隙增宽,呈现网筛状结构(图3E)[12];③真皮层可见高折光团块样聚集,界限通常较清晰(图3C)[13]。
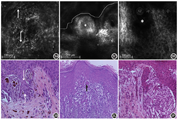

本组图片引自文献[11],已获出版商授权
证据等级:4
发育不良痣为不典型痣,具有发育不良的组织学表现。通常表现为灰色、深棕色和粉红色的混合,有时皮损周围可绕以红斑[14]。
RCM特征:RCM下见表皮突向下延伸,真表皮交界处不均匀增厚,伴高亮度细胞团块样聚集;细胞体积增大,有一定异型性(图4A)。对应组织学上基底层痣细胞沿表皮嵴不规则成巢与融合[15,16](图4B);常见痣细胞巢的桥接,巢内可见正常细胞与非典型细胞混合;真表皮交界处可见嗜黑素细胞及炎症细胞浸润,可有嗜酸性纤维组织增生。


图4、图5引自文献[15],已获出版商授权
证据等级:3b
蓝痣是真皮黑素细胞局限性增生所形成的良性肿瘤,常为蓝色、蓝灰色或蓝黑色丘疹。
RCM特征[17,18,19,20]:表皮通常正常,无黑素细胞增生或黑色素颗粒增多;基底细胞环形态完整;真皮层上部见散在或团块状混杂聚集分布的高亮度梭形细胞及较大体积类圆形细胞(图5A);真皮乳头内可分布少量不规则色素颗粒,可伴有束状细长的纤维增生。
证据等级:4
晕痣典型表现为色素痣周围为边界清楚的环状色素减退或色素脱失晕。
RCM特征[21,22,23]:表真皮交界处及真皮内可见单个或成巢高折光细胞,周边白斑区基底层色素明显减少,部分基底细胞环色素缺失,真皮乳头及浅层血管周围可见不等量噬黑素细胞及炎症细胞浸润(图6)。
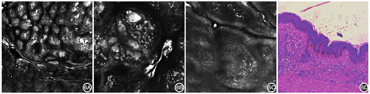

证据等级:4
黑色素瘤是黑素细胞来源的恶性肿瘤,常见亚型有浅表扩散型黑色素瘤、恶性雀斑样痣黑色素瘤及结节型黑色素瘤。
RCM特征[24,25,26,27,28,29,30,31,32,33,34]:不同类型的黑色素瘤表现各异,但主要特征基本相同,①密集的圆形或明亮的非典型细胞:表皮各层都有密集的体积明显增大的高亮度非典型细胞,呈圆形、树突状或者不规则形态(图7A、图7B),真表皮交界及真皮也可见非典型细胞巢;②表皮结构紊乱:角质形成细胞的正常排列结构(蜂窝状)消失,同时见棘层亮度明显增高(图7C);③表皮见Paget样细胞:较大而明亮的圆形或类圆形细胞成团分布,大小为正常角质形成细胞的2倍以上,中央折光度稍低,可呈"指环"样(图7E);④基底层可见大量形态各异的高亮度黑素细胞,部分细胞可见树枝状突起;雀斑样痣黑色素瘤真皮浅层可见大量树突状非典型黑素细胞;⑤真表皮交界不清:真表皮交界处正常的色素环消失,呈网状、块状或难以分辨;⑥真皮乳头层可见单一核细胞:数量不等的噬黑素细胞及单一核细胞浸润,有脑回状细胞团(图7F),并有扩张充血的血管(图7G);⑦雀斑样痣黑色素瘤中可见毛囊破坏。


证据等级:3b
经典恶性黑色素瘤的RCM诊断标准包括2个主要指标和4个次要指标。主要指标:①真表皮交界处不典型细胞增生,②无边缘的真皮乳头。次要指标:①圆形Paget样细胞,②表皮广泛的Paget样浸润,③真皮乳头层可见有核细胞,④真皮中有脑回状细胞。符合2个主要指标或1个主要指标加2个次要指标即可诊断[35]。或用"两步法",先根据系统成像的4个特征区分黑素细胞及非黑素细胞性皮损,即圆形鹅卵石样细胞,表皮有广泛的Paget样细胞浸润,真表皮交界处呈筛网状和真皮中有细胞巢,再根据恶性黑色素瘤的诊断标准进一步诊断[36]。根据一项多中心系统研究,黑色素瘤RCM检测的诊断敏感度约92%,特异度约70%,优于皮肤镜[32]。RCM在颜色较浅或无色素性黑色素瘤中具有优势,检测深度可到真皮中部,因此对于浅表扩散型诊断性能较好,但对于更深层次如肢端黑色素瘤,RCM的诊断准确性受限,此时需要联合其他更深层次成像或组织活检协助诊断。
证据等级:2
RCM可贯穿黑素细胞性皮肤肿瘤的整个诊疗和评估过程。①诊断筛查:单独或联合其他无创成像技术(如皮肤镜、光学相干断层扫描技术)用于黑素细胞性皮肤肿瘤的无创诊断分型[37,38];②治疗前随访:对于模棱两可的黑素细胞性皮肤肿瘤,可在切除前利用RCM随访3 ~ 12个月,色素痣相对稳定,而黑色素瘤则更易出现非典型树突细胞的增多和真表皮交界处结构紊乱,可避免约60%不必要的痣切除[39];③确定活检和切除范围:RCM可初步显示病灶的位置、侵袭深度,有助于保留正常组织;较简便的一种利用RCM评估黑色素瘤切缘的方法是,先利用皮肤镜或Wood灯确定黑色素瘤的临床区域,随后利用RCM扫视区域边缘,并沿各径向逐次向外推进2 mm,直至不显示非典型树突细胞,确定为切除区域[40];其与组织学一致性明显优于皮肤镜或Wood灯[33];在黑色素瘤切除术中利用手持RCM评估切除范围,单次切除就获得阴性组织学切缘的比例显著提升(86% vs. 50%,P < 0.000 1),减少二次手术需求,降低不完全切除和局部复发的风险[41];④手术治疗评估:在恶性雀斑样痣黑色素瘤切除后部位,由于瘢痕形成,皮肤镜的评估效果受限,RCM则不受影响,可区分复发或其他原因所致色素增多[42];⑤非手术治疗评估:局部恶性雀斑及难以切除的黑色素瘤患者,接受咪喹莫特或全身免疫治疗后,RCM提示原有的非典型细胞、片状结构消失,出现噬黑素细胞和胶原纤维增生,与组织学结果一致[43];治疗失败患者可见Paget样细胞,真表皮交界处结构紊乱[44];RCM也可监测黑素细胞痣激光治疗后结构和细胞形态的变化,避免不必要的手术切除[45]。
作为一种实时、具有细胞分辨率的无创检查方法,RCM在黑素细胞肿瘤的早期监测、辅助诊断和评估预后等方面具有重要的意义。因其是基于细胞水平的改变作出诊断,对医师的临床和病理水平都有较高要求。近年来,人工智能在RCM领域也取得了一定进展,已可用于黑色素瘤的辅助诊断和分型[46],也可将灰度RCM图像转换为具有微观分辨率的HE染色图像[47]。但操作人员的扫描流程、扫描习惯、图像生成及图像描述的不规范和不一致,导致RCM报告难以互认,阻碍了RCM的推广和在人工智能中的应用。同时,RCM皮肤成像还存在固有局限性,例如有限的穿透深度和对特殊病变(结痂、溃疡)的成像质量不佳,无法区分活化的朗格汉斯细胞和树突状黑素细胞等[31]。因此,未来需要建立统一的质控标准(可参照《反射式共聚焦显微镜皮肤检测质控专家共识(2023)》),进一步探索其他皮肤肿瘤疾病的RCM特征,并研究如何将RCM与组织病理、其他皮肤影像技术、人工智能技术相结合,推动RCM更广泛地应用和发展。
参与本共识制订的专家名单(以姓氏汉语拼音为序):陈柳青(武汉市第一医院)、崔勇(中日友好医院)、黄文慧(首都医科大学附属复兴医院)、李薇薇(北京大学第三医院)、李小红(郑州大学第一附属医院)、李航(北京大学第一医院)、林景荣(大连医科大学附属第一医院)、刘华绪(山东第一医科大学皮肤病医院)、刘洁(中国医学科学院北京协和医院)、吕成志(大连市皮肤病医院)、孟如松(解放军空军特色医学中心)、冉玉平(四川大学华西医院)、尚淑贤(中国医学科学院皮肤病医院)、陶娟(华中科技大学同济医学院附属协和医院)、辛琳琳[山东第一医科大学第一附属医院(山东省千佛山医院)]、许阳(南京医科大学第一附属医院)、尤艳(哈尔滨医科大学附属第四医院)、邹先彪(深圳大学附属华南医院)
执笔者:陈柳青(武汉市第一医院)、姜倩(武汉市第一医院)、魏思睿(武汉市第一医院)、邹先彪(深圳大学附属华南医院)
所有作者均声明无利益冲突