
比较4种测量12~18个月儿童骨盆正位片髋关节中心边缘角(centre-edge angle,CEA)方法的可重复性和对发育性髋关节发育不良(developmental dysplasia of the hip,DDH)的预测价值。
回顾性收集2020年1月至2022年12月于空军军医大学西京医院拍摄的12~18月龄儿童骨盆正位片184例(368髋),其中137髋存在DDH。3名观察者根据给定的4种测量CEA方法(分别以骨化核中心、骨化核骨骺侧中点、骨骺连线中点、骨骺连线与股骨颈中线交叉点作为股骨头中心测量)进行研究前的Digimizer软件操作培训。培训2周后,3名观察者分别对184例骨盆正位片进行髋关节CEA测量,间隔2周后,重复测量一次,最终得到368个髋关节4种CEA的6组数据。然后用观察者内、观察者间组内相关系数(intra-class correlation coefficient,ICC)对各方法测量的结果进行分析,并用方差分析比较4种CEA均值的差异,最后用受试者操作特征(receiver operator characteristic,ROC)曲线分析4种CEA测量方法对DDH的预测价值。
4种方法测量的CEA观察者内和观察者间的ICC结果均大于0.90,即4种方法可重复性均比较高。4种方法测量的CEA均值依次为7.396°、1.221°、-0.151°、4.307°,差异有统计学意义(P=0.001)。以骨骺连线与股骨颈中线交叉点为股骨头中心测量的CEA预测DDH的ROC曲线下面积为0.883,高于其他3种方法(95%CI:0.847~0.918,P<0.001)。
以骨骺连线与股骨颈中线交叉点作为股骨头中心的代替标志点测量12~18月龄儿童骨盆正位片的髋关节CEA可重复性强,对DDH的预测价值较高,是一个相对较好的测量CEA方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
中心边缘角(centre-edge angle,CEA)由Wiberg在1939年提出,是一种经证实用于量化髋臼覆盖范围的临床适用性评判指标[1]。CEA在发育性髋关节发育不良(developmental dysplasia of the hip,DDH)的诊断和预后评估中均有较高的应用价值,研究表明即使早期没有症状的情况下,CEA的大小也与患儿成年后骨关节炎的进展有关[2]。但是当股骨头不完全骨化时难以识别股骨头的中心,所以许多学者认为CEA在4~5岁以上儿童中应用才比较可靠[3]。然而早诊断、早治疗是改善DDH患儿预后的关键[4,5]。因此探讨CEA是否可以应用于幼儿髋臼覆盖范围的评估具有重要的临床意义。
目前已有研究表明CEA是预测5岁以下儿童DDH预后的可靠测量指标[6]。大量学者也尝试将CEA应用于幼儿DDH诊断和预后评估中[7,8,9,10,11]。但不同学者在测量CEA时股骨头中心点的X线标志点存在争议,文献中主要有以下4种不同的定位方法,包括骨化核的中心、骨化核骨骺侧中点、骨骺连线的中点和骨骺连线与股骨颈中线交叉点[7,12,13,14]。因为测量方法的不统一造成了CEA测量结果不稳定,使其应用受限,所以统一幼儿骨盆正位X线片上测量CEA的方法意义重大。
本研究选择行走早期(12~18月龄)的儿童骨盆正位X线片作为研究对象,探讨4种以不同股骨头中心作为标志点测量CEA方法的可重复性和对DDH预测价值,为利用幼儿骨盆正位片统一测量CEA的方法提供一定参考。
本研究病例的纳入标准为:①拍摄骨盆正位X线片时,儿童年龄在12~18个月;②标准前后位骨盆正位片;③髋关节未行手术治疗。排除标准为:①患有除DDH外的造成髋关节畸形的其他相关疾病;②拍片体位不正者,如骨盆存在明显的倾斜、旋转,股骨明显外展或内收者;③骨化中心未出现者。
回顾性收集2020年1月至2022年12月于空军军医大学西京医院拍摄的符合纳排标准的儿童骨盆正位片184例(368髋),其中男40例,女144例;儿童年龄为(15.57±2.03)个月,范围在12~18个月;其中137髋被诊断为DDH。本研究中DDH的诊断标准为国际髋关节发育不良协会(International Hip Dysplasia Institute,IHDI)分型Ⅱ型以上和IHDI分型Ⅰ型中髋臼指数>28°的髋关节。本研究经空军军医大学西京医院伦理委员会审核批准(KY20223254-1)。
选择本院3名儿童骨科医生作为本研究的观察者,包括:①刚进入儿童骨科的住院医师1名,工作时间3年;②具有一定临床经验的儿童骨科主治医师1名,工作时间6年;③儿童骨科副主任医师1名,工作时间10年。
以髋臼顶的外侧骨缘为CEA测量髋臼侧标志点,将骨化核在长度和宽度上一分为二的两条线的交界定义为骨化核的中心,将骨化核靠近骨骺一侧的中点定义为骨化核骨骺侧中点,将股骨近端干骺端平台的中点定义为骨骺连线的中点,将股骨近端干骺端边线与分隔股骨颈的中线的交界定义为骨骺连线与股骨颈中线交叉点。本研究4种测量方法分别以上述4点作为股骨头中心标志点,测量所得的CEA分别简称为骨化核中心CEA、骨化核骨骺侧中点CEA、骨骺连线中点CEA、骨骺连线与股骨颈中线交叉点CEA(图1)。
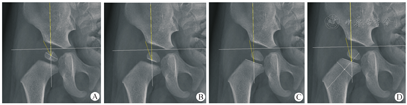

注:图中两条黄线所夹的角为不同股骨头中心代替标志点测量的中心边缘角。
3名观察者首先统一进行Digimizer软件操作培训,掌握软件的测量方法和基础操作步骤,并熟悉研究中给定的解剖标志点定义。
培训2周后,3名观察者利用Digimizer软件分别采用4种CEA测量方法对纳入研究的184例骨盆正位片进行测量,每位观察者利用每种方法需对同一张正位片测量2次,2次测量时间间隔2周。
采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以 ±s表示,用组内相关系数(intra-class correlation coefficient,ICC)判断不同方法测量CEA的可重复性,若ICC≥0.90,则认为该方法的可重复性比较高;若0.75≤ICC<0.90,认为可重复性较好;若ICC<0.75,认为可重复性较差。多组间均数的比较采用方差分析。应用受试者操作特征(receiver operator characteristic,ROC)曲线评价4种测量方法所得的CEA在DDH中的预测价值。以P<0.05为差异有统计学意义。
±s表示,用组内相关系数(intra-class correlation coefficient,ICC)判断不同方法测量CEA的可重复性,若ICC≥0.90,则认为该方法的可重复性比较高;若0.75≤ICC<0.90,认为可重复性较好;若ICC<0.75,认为可重复性较差。多组间均数的比较采用方差分析。应用受试者操作特征(receiver operator characteristic,ROC)曲线评价4种测量方法所得的CEA在DDH中的预测价值。以P<0.05为差异有统计学意义。
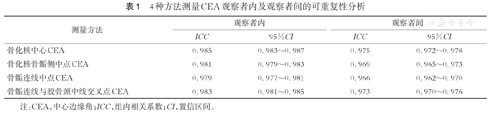
对4种CEA测量方法的测量结果进行可重复性分析,结果显示观察者内及观察者间的ICC均大于0.90(表1),说明这4种方法在观察者内和观察者间均有非常高的可重复性。4种测量方法在观察者内和观察者间的ICC大小顺序相同,从大到小依次为骨化核中心CEA、骨骺连线股骨中线交叉点CEA、骨化核骨骺侧中点CEA、骨骺连线中点CEA。
4种方法测量CEA观察者内及观察者间的可重复性分析
4种方法测量CEA观察者内及观察者间的可重复性分析
| 测量方法 | 观察者内 | 观察者间 | ||
|---|---|---|---|---|
| ICC | 95%CI | ICC | 95%CI | |
| 骨化核中心CEA | 0.985 | 0.983~0.987 | 0.975 | 0.972~0.978 |
| 骨化核骨骺侧中点CEA | 0.981 | 0.979~0.983 | 0.969 | 0.965~0.973 |
| 骨骺连线中点CEA | 0.979 | 0.977~0.981 | 0.966 | 0.962~0.970 |
| 骨骺连线与股骨颈中线交叉点CEA | 0.983 | 0.981~0.985 | 0.973 | 0.970~0.976 |
注:CEA,中心边缘角;ICC,组内相关系数;CI,置信区间。
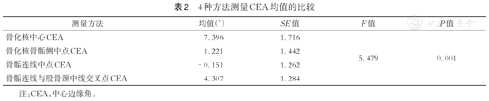
用方差分析比较4种方法测量的CEA均值,结果显示骨化核中心CEA的平均值为7.396°,骨化核骨骺侧中点CEA的平均值为1.221°,骨骺连线中点CEA的平均值为-0.151°,骨骺连线与股骨颈中线交叉点CEA的平均值为4.307°,4种CEA均值间差异有统计学意义(P=0.001,表2),其中骨化核中心CEA与骨骺连线中点CEA的均值相差最大为7.547°。
4种方法测量CEA均值的比较
4种方法测量CEA均值的比较
| 测量方法 | 均值(°) | SE值 | F值 | P值 |
|---|---|---|---|---|
| 骨化核中心CEA | 7.396 | 1.716 | 5.479 | 0.001 |
| 骨化核骨骺侧中点CEA | 1.221 | 1.442 | ||
| 骨骺连线中点CEA | -0.151 | 1.262 | ||
| 骨骺连线与股骨颈中线交叉点CEA | 4.307 | 1.284 |
注:CEA,中心边缘角。
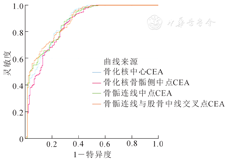
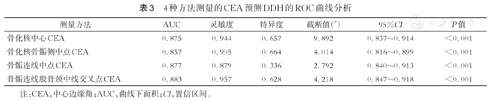
绘制4种方法测量的CEA预测DDH的ROC曲线,结果显示骨化核中心CEA、骨化核骨骺侧中点CEA、骨骺连线中点CEA、骨骺连线与股骨颈中线交叉点CEA的截断值分别为:9.892°、4.014°、2.792°、4.218°,ROC曲线下面积(area under the curve,AUC)分别为0.875、0.857、0.877、0.883,4种方法均对DDH具有较高的预测价值,差异有统计学意义(均P<0.001,表3,图2)。其中骨骺连线与股骨颈中线交叉点CEA的AUC最大,为最佳预测指标。

4种方法测量的CEA预测DDH的ROC曲线分析
4种方法测量的CEA预测DDH的ROC曲线分析
| 测量方法 | AUC | 灵敏度 | 特异度 | 截断值(°) | 95%CI | P值 |
|---|---|---|---|---|---|---|
| 骨化核中心CEA | 0.875 | 0.944 | 0.657 | 9.892 | 0.837~0.914 | <0.001 |
| 骨化核骨骺侧中点CEA | 0.857 | 0.905 | 0.664 | 4.014 | 0.816~0.899 | <0.001 |
| 骨骺连线中点CEA | 0.877 | 0.879 | 0.336 | 2.792 | 0.840~0.913 | <0.001 |
| 骨骺连线股骨颈中线交叉点CEA | 0.883 | 0.957 | 0.628 | 4.218 | 0.847~0.918 | <0.001 |
注:CEA,中心边缘角;AUC,曲线下面积;CI,置信区间。
DDH是小儿骨科常见疾病之一,它包括从轻度髋臼发育不良到髋关节完全脱位的广泛髋关节发育异常[15]。其发病率在1‰~34‰之间,在不同国家和地区间存在明显差异[16]。DDH患儿开始治疗的年龄越小治疗的方法也就越简单,而且越有可能获得较好的预后,因此早期诊断对DDH患儿来说非常重要[17]。拍摄骨盆正位片作为4~6个月以上DDH患儿诊断的首选辅助检查,诊断的指标包括髋臼指数、CEA、Perkin象限、沈通线等[18]。但是目前临床上并没有DDH诊断的金标准,各个指标均有一定的优势和缺陷。目前临床上最常用的诊断指标是髋臼指数,但是该指标仅评估了髋臼的发育,并没有对股骨头的位置进行评估,既往也有研究表明CEA对幼儿DDH预后的评估优于髋臼指数[7]。但幼儿股骨头中心难以在骨盆正位片上准确定位,为了解决这一难题,许多学者尝试用不同的X线标志点来代替幼儿股骨头中心测量CEA,但目前仍未达成共识。所以统一利用幼儿骨盆正位片测量CEA的方法具有重要的临床意义。因幼儿髋臼指数和CEA的正常参考范围均随年龄不断变化[19],12个月内的儿童(特别是存在DDH的儿童)股骨头骨化核可能尚未出现[20],而3~5岁儿童股骨头发育已趋于稳定,为减小年龄对研究结果的影响,本研究选择了行走早期(12~18月龄)的儿童骨盆正位片作为了研究对象。
较好的测量方法首先需要有较高的观察者内和观察者间可重复性,本研究利用ICC对比4种CEA测量结果的可重复性,结果显示骨化核中心CEA的可重复性在观察者内(ICC=0.985)和观察者间(ICC=0.975)均是最高的,次之为骨骺连线股骨中线交叉点CEA(观察者内ICC=0.983,观察者间ICC=0.973)。但是有研究表明骨化核是偏心的,而且个体之间的发育存在明显差异,特别是DDH患儿的骨化核出现得较晚,所以虽然其测量稳定性较好,但其本身位置的变异性可能较大[20,21]。本研究结果表明4种测量方法在观察者内和观察者间的可重复性均非常高(均ICC>0.90)。
对比4种CEA测量结果的均值发现,4种CEA均值差异有统计学意义(P=0.001),最大均值差达到了7.547°,而且ROC曲线分析结果显示4种方法对DDH预测的截断值也存在明显差异,其中骨化核中心CEA(截断值:9.892°)与骨骺连线中点CEA(截断值:2.792°)差异最大。这说明如果不能在测量方法上达成共识,即使测量方法稳定性非常高,临床上也无法确定CEA的正常参考范围来辅助诊断DDH。
本研究中ROC曲线分析结果显示4种方法测量的CEA结果对DDH均具有较高的预测价值(均P<0.001),AUC从大到小排序依次为:骨骺连线与股骨颈中线交叉点CEA(AUC=0.883)、骨骺连线中点CEA(AUC=0.877)、骨化核中心CEA(AUC=0.875)、骨化核骨骺侧中点CEA(AUC=0.857)。本研究4种方法在可重复性和DDH诊断预测中均有较高的价值,但是骨骺连线与股骨颈中线交叉点CEA在可重复性和在DDH预测方面均有较好的表现,故推荐以骨骺连线与股骨颈中线交叉点作为股骨头中心的代替标志点。既往研究也提示儿童股骨头的真实中心位于股骨颈中线的延长线上,而且用骨骺连线与股骨颈中线交叉点对股骨头真实中心的估计要优于骨化核的中心[14,22]。
综上所述,4种方法测量12~18个月儿童骨盆正位片的髋关节CEA均有较高的可重复性和DDH预测价值,但不同方法测量结果均值存在明显差异,因此在测量方法上达成共识非常重要。本研究结果提示以骨骺连线与股骨颈中线交叉点作为股骨头中心的代替标志点测量的CEA在可靠性和DDH预测价值方面均表现较好,是一个相对较好的测量12~18个月儿童骨盆正位片CEA的方法。
所有作者均声明不存在利益冲突



























