
比较依拉环素和多黏菌素类药物对多重耐药复杂腹腔感染(cIAI)的疗效与安全性。
前瞻性纳入2023年6至8月在浙江大学医学院附属邵逸夫医院和树兰国际医学院附属树兰(杭州)医院就诊的已知或高度怀疑多重耐药菌感染的cIAI患者,作为依拉环素组。回顾性收集2021年1月至2023年8月接受多黏菌素(B或E)治疗的多重耐药菌感染的cIAI患者,通过急性生理与慢性健康评分和年龄与依拉环素组进行匹配,纳入多黏菌素组。分析两组治疗结束和出院时的临床有效率、微生物清除率、综合疗效和安全性。
研究共纳入72例cIAI患者,男53例,女19例,年龄(56.0±15.4)岁。其中依拉环素组28例,多黏菌素组44例。两组患者基线指标、联合用药患者比例、菌株、感染部位和感染情况方面差异均无统计学意义(均P>0.05)。依拉环素组患者在治疗结束时[89.3%(25/28)比56.8%(25/44),P=0.004]和出院时[88.5%(23/26)比63.6%(28/44),P=0.024]的临床有效率、治疗结束时[88.9%(24/27)比47.6%(20/42),P=0.001]和出院时[91.3%(21/23)比59.5%(25/42), P=0.007]的微生物清除率以及治疗结束时[89.3%(25/28)比52.3%(23/44),P=0.001]和出院时[88.5%(23/26)比63.6%(28/44), P=0.024]的综合疗效均高于多黏菌素组。安全性方面,依拉环素组患者仅观察到2例轻度血管炎。
基于依拉环素的联合方案对多重耐药菌引起的cIAI有较好的临床疗效,在治疗结束和出院时的临床有效率、微生物清除率和综合疗效均优于多黏菌素类药物,且安全性良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
复杂腹腔感染(complicated intra-abdominal infection,cIAI)通常被定义为原发感染灶突破空腔脏器,感染侵及腹腔,形成腹膜炎或腹腔脓肿,病死率可达10.5%,给国家、患者及其家庭带来沉重经济负担[1, 2, 3]。液体复苏、源头控制和使用抗生素是cIAI管理的3大支柱[4, 5]。cIAI以混合感染常见,且细菌耐药情况日益严重,由多重耐药菌所致的cIAI呈现复杂难治性的特点,如无有效抗菌策略,cIAI的复发将成为临床面临的棘手问题[6, 7, 8]。
依拉环素是一种新型氟环素类抗生素,不受或极少受到传统四环素类常见药物耐药性机制的影响。与四环素相比,对核糖体结合的亲和力增加了14倍,而抑制蛋白质翻译的浓度降低了4倍[9]。且抗菌谱较广,可覆盖除铜绿假单胞菌之外的常见革兰阳性菌、革兰阴性菌、厌氧菌和部分非典型病原菌,对临床上主要的耐药菌也具有抗菌活性[10, 11, 12, 13, 14, 15, 16]。2023年3月依拉环素在中国获批上市。本文分析和比较了依拉环素和临床常用多重耐药治疗药物多黏菌素类药物对多重耐药的cIAI的疗效与安全性,以补充中国循证数据。
本研究为一项多中心、开放标签、队列研究。前瞻性纳入2023年6至8月在浙江大学医学院附属邵逸夫医院重症医学科及树兰国际医学院附属树兰(杭州)医院肝胆胰外科就诊的已知或高度怀疑多重耐药菌感染的cIAI患者,进入依拉环素组。并回顾性收集2021年1月至2023年8月接受多黏菌素(B或E)治疗的多重耐药菌感染的cIAI患者,根据急性生理与慢性健康评分[17]及年龄与依拉环素组进行匹配,纳入多黏菌素组(历史对照组)。
依拉环素组纳入标准:(1)年龄≥18周岁;(2)已知或高度怀疑多重耐药感染的cIAI患者;(3)自愿参加本研究,并签署知情同意书。多黏菌素组(历史对照组)入组标准为:(1)临床诊断为多重耐药感染的cIAI患者;(2)多黏菌素类药物使用时间≥3 d;(3)病例临床结局完整,资料能满足治疗结局评价。排除标准:(1)预期存活时间不能超过研究周期的患者(仅针对前瞻性部分);(2)明确为单一铜绿假单胞菌所致的腹腔感染;(3)对四环素类或研究药物配方中所含的任何辅药有过敏反应病史的患者,对本研究药物存在禁忌证的患者。本研究已通过浙江大学医学院附属邵逸夫医院伦理委员会审查(批准号:2023研第0280号)。依拉环素组患者均签署了知情同意书,多黏菌素组患者资料为回顾性研究资料,豁免知情同意。
1.收集以下临床数据:在用药当天、停药当天及出院当天收集患者的一般资料,包括基本资料(性别、年龄、体质指数、现病史、既往感染史、伴随疾病及治疗史、多重耐药菌定植或感染史、基础疾病诊断、感染部位等);病情严重程度评估包括:急性生理与慢性健康评分、手术史;生命体征及常规检查包括:生命体征、实验室检查。
停药当天收集患者的治疗持续时间及研究药物使用的其他情况,包括药物剂量、治疗持续时间及合并用药(药物类型、给药方式及给药时长)情况;生命体征及常规检查;感染相关症状及体征评估;结局和疗效评估(临床有效率、微生物清除率及综合疗效等),收集不良反应情况。研究根据常见不良反应术语评定标准5.0版对实验室检查异常值进行分级[18]。
出院当天收集患者病例资料,评估疗效和结局(疗效、死亡情况等)。
2.实验室检查:血常规、尿常规、血生化、动脉血气分析、C-反应蛋白(C-reactive protein,CRP)及降钙素原;病原学检查包括:血液、感染部位引流物、脓液或坏死组织等进行细菌培养和药敏检测结果。
3.已知多重耐药病原菌感染定义为感染的病原菌对通常敏感的常用的3类或3类以上抗菌药物同时呈现耐药;高度怀疑多重耐药菌感染定义为伴有以下危险因素的感染患者[19]:(1)老年;(2)免疫功能低下[包括患有糖尿病、慢性阻塞性肺疾病、肝硬化、尿毒症的患者,长期使用免疫抑制剂治疗、接受放射治疗和(或)化学治疗的肿瘤患者];(3)接受中心静脉插管、机械通气、泌尿道插管等各种侵入性操作;(4)近期(90 d内)接受3种及以上抗菌药物治疗;(5)既往多次或长期住院;(6)既往有多重耐药定植或感染史等。
4.治疗方案:依拉环素组患者接受基于依拉环素的联合治疗方案。多黏菌素组患者接受基于多黏菌素类药物的联合治疗方案。依拉环素按说明书推荐剂量和使用方法:1 mg/kg静脉给药,每12小时1次。医师根据临床资料(培养及药敏结果等)决定依拉环素的联合方案。
5.结局定义:主要终点指标为临床有效率,次要终点指标为微生物清除率及综合疗效。临床有效指患者在治疗结束后访视时所有入选时的症状、体征均已消失或完全恢复正常,且影像学和实验室检查等非微生物学指标均已恢复正常;微生物清除指治疗后来自原感染部位的标本未培养出原感染的致病菌;综合疗效指患者在治疗结束后访视时临床治愈,且细菌清除或假定清除[20]。
本研究采用SAS 9.4软件进行数据分析。符合正态分布的计量资料以表示,组间比较采用独立样本t检验,非正态分布数据以M(Q1, Q3)表示,组间比较采用Mann-Whitney U检验;计数资料以例(%)表示,组间比较行χ2检验。双侧检验,检验水平取α=0.05。
共纳入72例cIAI患者,男53例,女19例,年龄(56.0±15.4)岁,其中依拉环素组28例,多黏菌素组44例(其中硫酸多黏菌素B 30例,硫酸黏菌素14例)。两组患者基线指标差异均无统计学意义(均P>0.05)。其中,由于肝衰竭导致的肝移植患者在依拉环素组占53.6%(15/28),在多黏菌素组占31.8%(14/44)(表1及附表1)(扫描本文首页二维码查看附表)。
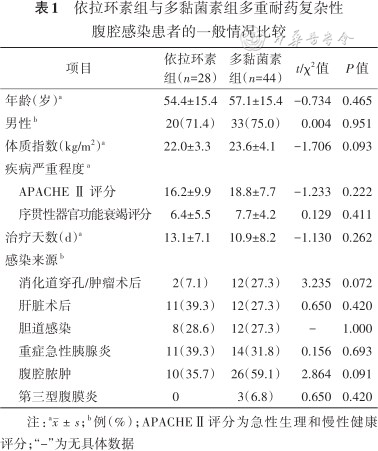
依拉环素组与多黏菌素组多重耐药复杂性腹腔感染患者的一般情况比较
依拉环素组与多黏菌素组多重耐药复杂性腹腔感染患者的一般情况比较
| 项目 | 依拉环素组(n=28) | 多黏菌素组(n=44) | t/χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 54.4±15.4 | 57.1±15.4 | -0.734 | 0.465 |
| 男性b | 20(71.4) | 33(75.0) | 0.004 | 0.951 |
| 体质指数(kg/m2)a | 22.0±3.3 | 23.6±4.1 | -1.706 | 0.093 |
| 疾病严重程度a | ||||
| APACHE Ⅱ 评分 | 16.2±9.9 | 18.8±7.7 | -1.233 | 0.222 |
| 序贯性器官功能衰竭评分 | 6.4±5.5 | 7.7±4.2 | 0.129 | 0.411 |
| 治疗天数(d)a | 13.1±7.1 | 10.9±8.2 | -1.130 | 0.262 |
| 感染来源b | ||||
| 消化道穿孔/肿瘤术后 | 2(7.1) | 12(27.3) | 3.235 | 0.072 |
| 肝脏术后 | 11(39.3) | 12(27.3) | 0.650 | 0.420 |
| 胆道感染 | 8(28.6) | 12(27.3) | - | 1.000 |
| 重症急性胰腺炎 | 11(39.3) | 14(31.8) | 0.156 | 0.693 |
| 腹腔脓肿 | 10(35.7) | 26(59.1) | 2.864 | 0.091 |
| 第三型腹膜炎 | 0 | 3(6.8) | 0.650 | 0.420 |
注:a;b例(%);APACHEⅡ评分为急性生理和慢性健康评分;“-”为无具体数据
在治疗过程中,联合使用最多的抗菌药物为头孢哌酮/舒巴坦,其次为哌拉西林/他唑巴坦、美罗培南,使用最多的抗真菌药是卡泊芬净。依拉环素组和多黏菌素组联合用药的患者比例差异无统计学意义(均P>0.05)(表2)。
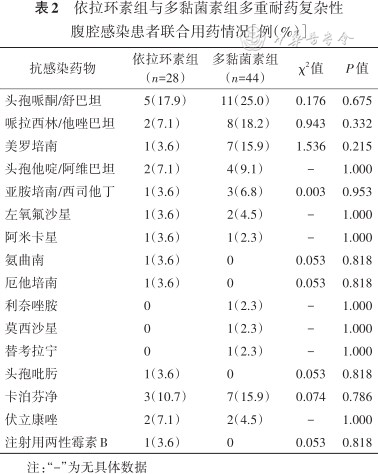
依拉环素组与多黏菌素组多重耐药复杂性腹腔感染患者联合用药情况[例(%)]
依拉环素组与多黏菌素组多重耐药复杂性腹腔感染患者联合用药情况[例(%)]
| 抗感染药物 | 依拉环素组(n=28) | 多黏菌素组(n=44) | χ2值 | P值 |
|---|---|---|---|---|
| 头孢哌酮/舒巴坦 | 5(17.9) | 11(25.0) | 0.176 | 0.675 |
| 哌拉西林/他唑巴坦 | 2(7.1) | 8(18.2) | 0.943 | 0.332 |
| 美罗培南 | 1(3.6) | 7(15.9) | 1.536 | 0.215 |
| 头孢他啶/阿维巴坦 | 2(7.1) | 4(9.1) | - | 1.000 |
| 亚胺培南/西司他丁 | 1(3.6) | 3(6.8) | 0.003 | 0.953 |
| 左氧氟沙星 | 1(3.6) | 2(4.5) | - | 1.000 |
| 阿米卡星 | 1(3.6) | 1(2.3) | - | 1.000 |
| 氨曲南 | 1(3.6) | 0 | 0.053 | 0.818 |
| 厄他培南 | 1(3.6) | 0 | 0.053 | 0.818 |
| 利奈唑胺 | 0 | 1(2.3) | - | 1.000 |
| 莫西沙星 | 0 | 1(2.3) | - | 1.000 |
| 替考拉宁 | 0 | 1(2.3) | - | 1.000 |
| 头孢吡肟 | 1(3.6) | 0 | 0.053 | 0.818 |
| 卡泊芬净 | 3(10.7) | 7(15.9) | 0.074 | 0.786 |
| 伏立康唑 | 2(7.1) | 2(4.5) | - | 1.000 |
| 注射用两性霉素B | 1(3.6) | 0 | 0.053 | 0.818 |
注:“-”为无具体数据
两组患者在菌株、感染部位和感染情况方面差异无统计学意义(均P>0.05),多黏菌素组感染部位培养结果阳性率更高(77.3%比46.4%,χ2=5.886,P=0.015)(表3)。
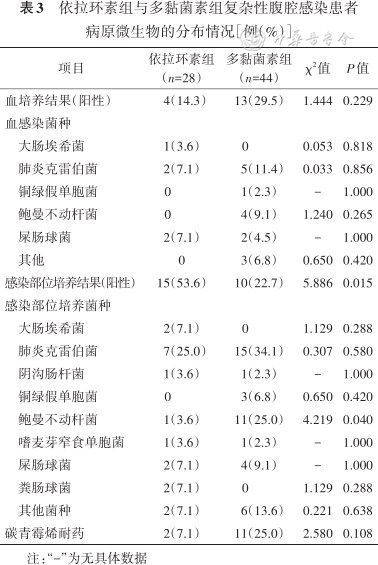
依拉环素组与多黏菌素组复杂性腹腔感染患者病原微生物的分布情况[例(%)]
依拉环素组与多黏菌素组复杂性腹腔感染患者病原微生物的分布情况[例(%)]
| 项目 | 依拉环素组(n=28) | 多黏菌素组(n=44) | χ2值 | P值 |
|---|---|---|---|---|
| 血培养结果(阳性) | 4(14.3) | 13(29.5) | 1.444 | 0.229 |
| 血感染菌种 | ||||
| 大肠埃希菌 | 1(3.6) | 0 | 0.053 | 0.818 |
| 肺炎克雷伯菌 | 2(7.1) | 5(11.4) | 0.033 | 0.856 |
| 铜绿假单胞菌 | 0 | 1(2.3) | - | 1.000 |
| 鲍曼不动杆菌 | 0 | 4(9.1) | 1.240 | 0.265 |
| 屎肠球菌 | 2(7.1) | 2(4.5) | - | 1.000 |
| 其他 | 0 | 3(6.8) | 0.650 | 0.420 |
| 感染部位培养结果(阳性) | 15(53.6) | 10(22.7) | 5.886 | 0.015 |
| 感染部位培养菌种 | ||||
| 大肠埃希菌 | 2(7.1) | 0 | 1.129 | 0.288 |
| 肺炎克雷伯菌 | 7(25.0) | 15(34.1) | 0.307 | 0.580 |
| 阴沟肠杆菌 | 1(3.6) | 1(2.3) | - | 1.000 |
| 铜绿假单胞菌 | 0 | 3(6.8) | 0.650 | 0.420 |
| 鲍曼不动杆菌 | 1(3.6) | 11(25.0) | 4.219 | 0.040 |
| 嗜麦芽窄食单胞菌 | 1(3.6) | 1(2.3) | - | 1.000 |
| 屎肠球菌 | 2(7.1) | 4(9.1) | - | 1.000 |
| 粪肠球菌 | 2(7.1) | 0 | 1.129 | 0.288 |
| 其他菌种 | 2(7.1) | 6(13.6) | 0.221 | 0.638 |
| 碳青霉烯耐药 | 2(7.1) | 11(25.0) | 2.580 | 0.108 |
注:“-”为无具体数据
两组患者基线上的CRP和降钙素原水平差异均无统计学意义(Z=1.675,P=0.094;Z=1.609,P=0.227)。经过治疗后,依拉环素组的CRP水平(22.6 mg/L比88.0 mg/L,Z=-3.292,P=0.001)及其与基线时的变化值(-30.5 mg/L比-15.0 mg/L,Z=3.137,P<0.001)均显著低于多黏菌素组。
依拉环素组与多黏菌素组相比,治疗结束时[89.3%(25/28)比56.8%(25/44),χ2=8.510,P=0.004]和出院时[88.5%(23/26)比63.6%(28/44),χ2=5.093,P=0.024]临床有效率更高;治疗结束时[88.9%(24/27)比47.6%(20/42),χ2=12.115,P=0.001]和出院时[91.3%(21/23)比59.5%(25/42),χ2=7.256,P=0.007]微生物清除率更高;治疗结束时[89.3%(25/28)比52.3%(23/44),χ2=10.549,P=0.001]和出院时[88.5%(23/26)比63.6%(28/44),χ2=5.093,P=0.024]的综合疗效也更好。
研究还按照中心进行了分层分析,结果发现,浙江大学医学院附属邵逸夫医院与树兰国际医学院附属树兰(杭州)医院患者的基线肝移植病史(0比100%,χ2=72.000,P<0.001)和急性生理和慢性健康评分(21.7±8.5比11.5±3.9,t=-5.854,P<0.001)差异均有统计学意义,其他基线特征差异无统计学意义(均P>0.05)。浙江大学医学院附属邵逸夫医院依拉环素组治疗结束时患者的临床有效率[84.6%(11/13)比50.0%(15/30),χ2=4.546,P=0.033]、综合疗效[84.6%(11/13)比50.0%(15/30),χ2=4.546,P=0.033]高于多黏菌素组。树兰国际医学院附属树兰(杭州)医院依拉环素组治疗结束时的微生物清除率[100%(14/14)比50.0%(6/12),χ2=6.501,P=0.011]和综合疗效[93.3%(14/15)比57.1%(8/14),χ2=5.179,P=0.023]高于多黏菌素组。
在安全性上,依拉环素组1例(3.6%)患者死亡,死亡原因为脑出血,研究者判断与治疗药物无关;2例(7.1%)发生血管炎(Ⅰ级不良事件),通过延缓输注时间后缓解。依拉环素组未发生因不良事件导致的延缓用药和终止用药事件。多黏菌素组未收集到不良事件。
由于多黏菌素组为回顾性数据收集,无法对实验室检查异常值判定临床意义和治疗相关性,故仅对治疗前后实验室检查指标变化情况进行分析。
依拉环素组与多黏菌素组相比,治疗后的患者出现肌酐升高(7.1%比18.2%)和低蛋白血症(25.0% 比40.9%)比例更低,但差异无统计学意义(χ2=0.943,P=0.332和χ2=1.273,P=0.259);凝血功能相关指标(活化部分凝血活酶时间、国际标准化比值、纤维蛋白原)变化更小(28.6%比56.8%,χ2=5.499,P=0.019)。
在全球范围内,多重耐药革兰阴性菌感染的增长已成为术后和危重患者的潜在威胁。多部国内外指南、共识推荐应用基于依拉环素或多黏菌素的联合治疗方案[21, 22, 23]。美国感染病学会的治疗指南认为对于碳青霉烯类耐药肠杆菌感染,β内酰胺类药物治疗无效或不能耐受时,依拉环素是替代选择,可用于腹腔感染[22]。对于腹腔感染患者,外科常见腹腔感染多学科诊治专家共识推荐,若碳青霉烯类耐药或者碳青霉烯酶阳性、金属酶、OXA-48样碳青霉烯酶阳性,可选基于多黏菌素或依拉环素的治疗方案[23]。本研究发现,依拉环素组在治疗结束和出院时的临床有效率、微生物清除率和综合疗效均显著高于多黏菌素类药物组,表明依拉环素是多重耐药cIAI的有效治疗选择。
关于联合用药方案的治疗选择,对于碳青霉烯类耐药肠杆菌感染,美国感染病学会和欧洲临床微生物与感染病学会推荐采用包含多黏菌素、替加环素、依拉环素等两种抗菌联合方案[24, 25, 26]。中国碳青霉烯耐药肠杆菌科细菌感染诊治与防控专家共识推荐以多黏菌素为基础的联合方案,包括与碳青霉烯类、替加环素、磷霉素、利福平或氨基糖苷类药物联合[27]。中国碳青霉烯类耐药革兰阴性杆菌感染的诊断、治疗和防控指南推荐以多黏菌素为基础的联合方案,联合替加环素、磷霉素、阿米卡星等治疗碳青霉烯类耐药革兰阴性杆菌[28]。
依拉环素对cIAI的疗效在既往研究中早就被证实。依拉环素治疗成人cIAI的疗效和安全性与其他抗生素(如替加环素、美罗培南、厄他培南、头孢他啶/阿维巴坦+甲硝唑、哌拉西林/他唑巴坦、亚胺培南/西司他丁和头孢曲松+甲硝唑)没有显著差异,在微生物应答率方面,依拉环素高于替加环素[29, 30]。
IGNITE系列研究结果表明,在cIAI成年住院患者中,使用依拉环素治疗的患者临床治愈率不劣于厄他培南(86.8%比87.6%)或美罗培南(90.8%比91.2%)[31, 32]。耐药性病原体(包括对耐多药和耐广谱头孢菌素的肠杆菌和鲍曼不动杆菌分离株)感染的患者接受依拉环素治疗具有高微生物应答率[33]。依拉环素和碳青霉烯类药物之间的临床治愈率没有显著差异[34]。
此外,本研究显示,依拉环素组治疗后肌酐升高比例低于多黏菌素组(7.1%比18.2%),但差异无统计学意义(P=0.332)。这可能与研究数据的收集方式有关,依拉环素组的不良事件和实验室检查数据是前瞻性收集获得,数据完整性好;而多黏菌素组是通过回顾性收集,未收集到不良事件信息,仅收集到医院有记录的实验室检查数据。
本研究两组凝血相关指标变化的发生率均高于既往文献报道水平[31, 32,35, 36],这可能与患者来源有关,树兰国际医学院附属树兰(杭州)医院纳入的研究人群93.3%是肝移植受体患者术后用药,浙江大学医学院附属邵逸夫医院纳入的研究人群均来自ICU,患者本身就存在凝血功能、肝肾功能较差的状态。
本研究证实,基于依拉环素的联合用药,在基线状态较差的多重耐药cIAI患者治疗中仍然有效。分层分析结果也表明,依拉环素在ICU重症患者、肝移植术后免疫抑制患者中的疗效依然存在优势。
本研究的局限性是多黏菌素组数据采用了回顾性方式收集。为了减小偏倚,提高两组的可比性,入组时通过急性生理和慢性健康评分和年龄对两组患者进行了匹配,并且在回顾性入组时间内采用连续入组的方式,没有挑选患者。多黏菌素组鲍曼不动杆菌比例高,可能是两组疗效差异的影响因素。另外,因为本研究样本量较小,在一些疗效指标和安全性指标上未得到有统计学意义的结果,需要大样本量的研究进行验证。
总之,基于依拉环素的联合方案治疗多重耐药菌引起的cIAI时表现出较好的临床疗效,在治疗结束和出院时的临床有效率、微生物清除率和综合疗效均显著高于多黏菌素类药物,且安全性良好。
陆志华, 陈岳亮, 苏伟, 等. 依拉环素和多黏菌素类药物对多重耐药复杂腹腔感染的疗效与安全性比较[J]. 中华医学杂志, 2024, 104(38): 3586-3592. DOI: 10.3760/cma.j.cn112137-20240517-01132.
所有作者声明不存在利益冲突




























