
心血管疾病已成为威胁我国居民生命和健康的重大公共卫生问题,因急性胸痛就诊的患者人数也逐年递增[1]。与急性胸痛相关的急性冠状动脉综合征(acute coronary syndrome ,ACS )、急性主动脉综合征(acute aortic syndrome ,AAS )、肺栓塞(pulmonary embolism ,PE)和急性心肌炎等致命性高危疾病,存在临床表现不一、病情变化迅速、疾病严重程度悬殊、预后与疼痛特征不完全相关及诊疗时间依赖性强等特点。因此,早期、快速及精准的诊断治疗,争取最佳抢救时机,改善患者临床预后,尽快识别低危人群及其他非致命性胸痛,避免不必要检查和治疗,是急性胸痛临床诊疗的核心目标[2]。随着诊断技术的不断发展,生物标志物已成为急性胸痛快速诊断及鉴别诊断的重要指标,特别是心肌肌钙蛋白(cardiac troponin ,cTn)、B型利钠肽(B-type natriuretic peptide, BNP)/N末端B型利钠肽前体(N-terminal pro-B-type natriuretic peptide ,NT-proBNP)及D-二聚体等生物标志物,结合临床评估、心电图及其他检查手段在急性胸痛病因的快速甄别、危险分层、治疗决策与预后评估中起到关键性的作用[2,3,4,5,6,7,8]。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心血管疾病已成为威胁我国居民生命和健康的重大公共卫生问题,因急性胸痛就诊的患者人数也逐年递增[1]。与急性胸痛相关的急性冠状动脉综合征(acute coronary syndrome ,ACS )、急性主动脉综合征(acute aortic syndrome ,AAS )、肺栓塞(pulmonary embolism ,PE)和急性心肌炎等致命性高危疾病,存在临床表现不一、病情变化迅速、疾病严重程度悬殊、预后与疼痛特征不完全相关及诊疗时间依赖性强等特点。因此,早期、快速及精准的诊断治疗,争取最佳抢救时机,改善患者临床预后,尽快识别低危人群及其他非致命性胸痛,避免不必要检查和治疗,是急性胸痛临床诊疗的核心目标[2]。随着诊断技术的不断发展,生物标志物已成为急性胸痛快速诊断及鉴别诊断的重要指标,特别是心肌肌钙蛋白(cardiac troponin ,cTn)、B型利钠肽(B-type natriuretic peptide, BNP)/N末端B型利钠肽前体(N-terminal pro-B-type natriuretic peptide ,NT-proBNP)及D-二聚体等生物标志物,结合临床评估、心电图及其他检查手段在急性胸痛病因的快速甄别、危险分层、治疗决策与预后评估中起到关键性的作用[2,3,4,5,6,7,8]。
在国家卫生健康委员会领导以及社会各界支持下,中国胸痛中心建设取得显著成效,有效地改善了我国急性胸痛,尤其是急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction ,STEMI)的救治现状[9,10]。但是急性非ST段抬高型ACS (non-ST-segment elevation ACS, NSTE-ACS)、AAS和PE等急性高危胸痛诊断和鉴别诊断更依赖生物标志物检测,其相关的胸痛中心临床决策路径(clinical decision pathway ,CDP )仍存在不足。首先,胸痛中心的生物标志物检测项目、流程和方法尚不规范,缺乏可执行的参考标准;其次,大部分胸痛中心进行的生物标志物检测敏感度和特异度参差不齐、缺乏标准化,限制了生物标志物检测在急性胸痛诊断及鉴别诊断中的应用;最重要的是,虽然近年来基于生物标志物水平测定的CDP具有丰富的临床和检验医学研究证据的支持,但尚缺乏中国真实世界数据,与中国临床实际情况不符,也缺乏明确统一标准[2, 11]。
为满足胸痛中心日常临床工作需求,提升临床医师对急性胸痛诊疗中生物标志物的认识,中国医师协会心血管内科医师分会、国家放射与治疗临床医学研究中心、中国心胸麻醉协会检验医学分会心血管标志物规范化应用协作组和苏州工业园区东方华夏心血管健康研究院组织国内相关领域专家,撰写《胸痛中心规范化应用主要心血管生物标志物专家共识(2024)》 ,对急性胸痛诊疗相关主要生物标志物进行全面阐述和应用推荐,以期精准指导高危胸痛相关疾病的治疗,快速合理识别低危人群,从而有效规范胸痛中心急性胸痛临床诊疗工作流程,提升诊疗效率。
急性胸痛是临床常见症状之一,是以胸痛及胸部不适为主要表现的一组异质性急性疾病群[2]。与急性胸痛相关的疾病种类繁多且病情严重性差异极大,不仅包括ACS、AAS、PE、急性心肌炎和张力性气胸等高危致命性疾病,也包括胃食管反流、肋间神经痛、骨骼肌肉损伤、带状疱疹及神经官能症等疾病[12],故应立即对急性胸痛患者进行包括生命体征、心电图、病史及心胸血管影像检查,如经胸超声心动图(transthoracic echocardiography ,TTE)等,对病情进行初步评估,具体流程见图1。
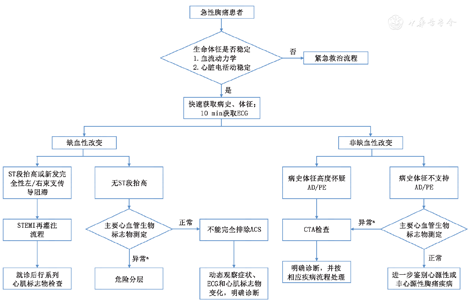

注:a不同临床路径、不同患者分层、不同检测平台应依据特异性截断值;ACS,急性冠状动脉综合征;AD,主动脉夹层;CTA, CT冠状动脉造影;ECG,心电图;PE,肺栓塞;STEMI, ST段抬高型心肌梗死
推荐意见1 首次医疗接触时,对需要利用生物标志物诊断、鉴别诊断或者危险评估的急性胸痛相关疾病的患者应进行主要心血管生物标志物检测。
在急性胸痛患者的诊疗过程中,心血管生物标志物的检测已成为诊断和风险评估的重要工具,它们能够为心肌损伤、心力衰竭和血栓形成等多种病理状态提供及时、可靠的检测结果,帮助临床医师快速决策,提高诊疗效率和患者预后。本部分将系统介绍胸痛中心常用的主要生物标志物,包括cTn、BNP/NT-proBNP、D-二聚体等,以及各标志物的检测方法、敏感度和特异度。
cTn是一种特异性表达在心肌细胞的结构蛋白复合物,包含cTnI、cTnT和cTnC三个亚基,各自结构特征见表1。

心肌肌钙蛋白3个亚基异同点
心肌肌钙蛋白3个亚基异同点
| 类别 | 相对分子质量 | 结构组成 | 主要功能 | 与sTn的同源性差异 | 心肌特异性 | 临床应用 |
|---|---|---|---|---|---|---|
| cTnI | 21 kD | 具有抑制区域 | 抑制肌肉收缩 | 有明显差异(约40%) | 特异性高 | 心肌损伤标志物 |
| cTnT | 37 kD | 连接肌钙蛋白复合物与肌丝 | 稳定复合物,锚定在肌原纤维上 | 有一定差异(6%~11%) | 特异性较高 | 心肌损伤标志物 |
| cTnC | 18 kD | 含有钙离子结合位点 | 感受钙离子信号,促进心肌收缩 | 高度同源,几乎无差异 | 无特异性 | 较少作为独立标志物 |
注:cTnI,心肌肌钙蛋白I; cTnT,心肌肌钙蛋白T; cTnC,心肌肌钙蛋白C; sTn,骨骼肌肌钙蛋白
cTn主要分布于心肌细胞的肌节细肌丝中,仅少量(2%~8%)以游离形式存在于细胞质内。当心肌细胞经历坏死、凋亡、更新或细胞膜通透性改变等生理病理过程时,cTn会从细胞内释放进入血液循环。在血液中,cTn会被进一步降解、片段化,并最终通过肾脏清除。这一过程尤其受到肾功能状态的影响,尤其是相对分子质量稍大的cTnT,其清除速度在肾功能受损时会显著减慢[13]。
cTn检测技术历经30余年革新,现有多达百余种临床检测试剂盒,通常采用双抗体夹心免疫原理检测样本中cTn,其中化学发光、免疫荧光等液相定量检测方法灵敏度和稳定性较好,在临床实践中展现出显著优势。但是不同检测方法在灵敏度和低浓度检测稳定性方面仍存在差异,依据国内外相关指南和共识,根据检测性能将cTn检测方法分为两类:普通敏感度cTn检测方法(contemporary cTn ,con-cTn)和高敏感度cTn检测方法(high sensitivity cTn, hs-cTn),两种方法均可作为急性胸痛分诊的标志物,但hs-cTn在早期鉴别诊断更有优势,已被多个指南推荐作为首选[2, 5,6, 11, 14,15]。同时需注意,cTn检测方法尚未标准化,不同检测系统的检测结果一致性差,不宜直接比较。
con-cTn检测方法需满足以下两个性能要求:(1)在20%~50%健康人群中能够检测到cTn,检测到的cTn浓度需等于或高于检出限(limit of detection ,LoD);(2)第99百分位值参考上限(99th upper reference limit ,99thURL)浓度下的总变异系数(coefficient of variation, CV)≤10%为指南可接受,总CV≤20%为临床可接受[16,17]。由于检测灵敏度有限,con-cTn不具备分设男女99th URL的能力,故男女性别采用同一99thURL。
hs-cTn检测方法需满足以下两个性能要求:(1)能够在不少于50%的男性和女性表观健康人群中均可稳定、可靠地检测到hs-cTn,且检测结果等于或高于LoD;(2)99th URL浓度下的总CV≤ 10%[16,17]。需要注意的是,不同hs-cTn试剂方法学具有不同的LoD和定量检测限(limit of quantification ,LoQ ),应采用绝对浓度变化值作为阈值[5,6,11,15]。不同性别间心脏质量、激素和代谢等具有差异,hs-cTn由于灵敏度高,故其99thURL在男性和女性中存在显著差异,在临床实践中采用性别特异性参考值对于提高诊断准确性和改善预后评估具有重要意义[18,19]。
目前,国内绝大部分现场快速检测(point-of-care testing,POCT)的检测性能属于con-cTn范畴,无法达到hs-cTn的性能要求[20]。值得注意的是,大量实验结果表明同一检测设备上血清、血浆与全血样本的检测性能可能存在差异,甚至乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)和肝素等不同抗凝剂的血浆的性能参数也有差异[21,22]。因此,当实验室同时应用不同样本类型进行检测时,应在使用前对每种样本类型进行独立的性能评估,以确保检测结果的准确性和一致性。
推荐意见2 cTn检测方法分为hs-cTn和con-cTn两类,均可作为急性胸痛分诊的标志物,hs-cTn为首选。con-cTn检测方法需在20%~50%健康人群的外周血中稳定地检测到cTn水平,而hs-cTn则要求在超过50%健康男性和女性人群的外周血中均能够稳定地检测到cTn水平。对于两类检测方法,在99th URL浓度下的总CV应≤10%,以满足指南要求。临床应用人员应了解hs-cTn和con-cTn检测方法的性能要求,并在实际应用前对所使用的检测方法及样本类型进行评估。
BNP主要由心肌细胞在机械性张力和充盈压增加时分泌的神经内分泌多肽。当心肌细胞膜将压力信号传至细胞内时,首先合成原前体肽,随后裂解成信号肽和BNP前体,再进一步酶解为无生物功能的N末端直链1~76氨基酸(amino acid,aa)的NT-proBNP和有生物学功能的C末端带有环状结构的77~108aa的BNP。理论上NT-proBNP和BNP被等摩尔数分泌到外周循环中,但由于二者分子大小不同、清除机制不同,因此外周血实际摩尔浓度并非1∶1关系。BNP主要通过与利钠肽清除受体(natriuretic peptide clearance receptors, NPR-C)结合进行受体介导的内化和溶酶体降解,也通过内肽酶降解和肾脏排泄。而NT-proBNP缺乏主动清除机制,主要通过肾脏、肌肉及肝脏等高血流量器官被动清除[23]。
BNP/NT-proBNP检测主要采用基于双抗体夹心原理的化学发光(如电化学发光、直接化学发光法及酶促发光法)和免疫荧光法。BNP检测通常采用识别不同表位的抗体与BNP形成抗原抗体复合物,其中一个抗体识别代表BNP活性形式的环状区表位,另一个识别其N端或C端非降解区。检测NT-proBNP一般选择特异性识别N末端和C末端的抗体对,以避开易受糖基化修饰的中心区域。用于心力衰竭分级时,BNP和NT-proBNP的截断值浓度下,CV应不高于10%[24]。
BNP和NT-proBNP水平均反映心脏的容量负荷,均是各心力衰竭治疗指南推荐的首选标志物[25]。二者排除和诊断急慢性心力衰竭的截断值见图2。但应注意BNP和NT-proBNP因分子结构、清除途径、半衰期和药物影响的不同而带来的细微差别。BNP具有生物学活性,可独立预测左心室舒张末期压力升高状况。BNP检测时对样本前处理要求略高,如必须采用非玻璃含EDTA抗凝剂采血管(含有胰蛋白酶抑制剂最佳),并且应在采集标本后4 h内上机检测[24]。BNP在不同平台检测方法间差异通常在15%~50%之间[26],NT-proBNP因大部分使用相同的抗体和校准物质,不同平台检测方法间差异相对较小(约10%)[27]。BNP和NT-proBNP均受到采血体位、采血前运动情况以及身体质量指数(body mass index,BMI)影响,建议抽血前静息10~15 min,连续监测时最好固定采血体位,尽可能缩短止血带使用时间。BNP和NT-proBNP水平均会随年龄增加而升高,与心脏和肾脏的结构和功能的生理性变化相关,但NT-proBNP依赖肾脏清除,其对年龄的反应略微敏感,临床上建议根据患者年龄调整这些标志物的参考值[28](图2)。由于经利钠肽C型受体清除,肥胖者(BMIgt;30 kg/m2)体内的受体数量增加或活性增强,导致出现与心功能不符的低值,建议将BNP和NT-proBNP的截断值降低50%,确保心力衰竭诊断的敏感度和准确性[28]。BNP和NT-proBNP均通过肾脏清除,肾功能下降时二者清除速率均降低,而NT-proBNP主要依赖于肾脏清除,所以其水平对肾功能的变化更加敏感。建议当估算肾小球滤过率(estimated glomerular filtration rate ,eGFR)< 60 ml· (min·1.73 m2)-1时,将BNP和NT-proBNP的诊断截断值提高1倍[29]。BNP检测在重组利钠肽和血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNI)类药物治疗过程中BNP水平会有所升高,这一现象反映了心脏负荷和药物干预的双重影响[30];NT-proBNP是无生物活性短肽,不受重组利钠肽和ARNI类药物治疗影响,反映心力衰竭严重程度并有助于预后评估[31,32];但是二者对患者预后评估的价值相同(表2)。
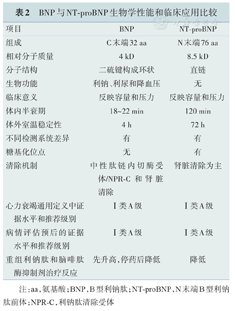
BNP与NT-proBNP生物学性能和临床应用比较
BNP与NT-proBNP生物学性能和临床应用比较
| 项目 | BNP | NT-proBNP |
|---|---|---|
| 组成 | C末端32 aa | N末端76 aa |
| 相对分子质量 | 4 kD | 8.5 kD |
| 分子结构 | 二硫键构成环状 | 直链 |
| 生物功能 | 利钠、利尿和降血压 | 无 |
| 临床意义 | 反映容量和压力 | 反映容量和压力 |
| 体内半衰期 | 18~22 min | 120 min |
| 体外室温稳定性 | 4 h | 72 h |
| 不同检测系统差异 | 有 | 有 |
| 糖基化位点 | 无 | 有 |
| 清除机制 | 中性肽链内切酶受体/NPR-C和肾脏清除 | 肾脏清除为主 |
| 心力衰竭通用定义中证据水平和推荐级别 | Ⅰ类A级 | Ⅰ类A级 |
| 病情评估预后的证据水平和推荐级别 | Ⅰ类A级 | Ⅰ类A级 |
| 重组利钠肽和脑啡肽酶抑制剂治疗反应 | 先升高,停药后降低 | 降低 |
注:aa,氨基酸;BNP, B型利钠肽;NT-proBNP ,N末端B型利钠肽前体;NPR-C,利钠肽清除受体
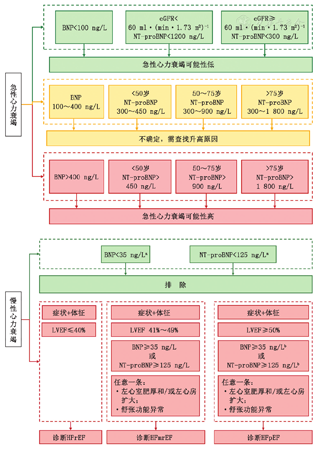

注:肥胖患者(身体质量指数≥30 kg/m2)BNP排除心力衰竭的截断值应<50 ng/L,BNP/NT-proBNP诊断截断值应降低50%;a20%~25%的HFpEF患者的BNP或NT-proBNP水平可能低于传统的心力衰竭诊断截断值(BNP<35 ng/L和NT-proBNP<125 ng/L);b心房颤动患者BNPgt;105 ng/L或NT-proBNPgt;365 ng/L; BNP, B型利钠肽;NT-proBNP,N末端B型利钠肽前体;LVEF,左心室射血分数;HFrEF,射血分数降低型心力衰竭;HFmrEF,射血分数轻度降低型心力衰竭;HFpEF,射血分数保留型心力衰竭
推荐意见3 BNP和NT-proBNP检测临床意义相似,均为心力衰竭诊断和鉴别诊断的首选标志物,但二者检测方法多样,不同检测方法结果间不能直接比较。因二者的分子结构、清除途径和半衰期的差异,临床应用中需注意年龄、肥胖、肾功能和药物对其影响。对于肾功能不全[eGFR<60 ml· (min·1.73 m2)-1]和肥胖者(BMIgt;30 kg/m2)BNP/NT-proBNP用于排除和诊断心力衰竭时需采用校正的截断值。
D-二聚体是纤溶酶降解血栓过程中生成的特异性纤维蛋白降解产物之一。凝血酶首先将纤维蛋白原水解为纤维蛋白单体,随后在ⅩⅢ因子作用下使纤维蛋白单体交联形成多聚体,纤溶酶将其降解为纤维蛋白降解产物,其中包含两个共价结合的D结构域的片段(D=D)与E片段以非共价键结合,形成D=D/E复合物,被称为D-二聚体[33]。D-二聚体在体内的半衰期约为8 h,主要通过肾脏和网状内皮系统从循环中清除。
D-二聚体是血栓形成及继发纤溶系统激活的重要标志物,水平升高不仅见于深静脉血栓、AAS、PE和弥漫性血管内凝血,也见于孕妇、肿瘤、炎症或慢性高凝状态,因此其阳性预测值相对较低。在正常生理状态下,2%~3%的血浆纤维蛋白原转化为纤维蛋白,纤维蛋白的降解可产生少量D-二聚体[34]。
D-二聚体检测通常采用能识别交联结构域的特异性抗体,常用方法包括酶联免疫吸附法、免疫荧光法、乳胶凝集法和化学发光法等。免疫法测定不仅可检测到单一D=D或D=D/E结构复合物,也可检测到含D-二聚体结构的多种片段混合物(相对分子质量为190~10 000 kD)。D-二聚体报告单位目前包括纤维蛋白原等价单位(fibrinogen equivalent unit,FEU)和D-二聚体单位(D-dimer unit ,DDU ),二者之间的换算关系大约为1.75倍。由于缺乏广泛验证,不同方法之间不可直接换算,检测报告应采用生产厂家推荐的单位,并在报告单上明确标注检测方法。D-二聚体尚无公认国际标准品和标准化溯源体系,不同方法和检测体系采用的特异性抗体不同,导致不同方法间敏感度、特异度和检测结果差异较大。因此,D二聚体用于PE和主动脉夹层等疾病排除时,不同方法不应简单采用同一截断值(灵敏度不足的D-二聚体检测不能可靠排除)。D-二聚体截断值诊断的敏感度应≥97%,阴性预测值应≥98%(置信区间下限≥95 %)[35]。如使用低敏感性检测方法,不能可靠地用于临床阴性排除。临床使用中,对于年龄不足50岁的患者,推荐使用固定的D-二聚体排除截断值;对于年龄超过50岁的患者,推荐使用年龄校正的D-二聚体排除诊断截断值,即年龄×10 ng/ml。在血栓形成时间小于6 h的情况下,由于D-二聚体尚未形成,建议对疑似患者进行动态连续检测[36,37]。
推荐意见4 D-二聚体是血栓形成和纤溶系统激活的标志物,不同检测方法具有不同敏感度、特异度及检测数值,两种报告单位(FEU和DDU)不能相互换算。D-二聚体在用于PE和AAS的排除诊断时应采用方法学特异和年龄校正的截断值。D-二聚体截断值的诊断敏感度应达到或超过97%,阴性预测值应不低于98%,以确保其用于临床排除诊断
根据当前指南和专家共识,hs-cTn被明确推荐为急性胸痛分诊和急性心肌梗死(acute myocardial infarction,AMI)诊断的首选生物标志物,其在敏感度和特异度方面显著优于传统标志物。相比之下,肌酸激酶(creatine kinase ,CK )、肌酸激酶同工酶(creatine kinase-MB,CK-MB)、乳酸脱氢酶(lactate dehydrogenase,LDH)、肌红蛋白(myoglobin,Myo)、心型脂肪酸结合蛋白(heart-type fatty acid binding protein ,hFABP)和缺血修饰白蛋白(ischemia-modified albumin ,IMA)等,单独或联合检测均不是判断心肌损伤和鉴别诊断心肌梗死的首选标志物。近期研究表明,这些标志物与hs-cTn联用也不能提供额外的诊断价值[38],仅在无法获得cTn检测或cTn存疑时,才建议将CK-MB质量浓度(不是CK-MB活性法)检测作为替补方法[6],并应采用性别特异的99th URL作为诊断截断值[20]。此外,由于CK-MB在心肌梗死后迅速下降,因此在判断心肌损伤时间(发病时长)及早期再梗死的诊断中CK-MB质量浓度法仍具有一定的补充诊断价值。值得注意的是,CK-MB质量浓度检测对ACS早期诊断的敏感度远低于cTn(特别是hs-cTn)。
推荐意见5 CK、CK-MB、LDH、Myo、hFABP、IMA均不推荐作为急性胸痛患者分诊的首选生物标志物,与hs-cTn联用并未增加额外诊断价值,不推荐作为急性胸痛分诊的常规检测。CK-MB质量浓度法仅用于无法获得cTn检测、cTn存疑或鉴别早期再梗死的辅助工具使用。
由于快速准确的诊断是合理分流和采取有效治疗的前提,急性胸痛的快速诊断及鉴别诊断是胸痛中心建设的第一要务。尽管心电图是最重要和最快捷的检查手段,但对于临床症状不典型或者就诊时症状已缓解和无典型心电图改变的患者,常常需要借助cTn、BNP/NT-proBNP及D-二聚体等生物标志物检测结果才能明确诊断。关于cTn的检测时间,按照最新国内外指南推荐的基于生物标志物连续观察的0~1 h或0~2 h快速诊断流程,所有检测系统从样本采集至结果报告的整体流转时间应在1 h内[5, 11, 39];依据中国胸痛中心的认证标准采用POCT检测方法,从完成抽血到获取报告的时间应在20 min内[40]。送检中心实验室的情况下,建议从标本采集到结果报告所需时间不超过1 h[20]。
cTn对心肌损伤诊断具有高敏感度和特异度,目前是ACS诊断的首选生物标志物,近期公布的ACS相关诊疗指南中,cTn是唯一推荐的生物标志物[23]。除STEMI和极高危NSTE-ACS患者需尽快实施再灌注治疗外,其他急性胸痛患者均需依靠cTn检测结果诊断或者排除心肌损伤与ACS。尤其是NSTE-ACS患者中的非ST段抬高型心肌梗死(non-ST-elevation myocardial infarction,NSTEMI)和不稳定型心绞痛(unstable angina,UA)鉴别诊断更是完全依赖cTn的结果,而这两种疾病的后续诊疗流程及预后也有较大差异[5,]。因此,帮助临床医生全面准确认识cTn,规范不同灵敏度的cTn应用,科学恰当解读cTn结果,在提升胸痛中心规范化应用生物标志物中具有重要意义。
cTn水平高于99th URL是心肌损伤的诊断标准,如伴随着上升或下降(≥20%)为急性心肌损伤;如持续升高,且幅度变化<20%则为慢性心肌损伤。con-cTn通常在心肌梗死患者出现症状4 h后升高,并持续2周左右。单次con-cTn检测水平不应作为唯一的诊断标准,因为在某些con-cTn阴性的高风险亚组人群中,患者的院内死亡率可能高达12.7%[41];但亦有指南建议对于胸痛症状发作超过12 h且目前较稳定的患者,可考虑单次con-cTn检测水平低于99th URL作为排除NSTEMI的标准[42,43]。hs-cTn的最大应用价值一是通过极低值(通常采用LoD或LoQ)安全排除NSTEMI,二是通过高的基线值或单位时间变化值快速诊断NSTEMI[6]。需注意hs-cTn极低值不适用于排除症状发作3 h内的患者[6]。在hs-cTn水平略高于99th URL的情况下需要鉴别的疾病谱较为广泛,高于99th URL的幅度越大,需要鉴别的疾病越少。hs-cTn的慢性、小幅升高常见于慢性肾病、糖尿病、左心室显著肥厚、慢性心力衰竭和结构性心脏病等。hs-cTn的中等程度升高常见于快速心律失常、急性心力衰竭、高血压危象、心包心肌炎、Takotsubo心肌病、主动脉疾病或PE等。hs-cTn水平明显升高常见于急性心肌梗死和急性心肌炎等疾病[44]。hs-cTn在99thURL附近的上升和/或下降所定义的心肌损伤只是心肌梗死通用定义的一个组成部分,而非单独定义(不是唯一决定因素)。临床无法解释的变化,临床应与检测人员及时沟通,积极查找干扰等检测原因。
另外,对于NSTE-ACS而言,危险分层是决定再灌注治疗时机的主要依据。一旦合并急性心力衰竭等血流动力学不稳定情况,将被视为极高危患者,建议在2 h内实施紧急介入治疗[2, 22]。因此,本共识推荐使用BNP和(或)NT-proBNP进行NSTE-ACS患者的危险分层,以帮助筛选出极高危患者,及时进行血运重建。
推荐意见6 cTn水平高于99th URL是心肌损伤的诊断标准,所有疑诊或确诊ACS的患者均应检测,是诊断AMI的必要条件。con-cTn检测水平低于99th URL不能单独作为NSTEMI排除标准,应在6 h后再次检测,观察其变化。hs-cTn单次检测低于LoD且症状发作超过3 h可安全排除NSTEMI ,需要在一定时间间隔之后动态观察其变化。BNP或NT-proBNP是ACS患者临床心功能评估和危险分层的重要依据,所有患者均应检测。
AAS主要包括主动脉夹层(aortic dissection ,AD)、主动脉壁内血肿和主动脉穿透性溃疡,是一组由于退行性改变和(或)外界机械应力导致主动脉壁(尤其是主动脉中层)结构完整性受损而引发的疾病[45],其中AD所占比例约80%[46]。在因急性胸痛就诊于胸痛中心的患者中,AAS发病急且死亡率高,多项注册研究显示,AD的院内死亡率超过10%,急性A型AD发病后每小时死亡率增加1%~ 2%[29]。因此,针对AAS的快速诊疗具有重要临床意义和社会效益。
AAS的确诊及后续治疗方案的选择依赖于以增强CT为代表的影像学检查结果,但增强CT的应用受到临床可行性、造影剂使用和电离辐射等因素的制约。D-二聚体作为一种反映机体凝血和纤溶系统激活的生物标志物,已被证明对AAS具有较高的排除诊断价值[47,48],尤其是在临床可能性低的患者中,阴性的D-二聚体检验结果可迅速排除AAS的诊断[49]。但值得注意的是,在壁间血肿早期的患者中,D-二聚体水平通常不升高[50]。因此,对于高度疑似AAS的高风险人群,无需检测D-二聚体,应采用经胸超声心动图TTE和增强CT直接明确诊断[4, 51]。此外,D-二聚体gt;500 ng/ml显著提高疑似急性AD患者的诊断能力[52]。然而,临床表现急性胸痛的肺栓塞患者D-二聚体水平也升高显著,D-二聚体不能有效区分急性AD和肺栓塞患者。新近研究指出,可溶性ST2联合D-二聚体可以鉴别诊断AD与其他以急性胸痛为主要临床表现的疾病(如ACS和PE),有望在症状发生早期准确快捷地鉴别诊断AD[53,54,55,56]。
推荐意见7 对于AAS临床可能性低的患者,D-二聚体检验结果阴性可迅速排除AAS的诊断(需要警惕发病早期的壁间血肿型AAS患者D-二聚体不一定升高);而对于高度疑似AAS患者,不宜依赖D-二聚体检测结果进行诊断,应该尽快完成影像学检查确诊。
PE是静脉血栓栓塞疾病中最严重、致死致残率最高的一种疾病[3]。PE急性期病情发展迅速,并且症状多变,给临床实践中的快速诊疗带来巨大挑战。据统计,因PE死亡的患者中,34%是猝死或者数小时内死亡,此时针对性的治疗往往尚未启动或生效;在剩余患者中,近60%是死亡后才确诊为PE,只有7%在死亡前得到明确诊断[57]。
与AAS相似,PE的明确诊断依赖于增强CT检查,而D-二聚体对疑似PE的急性胸痛患者,尤其是临床可能性低到中的患者具有较高的诊断和排除诊断的价值[58,59,60]。cTn和BNP/NT-proBNP在已确诊为PE患者的风险分层、预后评估及治疗选择中有重要作用。多项研究表明,con-cTn[61]或hs-cTn[62]的升高与PE患者死亡率增加关系密切,对于cTn升高的患者应采取更积极的治疗措施,包括再灌注治疗[8]。BNP/NT-proBNP的升高反映了急性PE引起右心室压力增加所导致的右心室功能障碍[37]。一项荟萃分析发现,BNP/NT-proBNP升高的PE患者早期死亡率高达10%,不良临床结局的发生率超过20 %[63]。针对血流动力不稳定而难以完成增强CT检查的疑似PE患者,床旁TTE和BNP/NT-proBNP联合识别右心室功能障碍是紧急启动再灌注治疗的重要指征[3]。cTn、BNP/NT-proBNP和D-二聚体等生物标志物的快速、便捷和准确测定,能够有效提升PE患者的临床诊疗效率。
推荐意见8 对于PE临床可能性低到中的患者,D-二聚体检验结果阴性可排除PE的诊断;对于高度疑似PE患者,不宜依赖D-二聚体检测结果进行诊断,应该尽快完成影像学检查确诊。
推荐意见9 对于疑似PE的患者应推荐结合hs-cTn、BNP/NT-proBNP和影像检查结果对PE患者进行风险分层,指导后续治疗方案的制定。
1.ACS患者的长期随访:ACS尤其是心肌梗死后患者的长期随访中,应高度关注患者心功能状态和心肌缺血复发情况。目前中国胸痛中心认证和质控标准中均要求ACS患者出院后1、3、6和12个月时进行规范随访,之后至少每年随访1次;对于ACS继发心力衰竭的患者,出院后1周应进行电话随访,出院后1、3、6和12个月时进行规范随访,之后至少每年随访1次。随访时应根据医疗机构及患者实际情况进行包括BNP/NT-proBNP和hs-cTn在内的生物标志物检查,以便与临床症状、体征、心电图以及TTE等检查结果联合评估患者临床状态,并及时调整二级预防方案[2]。另外,心力衰竭患者容易并发心腔血栓,可根据D-二聚体的水平变化指导抗凝药物的使用。
2.PE患者的长期随访:首次发生PE后平均每年再发PE的概率从2.5%至4.5%不等[8],因此,长期随访和管理非常重要。尽管目前没有循证医学证据提供长期随访的具体要求,但考虑到静脉系统血栓形成是大多数PE患者的发病基础,对康复后的PE患者进行D-二聚体检测可能有助于监测体内血栓形成的动态变化情况,并指导抗凝药物的停用或者剂量调整。同时,PE发生后有逐步发展为肺动脉高压和右心衰竭的可能,尤其是在急性期治疗不及时或不规范的患者,发生肺动脉高压的概率会更高。因此,对于临床症状提示肺动脉高压或者右心力衰竭的患者,应及时监测D-二聚体、BNP/NT-proBNP以评价患者的心功能状态[3]。
3.AAS患者的长期随访:经过规范化诊疗的AAS患者往往能获得令人满意的近中期预后,但仍有相当比例患者需要二次临床干预治疗,因此基于影像学的长期随访非常重要[4,]。目前,尚无在长期随访中检测相关生物标志物的临床证据。
推荐意见10 对于ACS患者,出院后1、3、6和12个月时进行规范随访,之后至少每年随访1次,随访时应根据患者病情变化情况进行包括hs-cTn和BNP/NT-proBNP在内的生物标志物检查。
推荐意见11 对于心力衰竭患者,出院后1、3、6和12个月时进行规范随访,之后至少每年随访1次。随访时应根据医疗机构及患者病情变化情况进行包括BNP/NT-proBNP在内的生物标志物检查。
如上文所述,疑似ACS、AAS及PE等疾病的急性高危胸痛患者,需要通过准确和快速的CDP进行有效的排除、诊断以及风险评估,生物标志物(包括cTn、BNP/NT-proBNP和D-二聚体等)在CDP各个环节均起到不可替代的作用[2,3,4,39,]。本共识综合最新的循证医学证据及胸痛中心运行过程中的实际临床情况,分别推荐针对ACS、AAS和PE的基于生物标志物测定的CDP,用于因急性胸痛就诊于胸痛中心患者的精准快速诊疗。
目前,大量循证医学证据支持将基于hs-cTn连续测定的快速CDP应用于疑似ACS的急性胸痛患者的临床诊疗[15, 39,43, 64],其中欧洲心脏学会Ⅰ级A类推荐的0~1 h快速CDP(最优选择,在就诊后0 h及1 h连续采血)或0~2 h快速CDP(次优选择,在就诊后0 h及2 h连续采血,后文中均可作为0~1 h快速CDP的替代)亦被美国近期发表的胸痛诊疗指南所采纳[5, 11]。相对于其他CDP,0~1 h快速CDP对临床风险评估依赖较少,在保证对心肌梗死患者诊断的敏感度和准确性的前提下,缩短了低危患者在急诊的停留时间及诊疗代价[65,66,67,68]。
0~1 h快速CDP主要有两个理论基础[65,66,67,68]:第一,hs-cTn的测定值是一个连续变量,hs-cTn值的升高直接反映了心肌梗死概率的增大;第二,hs-cTn早期的改变量可以作为3 h至6 h改变量的替代,并额外提供独立于0 h测定值的诊断和预后价值。但0~1 h快速CDP既需要具有足够诊断准确性的hs-cTn测定方法,也离不开与之配套的完整胸痛快速诊疗体系,因此现有国际指南及专家共识均强调须对hs-cTn检验方法和对应的0~1 h快速CDP进行严格验证后才可在临床应用[5,6, 11, 15,16, 39]。目前经过验证的0~1 h快速CDP多为基于中心实验室的hs-cTn测定,仅有少数基于POCT的hs-cTn在0~1 h快速CDP中的有效性和安全性得到验证[69,70]。最新研究结果表明,即使在欧美地区,目前0~1 h快速CDP在临床使用的比例只有10%左右[46]。我国幅员辽阔,人口众多,各地区之间的经济、科技和医疗水平差距较大,即使是在同一地区,不同等级医院之间,胸痛中心标准版、基层版以及胸痛救治单元等医疗机构之间亦在hs-cTn和con-cTn及中心实验室和POCT等技术应用方面存在较大差异。因此,在设立胸痛中心的医疗机构中统一应用基于hs-cTn的0~1 h快速CDP应当更为谨慎,需要从安全性、可行性和有效性等多方面进行考量。
相较于对检验方法学要求严格的0~1 h快速CDP的安全和高效,0~3 h快速CDP可作为备选方案(推荐等级为Ⅱa,B)[5, 11]。首先,与0~1 h快速CDP相比,0~3 h快速CDP牺牲了一部分有效性,但安全性得到了保障。分别以快速排除NSTEMI的患者占比和诊断NSTEMI的阴性预测值作为衡量有效性和安全性的主要指标,汇总分析近期将两种路径直接比较的研究可发现:0~1 h快速CDP的阴性预测值接近100%,而0~3 h快速CDP也保持在96%以上,但快速排除比例有所下降,患者停留时间有所延长[71,72,73]。另外,亦有研究发现,0~3 h快速CDP受检验方法学影响较小,大部分hs-cTn均可满足要求[15]。但单纯依赖con-cTn的测定难以快速准确地对ACS进行排除和诊断,故需将con-cTn的测定与风险评分有机结合形成CDP[2]。在此类CDP中,基于连续con-cTn测定和HEART评分的CDP循证医学证据最为充足,其诊断NSTEMI以及预测30 d内临床事件的敏感度均达100%,且能快速排除低危患者,受到近期急性胸痛诊疗相关指南及专家共识的推荐[64]。更具临床意义的是,HEART评分操作简捷(详见附表1),准确性较高,可基本满足胸痛中心的日常诊疗需求[74]。
综上所述,结合最新的循证医学证据及临床的实际情况,本共识分别推荐基于hs-cTn的0~1 h快速CDP[5,6, 11]、基于hs-cTn的0~3 h快速CDP[15]和基于con-cTn及HEART评分的CDP[2,64]应用于因疑似ACS就诊于胸痛中心的急性胸痛患者临床诊疗,不同机构选择时应了解所用检测平台的检测性能是属于con-cTn还是hs-cTn,然后根据机构具体情况制定适合自身的CDP。
推荐意见12 不同机构根据具体情况选择合适的CDP,包括基于hs-cTn的0~1 h快速CDP、基于hs-cTn的0~3 h快速CDP和基于con-cTn及HEART评分的CDP。
0~1 h快速CDP是根据临床实际情况分别在就诊后0 h、1 h和3 h进行hs-cTn检测,根据hs-cTn的绝对值及相对变化并结合心电图改变、临床表现和风险评估(见附表1)快速对患者进行分类,具体流程见图3,经过验证的方法学特异的hs-cTn截断值请参照欧美指南与中国专家共识[5, 11, 16,39]。基于hs-cTn的0~2 h快速CDP流程第二次hs-cTn测定在2 h进行,其余与0~1 h快速CDP流程相似,但应注意使用对应的hs-cTn截断值[39]。
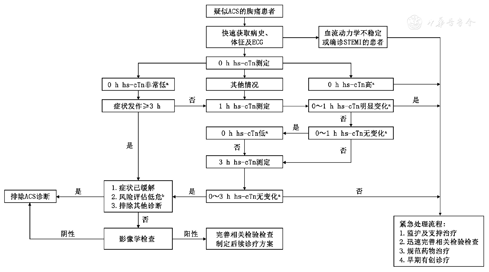

注:ahs-cTn不同时间点的不同阈值具有明确的方法特异性(详见国际临床化学与实验室医学联盟网站,网址http://www. ifcc. org/ifcc-education-division/emd-committees/committee-on-clinical-applications-of-cardiac-bio-markers-c-cb);b具体的风险评估方法及对应的危险分层详见附表1 ;ACS,急性冠状动脉综合征;ECG,心电图;hs-cTn,高敏肌钙蛋白;STEMI ,ST段抬高型心肌梗死。
如能保证hs-cTn测量,推荐基于hs-cTn的0~3 h快速CDP[15]。0~3 h快速CDP是根据临床实际情况分别在就诊后0 h、3 h和6 h进行hs-cTn检测,并结合心电图改变、临床表现和风险评估(见附表1)快速对患者进行分类,具体流程见图4。
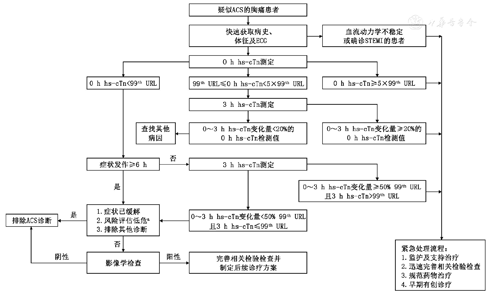

注:a具体的风险评估方法及对应的危险分层详见附表1; 99th URL,正常值上限,一般是由健康人群第99百分位值确定;ACS,急性冠状动脉综合征;ECG,心电图;hs-cTn,高敏肌钙蛋白;STEMI ,ST段抬高型心肌梗死
如无法保证hs-cTn测量,可采用基于con-cTn和风险评估集合的CDP[64],该CDP根据需要分别在就诊后0 h和6~9 h采血,并结合风险评估对患者进行分类,不同con-cTn阈值见国际临床化学与实验室医学联盟网站(http://www.ifcc.org/ifcc-education-division/emd-committees/committee-on-clinical-applications-of-cardiac-bio-markers-c-cb),具体流程见图5。
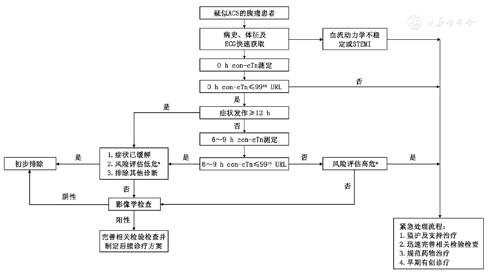

注:a具体的风险评估方法及对应的危险分层详见附表1 ;99th URL,正常值上限,一般是由健康人群第99百分位值确定;ACS,急性冠状动脉综合征;con-cTn,普通敏感肌钙蛋白;ECG,心电图;STEMI ,ST段抬高型心肌梗死
该CDP首先利用已被广泛验证并推广的主动脉夹层诊断风险评分(附表2)对血流动力学稳定的疑似AAS的急性胸痛患者进行评估[4,]。该评分从病史、症状以及体征三方面对患者进行评分,0或1分为临床可能性低,2或3分为临床可能性高(见附表2)。TTE识别的AAS直接征象主要为明确的主动脉内膜撕裂[4, 51]。该CDP结合临床可能性、D-二聚体、TTE及增强CT检查快速诊断或排除AAS,详见图6。
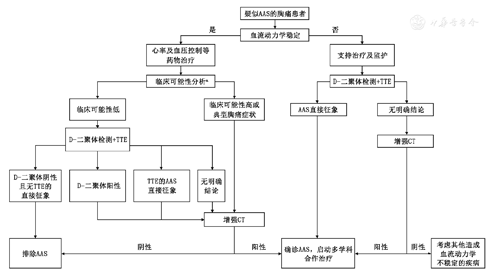

注:a具体的临床可能性评估方法及对应的分层详见附表2;AAS,急性主动脉综合征;TTE,经胸超声心动图
推荐意见13 对临床可能性低的AAS患者进行D-二聚体及TTE检查,D-二聚体阴性且TTE检查无AAS直接征象可排除AAS诊断,其他情况需进一步完善增强CT检查;对临床可能性高或具有典型胸痛症状的AAS患者首选进行增强CT检查。
该CDP根据修订的日内瓦临床预测规则将血流动力学稳定的疑似PE患者分为低、中及高度临床可能性三类或PE不太可能和很可能两类(见附表3)。对于确诊PE的患者,综合考虑血流动力学情况、PE严重程度指数(见附表4)、生物标志物、影像检查结果(增强CT和TTE)以及客观医疗条件对患者进行风险评估,采取对应治疗方案(详见图7)[3]。
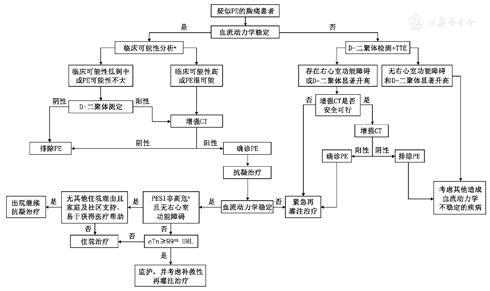

注:a具体的临床可能行分析方法及对应的分层详见附表3;bPESI具体的评估方法及对应的危险分层详见附表4; 99th URL,正常值上限,一般是由健康人群第99百分位值确定;PE,肺栓塞;PESI, PE严重程度指数;TTE,经胸超声心动图
推荐意见14 对临床可能性低到中的PE患者进行D-二聚体检测,对检测结果阳性的患者进行增强CT检查,阴性患者可排除PE诊断;对临床可能性高的PE患者首选增强CT检查。
综上所述,患者病史和临床表现、ECG、生物标志物是急性胸痛患者诊疗过程中最重要的三个方面。任何生物标志物发挥最大临床诊断价值均应依赖于检测质量的控制和规范化应用(见附件),并应结合临床评估和其他检查手段。当临床与实验室检测结果不符合时,应积极查找检测原因和临床病因。生物标志物的规范合理应用,尤其是在胸痛中心推广准确、高效及符合临床实际需求的基于生物标志物的CDP,可以为急性胸痛患者的临床诊疗工作提供更好的客观依据,有利于提高急性胸痛相关疾病诊断的敏感度和特异度,改善危险分层及预后判断的能力,有助于早期识别并精准治疗高危胸痛相关疾病,快速安全分流低危人群,从而有效规范胸痛中心急性胸痛临床诊疗工作流程,提升诊疗效率。
共同执笔人:
张真路(武汉亚洲心脏病医院检验科);蔺亚晖(中国医学科学院阜外医院检验科);周伽(天津市胸科医院心内科);李玲(武汉亚洲心脏病医院检验科);梁岩(中国医学科学院阜外医院重症医学科ICU病房)
参与共识制定的专家(按姓名拼音排序):
陈韵岱(解放军总医院第六医学中心心内科);陈玉国(山东大学齐鲁医院急诊科);方唯一(复旦大学附属华东医院心内科);高传玉(阜外华中心血管病医院心内科);葛均波(复旦大学复属中山医院心内科);关坤萍(山西医科大学第二医院检验科);胡敏(湘雅医学院附属第二医院检验科);黄恺(华中科技大学同济医学院附属协和医院心内科);霍勇(北京大学第一医院心内科);贾克刚(泰达国际心血管病医院检验科);蒋峻(浙江大学医学院附属第二医院心内科);蒋黎(四川省人民医院检验科);李春洁(天津市胸科医院急诊科);李浪(广西医科大学第一附属医院心内科);李玲(武汉亚洲心脏病医院检验科);梁岩(中国医学科学院阜外医院重症医学科ICU病房);蔺亚晖(中国医学科学院阜外医院检验科);刘峰(上海交通大学医学院苏州九龙医院心内科);罗素新(重庆医科大学附属第一医院心内科);马根山(东南大学附属中大医院心内科);马礼坤(安徽省立医院心内科);马丽娟(首都儿科研究所附属儿童医院心内科);潘柏申(复旦大学附属中山医院检验科);石蓓(遵义医科大学心血管病医院心内科);苏晞(武汉亚心总医院心内科);王华梁(上海市临床检验中心检验科);王利新(宁夏医科大学总医院心血管分院检验科);王焱(厦门大学附属心血管病医院心内科);王媛(首都医科大学附属北京安贞医院心血管基础与转化医学研究中心);向定成(解放军南部战区总医院心内科);谢华斌(厦门大学附属心血管病医院检验科);徐亚伟(同济大学附属第十人民医院心内科);许俊堂(北京大学人民医院心内科);杨丽霞(解放军联勤保障部队第九二〇医院心内科);杨艳敏(中国医学科学院阜外医院急诊科);袁弘(大连市中心医院检验科);袁祖贻(西安交通大学第一附属医院心内科);张立(四川大学华西医院心内科);张义(山东大学齐鲁医院检验科);张真路(武汉亚洲心脏病医院检验科);张钲(兰州大学第一医院心内科);郑博(北京大学第一医院心内科);郑磊(南方医科大学南方医院检验科);周伽(天津市胸科医院心内科);周厚清(中国医学科学院阜外医院深圳医院检验科);周欣(天津医科大学总医院心内科);周洲(中国医学科学院阜外医院检验科)
中国医师协会心血管内科医师分会,国家放射与治疗临床医学研究中心,中国心胸麻醉协会检验医学分会心血管标志物规范化应用协作组,等.胸痛中心规范化应用主要心血管生物标志物专家共识(2024) [J/OL].中华心血管病杂志(网络版),2024, 7: e1000174(2024-10-31). http://www.cvjc.org.cn/index. php/Column/columncon/article_id/354. DOI:10.3760/cma.j.cn116031.2024.1000174.
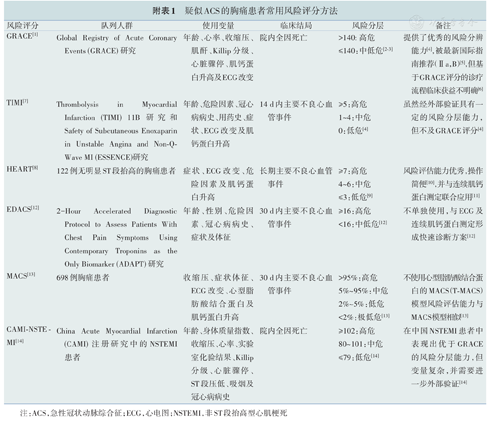
疑似ACS的胸痛患者常用风险评分方法
疑似ACS的胸痛患者常用风险评分方法
| 风险评分GRACE[1] | 队列人群Global Registry of Acute Coronary | 使用变量年龄、心率、收缩压、 | 临床结局院内全因死亡 | 风险分层>140:高危 | 备注提供了优秀的风险分辨 |
|---|---|---|---|---|---|
| Events (GRACE)研究 | 肌酐、Killip分级、心脏骤停、肌钙蛋白升高及ECG改变 | ≤140:中低危[2,3] | 能力[4],被最新国际指南推荐(Ⅱa,B)[5],但基于GRACE评分的诊疗流程临床获益不明确[6] | ||
| TIMI[7] | Thrombolysis in Myocardial Infarction (TIMI) 11B研究和Safety of Subcutaneous Enoxaparin in Unstable Angina and Non-Q- Wave MI (ESSENCE)研究 | 年龄、危险因素、冠心病病史、用药史、症状、ECG改变及肌钙蛋白升高 | 14 d内主要不良心血管事件 | ≥5:高危1~4:中危0:低危[4] | 虽然经外部验证具有一定的风险分层能力,但不及GRACE评分[4] |
| HEART[8] | 122例无明显ST段抬高的胸痛患者 | 症状、ECG改变、危险因素及肌钙蛋白升高 | 长期主要不良心血管事件 | ≥7:高危4~6:中危≤3:低危[9] | 风险评估能力优秀,操作简便[10],并与连续肌钙蛋白测定联合应用[11] |
| EDACS[12] | 2-Hour Accelerated Diagnostic Protocol to Assess Patients With Chest Pain Symptoms Using Contemporary Troponins as the Only Biomarker (ADAPT)研究 | 年龄、性别、危险因素、冠心病病史、症状及体征 | 30 d内主要不良心血管事件 | ≥16:高危<16:中低危[12] | 不单独使用,与ECG及连续肌钙蛋白测定形成快速诊断方案[12] |
| MACS[13] | 698例胸痛患者 | 收缩压、症状体征、ECG改变、心型脂肪酸结合蛋白及肌钙蛋白升高 | 30 d内主要不良心血管事件 | >95%:高危5%~95%:中危2%~5%:低危<2%:极低危[13] | 不使用心型脂肪酸结合蛋白的MACS(T-MACS)模型风险评估能力与MACS模型相似[13] |
| CAMI-NSTE - MI[14] | China Acute Myocardial Infarction(CAMI)注册研究中的NSTEMI患者 | 年龄、身体质量指数、收缩压、心率、实验室化验结果、Killip分级、心脏骤停、ST段压低、吸烟及冠心病病史 | 院内全因死亡 | ≥102:高危80~101:中危≤79:低危[14] | 在中国NSTEMI患者中表现出优于GRACE的风险分层能力,但变量复杂,并需要进一步外部验证[14] |
注:ACS,急性冠状动脉综合征;ECG,心电图;NSTEMI,非ST段抬高型心肌梗死

主动脉夹层诊断风险评分[15]
主动脉夹层诊断风险评分[15]
| 高危病史 | 高危症状 | 高危体征 |
|---|---|---|
| 马凡综合征(或其他结缔组织疾病) | 胸痛、背痛或腹痛有以下任一特点: | 灌注不足的证据: |
| 主动脉疾病家族史 | -突然发作 | -脉搏短绌 |
| 确诊主动脉瓣疾病 | -疼痛剧烈 | -出现收缩压差异 |
| 确诊胸主动脉瘤 | -撕裂样疼痛 | -局部神经功能缺损 |
| 既往主动脉手术操作史 | 新发主动脉瓣杂音 | |
| 低血压或休克 |
注:该评分从高危病史、高危症状以及高危体征三方面对患者进行评分;每一方面满足任一项为1分,患者个体评分最低为0分,最高为1分;0或1分为临床可能性低,2或3分为临床可能性高
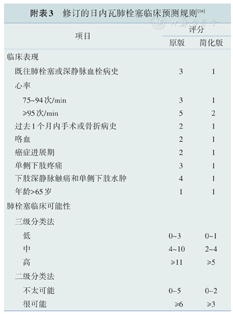
修订的日内瓦肺栓塞临床预测规则[16]
修订的日内瓦肺栓塞临床预测规则[16]
| 项目 | 评分 | |
|---|---|---|
| 原版 | 简化版 | |
| 临床表现 | ||
| 既往肺栓塞或深静脉血栓病史 | 3 | 1 |
| 心率 | ||
| 75~94次/min | 3 | 1 |
| ≥95次/min | 5 | 2 |
| 过去1个月内手术或骨折病史 | 2 | 1 |
| 咯血 | 2 | 1 |
| 癌症进展期 | 2 | 1 |
| 单侧下肢疼痛 | 3 | 1 |
| 下肢深静脉触痛和单侧下肢水肿 | 4 | 1 |
| 年龄>65岁 | 1 | 1 |
| 肺栓塞临床可能性 | ||
| 三级分类法 | ||
| 低 | 0~3 | 0~1 |
| 中 | 4~10 | 2~4 |
| 高 | ≥11 | ≥5 |
| 二级分类法 | ||
| 不太可能 | 0~5 | 0~2 |
| 很可能 | ≥6 | ≥3 |
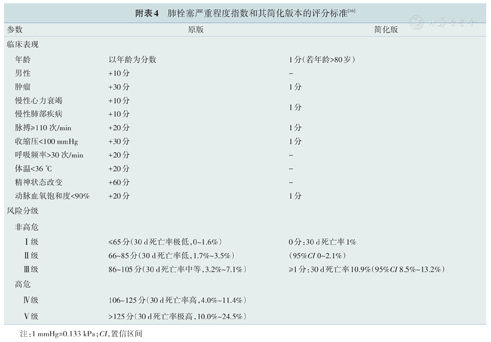
肺栓塞严重程度指数和其简化版本的评分标准[16]
肺栓塞严重程度指数和其简化版本的评分标准[16]
| 参数 | 原版 | 简化版 |
|---|---|---|
| 临床表现 | ||
| 年龄 | 以年龄为分数 | 1分(若年龄>80岁) |
| 男性 | +10分 | - |
| 肿瘤 | +30分 | 1分 |
| 慢性心力衰竭 | +10分 | 1分 |
| 慢性肺部疾病 | +10分 | |
| 脉搏≥110次/min | +20分 | 1分 |
| 收缩压<100 mmHg | +30分 | 1分 |
| 呼吸频率>30次/min | +20分 | - |
| 体温<36 ℃ | +20分 | - |
| 精神状态改变 | +60分 | - |
| 动脉血氧饱和度<90% | +20分 | 1分 |
| 风险分级 | ||
| 非高危 | ||
| Ⅰ级 | ≤65分(30 d死亡率极低,0~1.6%) | 0分:30 d死亡率1% |
| Ⅱ级 | 66~85分(30 d死亡率低,1.7%~3.5%) | (95%CI 0~2.1%) |
| Ⅲ级 | 86~105分(30 d死亡率中等,3.2%~7.1%) | ≥1分:30 d死亡率10.9%(95%CI 8.5%~13.2%) |
| 高危 | ||
| Ⅳ级 | 106~125分(30 d死亡率高,4.0%~11.4%) | |
| Ⅴ级 | >125分(30 d死亡率极高,10.0%~24.5%) |
注:1 mmHg=0.133 kPa; CI,置信区间
临床检测前(包括POCT)应尽量选择溯源至国际参考物质的检测方法,并依据EP文件验证空白检测限(limit of blank ,LoB)、LoD、定量限(limit of quantitation ,LoQ )、精密度、可报告范围、抗干扰能力和临床诊断能力,此后每年至少验证1次,也可以根据需要增加次数[17,18]。
LoD和LoQ是用于早期快速排除急性心肌梗死诊断的重要指标,各种cTn检测开展前应依据EP-17文件标准评估或验证LoD以及20%(或10%)CV的LoQ。
评价检测方法99th URL附近的总CV是判断方法学是否符合指南或临床可接受的必要标准。验证过程中需要考虑不同类型采血管对结果的影响。对于能检测全血的POCT,应分别对全血和血浆(或血清)的检测性能进行验证。
URL及正常人检出率:判断检测方法灵敏性分类的标准之一是表观健康人群的检出率,同时99th URL是诊断心肌损伤的必要条件,有条件的实验室可根据要求建立99th URL,或采用不少于20例符合要求的样本进行验证。
不建议同一医疗机构同时开展多种方法的cTn检测。如同时开展hs-cTn和POCT检测,则要对POCT诊断急性心肌梗死的灵敏度进行临床评估,能否满足临床早期诊断及危险分层的需要。
评估线性范围:BNP/NT-proBNP检测下限应达到5 ng /L,BNP检测上限应达到5 000 ng /L ,NT-proBNP检测上限应达到30 000 ng/L。
评估精密度,在急、慢性心力衰竭诊断阈值附近对应的CV≤10%。
评估线性范围,优秀的检测方法具有较宽的测量范围,至少达到0.2~20 mg/L。
评估精密度,尤其关注排除阈值附近的精密度CV应≤10%。
评估抗干扰能力,包括对纤维蛋白原、纤维蛋白原其他降解产物、乳糜血、血色素及胆红素对检测结果的影响。
应用过程中应定期检测合适浓度的质控品以确保检测系统精密度[17]。对于hs-cTn检测,临床实验室应该每天至少检测3种浓度的质控物各1次,单位为ng/L,小数点后保留1位小数。(1)浓度1: 1介于LoD和最低的性别特异性99thURL之间的浓度(体现hs-cTn价值的重要浓度范围),现在国际专业质控物生产公司已有针对不同厂家hs-cTn这一浓度范围的专门质控物,使用科室应努力加强这一区间的质量监控,CV应符合厂家声明;(2)浓度2:浓度稍高于较高性别特异性的99th URL,但不要超过URL的20%,CV应≤10%;(3)浓度3:可报告结果的最高浓度或实验室可见的最高样本数值(例如数倍于99thURL),CV应≤10%。对于cTn及POCT检测,临床实验室应该每天至少检测两种浓度的质控物1次,单位为ng/ml或μg/L,小数点后保留3位小数,CV应≤20%。(1)浓度1:接近99th URL(总体20%以内);(2)浓度2:可报告结果的最高浓度或实验室可见的最高样本数值(例如数倍于99th URL)。高水平质控物的具体浓度取决于各个医院所服务的患者种类。例如,对于冠状动脉旁路移植术患者而言,10倍的99th URL浓度可能是高水平质控物的合适浓度值。
对于所有检测方法(包括POCT)均建议参加高水平室间质评活动,同一医疗机构内,同品牌、同性能的cTn检测方法,可选一台参加室间质评参加高水平室间质评活动,而其他设备与之做比对实验,机构内对于各临床科室的POCT检测至少每半年1次与中心实验室进行比对,测量结果之间的偏倚应≤20%[17]。


























