
唾液腺导管内癌(IDC)是较罕见的低级别唾液腺恶性肿瘤,2022年第5版WHO头颈部肿瘤分类更新其内容。IDC的确诊不仅依赖于病变组织的形态学特征,还需要免疫组化辅助诊断,需与腺样囊腺癌、腺泡细胞癌的乳头状囊性亚型、乳头状囊腺癌(腺癌;非特殊类型)、唾液腺导管癌、类似乳腺分泌性癌的腮腺肿瘤(分泌性癌)、硬化性多囊性腺瘤等多种疾病进行鉴别诊断。本文探讨1例IDC的临床及病理学特征,旨在提高和加深病理和临床医师对IDC认识,精准评估IDC生物学行为及预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
唾液腺发生的导管内癌(intraductal carcinoma)组织病理学特征是完全或主要表现为导管内的乳头状、筛状和实性的增生,类似乳腺导管原位癌或不典型导管内增生的病变。1983年Chen就描述了发生于口腔内的类似病变[1],其命名经历了低度恶性筛状囊腺癌、低级别唾液腺导管癌、原位唾液腺癌等一系列的变化[2],在2022年第5版WHO头颈部肿瘤分类更新命名为导管内癌[3]。大多数导管内癌在癌巢周围存在肌上皮细胞,但罕见病例伴有显著的浸润性生长和癌巢周围肌上皮的缺失。因此有研究者认为导管内癌是双相性肿瘤而不是真正的导管原位癌。本文报道1例原发颊黏膜导管内癌,免疫组化染色显示导管周围存在完整的肌上皮,易与腺样囊腺癌、腺泡细胞癌的乳头状囊性亚型、乳头状囊腺癌(腺癌;非特殊类型)、唾液腺导管癌、类似乳腺分泌性癌的腮腺肿瘤(分泌性癌)、硬化性多囊性腺瘤混淆。本病例结合文献分析,旨在提高对该肿瘤的认识,避免因其认识不足而导致的误诊,也有助于评估导管内癌的生物学行为及预后风险评估,为临床精准治疗提供依据。
(1)一般资料:患者女性,79岁,因发现左侧颊黏膜磨牙后区“黄豆粒”大小肿物于2023年5月就诊徐州市第一人民医院口腔科,患者无自发痛和麻木感,但稍有触压痛。患者否认外伤、手术史、药物、食物过敏史。患者基本情况尚可,全身浅表淋巴结无肿大,系统体格检查未及异常,各辅助检查亦无阳性发现。
(2)检查:B超示左颊黏膜见1个1.1 cm×0.5 cm×0.5 cm大小的低回声囊实性肿物,边界欠清。CT平扫示左颊黏膜区体积增大,密度不均,可见类圆环形低密度影。
(3)初诊及治疗:初步诊断左颊区肿物,性质待定。经口腔科综合评估,完善术前所有常规检查后,先行手术肿物完整切除术,送病理活检明确病变性质。
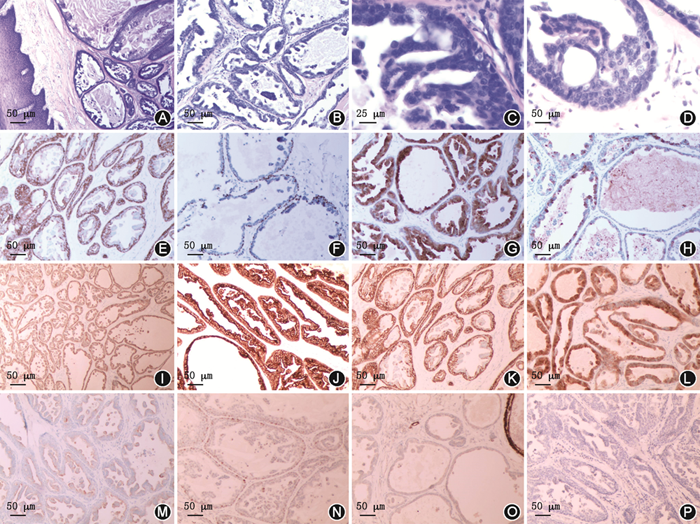
(4)术后诊断:标本大体为灰黄灰红色组织一块,大小3.0 cm×2.0 cm×1.5 cm,切开见灰白色结节,大小1.0 cm×0.5 cm×0.5 cm,与颊黏膜组织分界尚清,质地稍硬。镜下显示,肿瘤由纤维组织间隔分割成大小不等的囊实性巢团状区域,部分区域囊腔扩张,内见肿瘤细胞增生呈乳头状、微乳头状,部分区域囊腔内肿瘤细胞呈筛网状,部分区域囊腔内充满红染分泌物,肿瘤细胞体积中等大小,核呈圆或椭圆状,轻度异型性(低核级),核仁不明显、核分裂偶见,囊状管腔周边可见基底细胞排列(图1A~D)。免疫组化示细胞角蛋白(cytokeratin,CK)5/6和p63均为肌上皮阳性,CK14、钙调理蛋白(Calponin)、34βE12、巨囊性病液体蛋白-15(gross cystic disease fluid protein 15,GCDFP15)、S100蛋白、SOX10均为阳性,Ki-67(+10%),CK8/18表现为腔缘阳性,p53为散在弱阳性,平滑肌肌球蛋白重链(smooth muscle myosin heavy chain,SMMHC)、雄激素受体(androgen receptor,AR)均为阴性(图1E~P)。RET断裂探针FISH检测结果,>50%的肿瘤细胞核内发现一红一绿两信号,提示该基因发生异常(图2)。院外(乐士医学检验实验室)基因检测显示有NCOA4-RET融合。结合HE及免疫组化结果最终诊断为导管内癌。



(5)术后随访:患者术后未再接受其他治疗,每隔6个月复诊1次,末次复查为2024年5月,未见肿瘤有复发,状况尚好。
2. 讨论:唾液腺导管内癌一种罕见的类似乳腺导管原位癌或典型导管内增生的肿瘤性病变,病理诊断特征是肿瘤性上皮在导管内增生,形成实性、乳头样、筛孔样及微乳头样结构,WHO的ICD-O编码(8500/2)导管内癌发病罕见,发病年龄广泛(17~90岁),男女比例差异无统计学意义。导管内癌的生物学行为较惰性,罕有浸润性生长的病例,无远处转移,多发生于腮腺,少见于颌下腺、颊黏膜等。肿瘤大体形态无包膜,多结节状,与正常唾液腺组织分界清晰,呈膨胀性推挤性生长。组织学分型有闰管型、顶浆分泌型、嗜酸型和混合型,依据细胞核特点可分成低级别和高级别。4种分型导管内癌的共性是镜下可见肿瘤在大小不等的囊腔或导管内增生,囊腔和导管的周围围绕一层连续的、扁平的肌上皮细胞。不同组织学分型的导管内癌其细胞学各有特点,闰管型导管内癌的细胞呈圆形或卵圆形,细胞质嗜酸性或嗜双色性,核仁不显著,肿瘤细胞核多表现低级别,仅在出现浸润性病变时,可能出现细胞核异型增大,向高级别转化的趋势;免疫组化S100、SOX10、乳腺球蛋白(mammaglobin)常过表达,分子表型常见NCOA4-RET的融合,个别存在STRN-ALK融合[4, 5]。顶浆分泌型导管内癌细胞体积稍大、细胞质丰富嗜酸性,瘤细胞核圆且核仁突出、常呈多形性改变,多伴有顶浆分泌现象、出血和明显粉刺样坏死,故细胞核级别可低可高,但以高级别核占主导;镜下肿瘤形态表现多样,免疫组化表现对AR有高反应性;分子表型上具有复杂遗传特点,多具有RAS、PIK3CA、TP53的改变[6]。嗜酸型导管内癌细胞核呈圆形,核仁突出,与顶浆分泌型导管内癌的鉴别是具有丰富的颗粒状嗜酸性的细胞质,多呈致密的实性生长模式。本例患者根据HE染色细胞核的特征及免疫组化、分子检测更倾向于闰管型导管内癌。
导管内癌需与多种疾病进行鉴别诊断。①腺样囊腺癌由导管细胞和肌上皮细胞两层细胞构成,可表现多种结构模式(实体型、筛状型、管状型或混合型)。筛状型的腺样囊腺癌形态易与导管内癌混淆,借助免疫组化检测导管内癌外肌上皮的存在可鉴别二者。②腺泡细胞癌的乳头状囊性亚型,由腺泡细胞、闰管细胞、透明细胞、空泡状细胞和非特异性腺样细胞构成,表现多种结构模式(实体型、滤泡型、乳头状囊性型)。顶浆分泌型导管内癌易与乳头状囊性亚型腺泡细胞癌混淆,除了根据是否存在肌上皮鉴别二者外,还可借助腺泡细胞癌表达NR4A3、DOG1及不表达S-100鉴别诊断[4]。③乳头状囊腺癌,又称为低度恶性乳头状腺癌,在第5版WHO头颈部肿瘤分类中被归为腺癌,非特殊类型,代表一组无法分类的伴有导管细胞成分的唾液腺型腺癌,多属于排除性诊断。镜下多以囊性增生为主,伴有乳头状突起,具有低级别的外观,囊肿和乳头状结构的上皮是由大的或小的立方形/柱状细胞组成,细胞学形态一致,有丝分裂象罕见。与导管内癌相比,乳头状囊腺癌常表现出显著的浸润性生长,且免疫组织化显示囊周围缺乏肌上皮细胞表达。④唾液腺导管癌,一种高度侵袭性的类似于高恶乳腺导管癌的唾液腺恶性肿瘤,肿瘤多呈圆形或囊状结节,形态学特征为可见大汗腺分化和免疫组化表达AR和GCDFP15。GATA3阳性有助于与导管内癌鉴别。尤其与顶浆分泌型导管内癌的鉴别,后者一般边界清楚,呈多结节状生长,纯原位缺乏浸润性生长,即使存在浸润性生长,通常也是局灶性或具有导管内癌的整体特征,神经累犯罕见,唾液腺导管癌粉刺状坏死显著,且易见神经和淋巴管浸润。另外,唾液腺导管癌细胞具有的高度多形性和细胞质内含嗜酸性颗粒细胞的特点也是鉴别两者的依据。⑤类似乳腺分泌性癌的腮腺肿瘤,WHO头颈部肿瘤分类将其命名为分泌性癌,好发于腮腺,其次是颌下腺,也有罕见部位(皮肤、肺等)的病例报道。镜下呈囊性(大囊或微囊)为主的特异性结构,囊性结构约65%,乳头状结构约35%,肿瘤细胞胞质较丰富、呈空泡状,多数可见嗜酸性分泌物,少数病例可见嗜碱性分泌物,核异型性不明显,核分裂象不易见。MASCSG表达S-100蛋白,且以ETV6-NTRK3融合为特征;罕见分泌性癌有ETV6-RET融合的报道,但RET重排的导管内癌中未见ETV6-RET融合,肿瘤细胞巢和囊周是否有肌上皮的存在有助于鉴别二者[7, 8]。⑥硬化性多囊性腺瘤,镜下肿瘤与正常唾液腺分界清楚,小叶状结构显著,呈囊状、实性、筛状和微乳头状,上皮细胞呈扁平或圆柱状,常有顶浆分泌或囊性导管和浆液性腺泡混合存在,细胞可出现不同程度的异型性,且导管周围也包绕肌上皮细胞,形态极类似唾液腺导管内癌,但硬化性多囊性腺瘤常伴有明显的高嗜酸性颗粒或嗜酸性小球,这一特征性的结构可与唾液腺导管内癌鉴别。此外,分子遗传学上硬化性多囊性腺瘤以PIK3CA通路的基因改变为特征,尤其PTEN突变最常见[9, 10],有助于两者的鉴别诊断。
唾液腺导管内癌临床罕见,彻底手术切除是治疗导管内癌的治疗原则。导管内癌生物学行为大多数表现为惰性,但也有伴有浸润性生长的侵袭性的病例报道。有研究显示,唾液腺导管内癌术后大多数不复发,预后良好[11, 12, 13],这与导管内癌的生物学行为相对惰性有关。Todorovic和Weinreb[14]报道的1例低级别顶浆分泌型导管内癌进展为浸润性腺鳞状细胞癌,并伴区域淋巴结转移,但患者随访91个月仍无病生存。Anderson等[15]报道2例导管内癌,1例部分切除术后复发,1例转化成浸润性癌后复发。目前缺乏导管内癌的大样本量的统计分析,因此对伴浸润和高级别导管内癌的病例需长期密切随访,术后辅以放疗能否延长生存期,以及术后化疗疗效均不确定。本文探讨导管内癌的临床及病理学特征,旨在提高和加深病理医师对导管内癌认识,评估导管内癌生物学行为及预后,指导临床合理治疗。
任萍, 卓士超, 高立永, 等. 原发颊黏膜导管内癌1例[J]. 中华口腔医学杂志, 2024, 59(12): 1258-1261. DOI: 10.3760/cma.j.cn112144-20240307-00101.
所有作者声明不存在利益冲突



























