
探讨与分析急性生理学及慢性健康状况评分系统(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)、序贯器官衰竭估计评分(sequential organ failure assessment,SOFA)、小儿死亡风险评分(pediatric risk of mortality score,PRISM)、小儿危重病例评分(pediatric critical illness score,PCIS)、小儿死亡指数(paediatric index of mortality,PIM)5种常用的评分系统在儿科重症病例中判断病情轻重、评估预后的效果;同时筛选出适用于我院PICU的危重症评分。
选取2013年1月至2014年12月我院PICU全部院内死亡病例42例为死亡组,选取存活(或治愈)患儿444例为存活组,分别予评估入院时APACHE Ⅱ、SOFA、PRISM、PCIS、PIM 5项评分;分析死亡组与存活组各项评分的差异。
死亡组与存活组入院时APACHE Ⅱ、SOFA、PCIS、PRISM、PIM这5种重症评分的差异均有统计学意义(13.43±8.70 vs.3.48±3.94;78.38±9.33 vs.88.24±6.84;0.142 0±0.214 7 vs.0.015 3±0.030 7;5.48±3.42 vs.1.73±1.94;22.02±8.48 vs.12.68±4.88,P均<0.001)。APACHE Ⅱ、SOFA、PCIS、PRISM、PIM这5种重症评分的工作特征曲线下面积(95%CI)分别为0.854(0.798,0.910)、0.838(0.778,0.898)、0.881(0.828,0.934)、0.808(0.748,0.869)、0.936(0.913,0.960),PIM的曲线下面积显著高于其他评分。
5种评分用于评估疾病轻重程度均有效,对评判预后、评估病情严重程度有很好的鉴别能力,尤以PIM更加显著。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童病情变化快,且症状体征常不典型,易漏诊或误诊,病情可能迅速恶化,甚至死亡[1];如能及时判断轻重,早期干预,疾病往往也较快好转。评估疾病严重程度是一项复杂的工作,多种因素与疾病的严重程度密切相关,以分值形式分级评判疾病危重程度,结果更加客观、有效。国际上在应用评分法评估疾病严重程度方面已达成共识[2],目前应用较多的有急性生理学及慢性健康状况评分系统(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)、序贯器官衰竭估计评分(sequential organ failure assessment,SOFA)、小儿死亡风险评分(pediatric risk of mortality score,PRISM)、小儿危重症评分法(pediatric critical illness score,PCIS)、小儿死亡指数(paediatric index of mortality,PIM)等,其中国外儿科领域较多采用PRISM,国内更倾向于PCIS[3]。
本研究把APACHE Ⅱ、SOFA、PCIS、PRISM、PIM等5种目前国内外常用的评分系统应用于我院PICU,以验证各评分系统判断患病儿童病情轻重、评估预后的效果;同时筛选出适用于我院PICU的重症评分系统。
因危重病入住我院PICU的患儿,年龄1个月~14周岁。
入院不足2 h者,无任何检查(包括急诊及院前)、处置(包括急诊及院前)而退院者或者持续进行心肺复苏、生命指征不能稳定>2 h者或2 h内死亡者。
选取2013年1月至2014年12月我院PICU全部院内死亡病例42例为死亡组,采用简单随机抽样法随机选取的存活(或治愈)患儿444例为存活组。486例患儿中,男306例(63.0%);女180例(37.0%)。年龄1~156个月,平均27.4个月。住院时间1~113 d,平均12.3 d。诊断:呼吸系统疾病183例,占37.7%;神经系统疾病104例,占21.4%;消化系统疾病34例,占7.0%;循环系统疾病34例,占7.0%;中毒29例,占6.0%;血液系统疾病12例,占2.5%;外伤9例,占1.9%;泌尿系统疾病6例,占1.2%;心肺复苏术后4例,占0.8%;其他包括营养性疾病、遗传代谢疾病、其他感染性疾病、自身免疫性疾病等71例,占14.5%。
486例患儿分别于入院时进行APACHE Ⅱ、SOFA、PRISM、PCIS、PIM 5项评分,5项评分系统具体包含项目见表1。
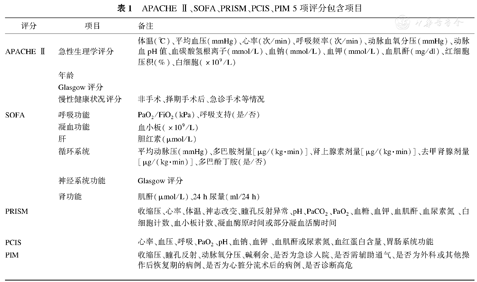
APACHE Ⅱ、SOFA、PRISM、PCIS、PIM 5 项评分包含项目
APACHE Ⅱ、SOFA、PRISM、PCIS、PIM 5 项评分包含项目
| 评分 | 项目 | 备注 |
|---|---|---|
| APACHE Ⅱ | 急性生理学评分 | 体温(℃)、平均血压(mmHg)、心率(次/min)、呼吸频率(次/min)、动脉血氧分压(mmHg)、动脉血pH值、血碳酸氢根离子(mmol/L)、血钠(mmol/L)、血钾(mmol/L)、血肌酐(mg/dl)、红细胞压积(%)、白细胞(×109/L) |
| 年龄 | ||
| Glasgow评分 | ||
| 慢性健康状况评分 | 非手术、择期手术后、急诊手术等情况 | |
| SOFA | 呼吸功能 | PaO2/FiO2(kPa)、呼吸支持(是/否) |
| 凝血功能 | 血小板(×109/L) | |
| 肝 | 胆红素(μmol/L) | |
| 循环系统 | 平均动脉压(mmHg)、多巴胺剂量[μg/(kg·min)]、肾上腺素剂量[μg/(kg·min)]、去甲肾腺剂量[μg/(kg·min)]、多巴酚丁胺(是/否) | |
| 神经系统功能 | Glasgow评分 | |
| 肾功能 | 肌酐(μmol/L)、24 h尿量(ml/24 h) | |
| PRISM | 收缩压、心率、体温、神志改变、瞳孔反射异常、pH、PaCO2、PaO2、血糖、血钾、血肌酐、血尿素氮、白细胞计数、血小板计数、凝血酶原时间或部分凝血活酶时间 | |
| PCIS | 心率、血压、呼吸、PaO2、pH、血钠、血钾、血肌酐或尿素氮、血红蛋白含量、胃肠系统功能 | |
| PIM | 收缩压、瞳孔反射、动脉氧分压、碱剩余、是否为急诊入院、是否需辅助通气、是否为外科或其他操作后恢复期的病例、是否为心脏分流术后的病例、是否诊断高危 |
所有计量数据采用均数±标准差( ±s)表示,数据应用Excel 2000软件及SPSS 19.0统计软件进行统计分析;两组资料均数比较采用t检验; P<0.05为差异有统计学意义。受试者工作特征曲线(receiver operating characteristic curve,ROC)是反映敏感性和特异性连续变量的综合指标,曲线下面积越大,诊断准确性越高,通过各评分系统的ROC曲线下面积(AUC)以衡量各种评分系统对患者预后判别的能力。AUC在0.5~0.7时有较低的准确性,0.7~0.9时有一定准确性,0.9以上时有较高的准确性;各ROC曲线间行Z检验以判断差异是否有统计学意义。
±s)表示,数据应用Excel 2000软件及SPSS 19.0统计软件进行统计分析;两组资料均数比较采用t检验; P<0.05为差异有统计学意义。受试者工作特征曲线(receiver operating characteristic curve,ROC)是反映敏感性和特异性连续变量的综合指标,曲线下面积越大,诊断准确性越高,通过各评分系统的ROC曲线下面积(AUC)以衡量各种评分系统对患者预后判别的能力。AUC在0.5~0.7时有较低的准确性,0.7~0.9时有一定准确性,0.9以上时有较高的准确性;各ROC曲线间行Z检验以判断差异是否有统计学意义。
死亡组及存活组APACHE Ⅱ、SOFA、PRISM、PCIS、PIM 5种评分间的差异均有统计学意义(P<0.001),见表2。
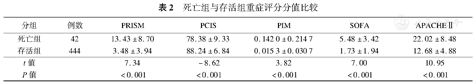
死亡组与存活组重症评分分值比较
死亡组与存活组重症评分分值比较
| 分组 | 例数 | PRISM | PCIS | PIM | SOFA | APACHEⅡ |
|---|---|---|---|---|---|---|
| 死亡组 | 42 | 13.43±8.70 | 78.38±9.33 | 0.142 0±0.214 7 | 5.48±3.42 | 22.02±8.48 |
| 存活组 | 444 | 3.48±3.94 | 88.24±6.84 | 0.015 3±0.030 7 | 1.73±1.94 | 12.68±4.88 |
| t值 | 7.34 | -8.62 | 3.82 | 7.00 | 10.95 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
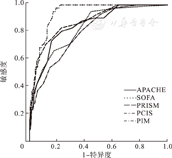
APACHE Ⅱ、SOFA、PRISM、PCIS 、PIM各评分的AUC(95%CI)分别为0.854(0.798,0.910)、0.838(0.778,0.898)、0.881(0.828,0.934)、0.808(0.748,0.869)、0.936(0.913,0.960),经Z检验发现,除PRISM外(Z=1.86,P>0.05),PIM均显著优于其他评分(Z值分别为2.61、2.95、3.85,P值均<0.01),各评分ROC曲线见图1。

为给儿科重症病例提供最佳监护治疗,发达国家从20世纪60年代、我国从20世纪80年代起陆续建立多所PICU,大大促进了PICU技术的广泛开展,危重患儿抢救成功率日益提高。《中国妇幼卫生事业年度发展报告(2011)》指出2010年全国婴儿死亡率为13.1‰,比2000年下降了59.3%,5岁以下儿童死亡率为16.4‰,比2000年下降了58.7%,但我国人口庞大,儿童死亡数目仍然令人痛心,且相对发达国家尚有较大差距,如2010年5岁以下儿童死亡率为16.4‰,仅相当于美国1979年水平。
如仅以轻、中、重度区别病情严重程度,虽简便易行,但显十分粗糙,且不可避免带有主观臆断性质;另外,评估疾病严重程度是一项复杂的工作,年龄、疾病不同发展阶段、治疗及时与否、治疗方法是否得当等多种因素与疾病的严重程度都密切相关,如果能够以分值形式分级评判疾病危重程度,结果必然更加客观、科学、有效,所以国际上在应用评分法评估疾病严重程度方面已达成共识。危重症评分常常依据疾病的一些重要症状、体征和生理参数等进行加权或赋值,从而量化评价危重疾病的严重程度。
APACHE Ⅱ、SOFA、PRISM、PCIS、PIM是几种目前国际、国内常用的评分系统,其中后三项已在儿科广泛应用,而APACHE Ⅱ、SOFA在儿科领域应用有限,但二者对于疾病危重程度均有较明确的效验力和辨析力,是临床研究的重要工具;如果能够引入儿科,可能会有新的突破。PRISM、PIM早已引入中国,且已经验证在我国PICU同样可以有效、客观、全面地评估病情和预后[4,5,6,7,8],但因我国物质资源和人力资源不足等因素未能广泛应用。
自1995年PCIS于我国公布后,引起广泛关注[9];中华医学会急诊分会儿科学组及中华医学会儿科学会急诊学组于1998年组织12所医院共同试用该评分,结果显示PCIS可准确判断病情轻重,分值越低,器官功能衰竭越多,病死率越高,该评分成为我国儿科应用最多的判断病情轻重的工具[10]。但由于儿童群体的特殊性,也不可避免地存在问题,如病情轻重与预后关系并非完全一致,个体差异也不容忽视,PCIS也存在其局限性,如评分分组界线尚存在争议、不适用于单个脏器功能衰竭等;寻找另一种更加客观有效并适应目前我国国情的儿科重症评分系统对临床工作有重要意义。
本研究通过临床分析检验上述5种重症评分系统在我国儿科领域的应用效能并择优而取。研究结果表明,5种评分用于评估患病儿童危重程度均十分有效;APACHE Ⅱ、SOFA在儿科领域应用也有显著效果,甚至优于我国目前较常采用的PCIS。经比较AUC,PIRSM、PIM用于评估危重程度可能较PCIS更加适合我院PICU,尤以PIM为首选。
PIM最早产生于1988至1996年间,来自澳大利亚的7家PICU和英国1家PICU共同参与制定,并在5 695例患者中应用评估并证实其有效性;该评分建立的初衷在于突破PRISM的某些不足之处:如在早期(24 h内)收集所有14项指标的全部信息颇为费力,又如同一病重患儿在不同水平PICU可能会获得不同评分而得到不同的疾病程度评价[11];PIM仅包含8项指标,这些指标需患儿在入住ICU 1 h内进行量化评估,再经过特殊公式处理计算死亡风险,也可以通过互联网提供的评分软件进行直接评分。PIM具有很大优越性:入ICU早期(入院1 h内,但是也有报道显示超过12或24 h采取的数据可能同样有效[12,13,14])收集相关参数,可最大限度避免早期治疗所致误差,且仅仅需要8项指标;PIM评分可通过互联网完成,而且免费使用,较之以往各评分系统大为方便。
该评分可适当校准甚至不需重校就适用于包括意大利、日本等多个国家及地区[15,16,17]。我国香港地区早已有研究验证PIM用于预测儿童死亡风险合理有效[7]。后浙江大学人民医院于2010年收集NICU 243例患儿,分别采用PRISM、PIM和PIM2进行评估分析,结果显示三者在判断病情方面均有较好的评估能力,且研究发现PIM最精确、最适宜[8]。虽然PIM是发达国家在良好医疗模式基础上创建的,但随着我国物质资源和人力资源的不断充足,PICU水平和国外差距逐渐缩小,且PIM具有诸多优越性,应予推广应用。
然而每种评分系统研究均是对群体水平而言的,评分结果反映的是个体患者的严重程度和死亡风险,每种评分总有其局限性。可以采取多种措施弥补:(1)多次连续评分可提高判断病情危重程度的准确性;(2)采取联合评定,应用两种以上评分亦可以增加判断病情危重程度的准确性;(3)结合临床症状体征、治疗效果等方面综合判断,不可尽信评分结果;(4)因地制宜,根据不同医院条件,适当添减辅助评估指标;(5)使用前校准每个评分系统[11]。
当然,为寻求更加合理、客观、有效并适用我国国情的重症评分系统,我们需要在今后工作中更加积极探索、开拓创新,不断取得新进步。



























