
探讨脑萎缩对皮质下缺血性血管病(SIVD)患者认知功能的影响。
选取2013年9月至2014年12月在安徽医科大学第一附属医院神经内科门诊或住院的SIVD患者116例,根据诊断标准分为SIVD无认知损害组(SIVD-NCI)、SIVD轻度认知损害组(SIVD-MCI)和SIVD痴呆组(SIVD-VaD);采用多种神经心理学量表包括简易智能精神状态量表(MMSE)、剑桥老年认知功能评估量表-中文版(CAMCOG-C)等进行评估;使用3.0T头颅MRI扫描,按照视觉等级评分量表分别对额叶、颞叶、顶叶萎缩程度评分(0~3分),同时分别评定额区、顶枕区、颞区、基底节区脑白质疏松(LA)程度及腔隙性脑梗死(LI)数目。比较各组间不同脑叶萎缩程度、LA程度、LI数目,并将认知功能评分与其及血管危险因素进行二元Logistic回归分析。
(1)SIVD-MCI组和SIVD-VaD组萎缩评分、额叶萎缩评分、LA评分及LI数目均显著高于SIVD-NCI组,差异均有统计学意义(H=6.138,P=0.013;H=45.845,P=0.000;H=36.818,P=0.000; H=37.46,P=0.000),SIVD-NCI组和SIVD-MCI组颞叶萎缩评分差异无统计学意义,顶叶萎缩三组间差异无统计学意义;(2)相关分析发现,萎缩评分、LA评分及LI数目与SIVD认知功能呈负相关,其中额叶萎缩评分、顶枕区LA评分及基底节区LI数目与MMSE、CAMCOG-C及其部分子项呈显著负相关(均P<0.05),颞区LI数目与MMSE、CAMCOG-C及其各子项评分均无显著相关(均P>0.05);(3)回归分析发现,控制性别、年龄、受教育年限及血管危险因素等因素后,受教育年限(OR=0.787,P=0.009)、LA评分(OR=1.201,P=0.036)和LI数目(OR=1.221,P=0.011)与认知功能相关,校正萎缩后,LA评分与认知功能间的关系并不显著,萎缩、LI及受教育年限仍与认知功能相关,其中额叶萎缩与认知功能显著相关(OR=16.082,P=0.000),颞叶和顶叶萎缩与认知功能无显著相关。
脑萎缩可能为SIVD患者认知损害新的独立的预测指标,且脑萎缩、LI数目、LA程度在认知损害中的作用可能依次减小。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
我国老龄化改变使脑血管病及认知损害的发病率和患病率明显升高,给患者、家庭和社会带来严重的影响,早期诊断及治疗具有重大的社会意义。血管性认知损害(VCI)由血管因素导致或与之伴随的认知损害,可单独发生或与阿尔茨海默病(AD)伴发[1]。皮质下缺血性血管病(SIVD)是VCI和血管性痴呆(VaD)的重要亚型,因其临床同质性较好,近年来成为研究VCI和VaD甚至卒中最受关注的对象之一[2,3]。对SIVD患者临床表现、影像学改变、生物学标志物等的研究,有助于阐明VCI的发病机制及早期诊断。本研究主要目的是探讨脑萎缩对SIVD认知功能的影响。
收集2013年9月至2014年12月在安徽医科大学第一附属医院神经内科门诊或住院的SIVD患者116例,其中男64例,女52例,平均年龄(68±8)岁,其中无认知功能损害(SIVD-NCI)组39例、轻度认知功能损害(SIVD-MCI)组50例、痴呆(SIVD-VaD)组27例。本研究经安徽医科大学第一附属医院伦理委员会批准(批号:PJ2015-11-06),所有受试者均知情并签署知情同意书。
SIVD纳入标准:参考Erkinjuntti等[4]提出的诊断标准并修订如下:(1)年龄60~85岁;(2)头颅MRI检查示广泛的脑室旁和深部白质高信号;广泛的帽状高信号(沿脑室>10 mm)或不规则带状高信号(宽度>10 mm,边界不规则,向深部白质扩展),和(或)弥漫融合高信号(>25 mm,形状不规则),或广泛的白质改变(弥漫性高信号无局灶性病变)和深部灰质腔隙性脑梗死(LI);或者深部灰质多发性LI数目>5个和至少中度的WMH;(3)6个月内无急性期LI;(4)测试前24 h内未服用影响认知的药物。
SIVD-NCI纳入标准:符合SIVD诊断标准,且认知正常,日常生活能力保存,临床痴呆评定量表(CDR)0分,日常生活能力量表(ADL)<26分。
SIVD-MCI纳入标准:参考Frisoni等[5]提出的SIVD-MCI诊断标准并加以修订:(1)符合SIVD诊断标准;(2)存在认知损害,并经陪护或家属证实;(3)客观检查存在执行、注意等认知损害,记忆损害可较轻微;CDR 0.5分;(4)认知损害程度对患者复杂功能和社会活动影响较小,ADL<26分。
SIVD-VaD纳入标准:参照2002年Román等[3]提出的标准,并符合美国精神障碍诊断与分类统计手册第四版(DSM-Ⅳ)有关血管性痴呆的诊断标准,同时CDR评分为1~2分。
排除标准:(1)脑肿瘤、脑外伤、脑出血史,严重的躯体疾病,精神系统疾病史或电抽搐治疗史;(2)帕金森病、AD、路易小体痴呆等其他导致认知功能损害的老年疾病;(3)非SIVD相关的脑白质病变如多发性硬化,免疫、代谢、中毒、感染及其他因素引起的非血管性脑白质改变;(4)明显的听力、视力障碍等;(5)语言障碍;(6)存在头颅MRI检查禁忌。
收集受试者详细的病史资料,包括性别、年龄、受教育年限、高血压病史、糖尿病史、吸烟史、心脏病史、房颤病史及卒中史等及其他重大疾病史(如肝功能不全、肾功能不全等)。
采用简易智能精神状态量表(MMSE)、剑桥老年认知功能评估量表-中文版(CAMCOG-C)、ADL、CDR等进行综合评估,其中CAMCOG-C包括定向、语言(语言理解和表达)、记忆(近记忆、远记忆和学习记忆)、注意、计算、执行功能、思维、知觉8个方面,总分107分。
采用3.0T GE Signa MRI扫描,采集常规轴位及冠状位T1、T2、T2液体衰减反转恢复序列(FLAIR)像及弥散加权成像(DWI)像。
参考Victoroff等[6]提出的皮质视觉等级量表,在头颅MRI T1像上分别对额叶、颞叶、顶叶萎缩程度进行评分,评分依据为与不同脑叶的三张代表不同萎缩程度的标准图像相比较。评分范围0~3分:0分表示萎缩程度未超过第一张图像,无萎缩;1分表示萎缩程度超过第一张图像但未超过第二张图像,轻度萎缩;2分表示萎缩程度超过第二张图像但未超过第三张图像,中度萎缩;3分表示萎缩程度超过第三张图像,重度萎缩。不同脑叶评分相加求总和即为萎缩总分。脑萎缩视觉评定信度检测:任意选取30例受试者行评估者间和评估者内脑萎缩视觉评定κ一致性检验。评估者间信度检测:额叶κ=0.809、颞叶κ=0.670、顶叶κ=0.830;评估者内部信度检测:额叶κ=0.854、颞叶κ=0.732、顶叶κ=0.772。κ≥0.75时,表示两结果一致性较好;0.40<κ<0.75,表示一致性中等;0<κ≤0.40,一致性较差。
根据Wahlund等[7]提出的年龄相关白质改变评分量表,结合既往研究SIVD患者病变主要位于幕上,将大脑左右半球分别分为额区、顶枕区、颞区、基底核共8个区域,根据患者MRI图像WMH范围的不同,每个区域按0~3分的4级标准分别评分,总分0~24分。按照以上分区方法,结合T1、T2及FLAIR像计数同脑脊液信号一致的圆形或卵圆形直径在3~15 mm内的沿穿通动脉分布的囊腔即为LI数目,而垂直穿通血管分布,直径<3 mm的圆形或卵圆形囊腔则被认为是扩大的血管周围间隙。
采用SPSS 16.0软件进行统计学分析,计量资料服从正态分布以 ±s表示,不服从正态分布以M(QU~QL)表示,方差齐性时采用单因素方差分析检验,方差不齐时采用秩和检验(Kruskal-Wallis法),两两比较采用LSD法;计数资料采用χ2检验;相关分析采用Pearson分析及二元Logistic回归分析。P<0.05为差异有统计学意义。
±s表示,不服从正态分布以M(QU~QL)表示,方差齐性时采用单因素方差分析检验,方差不齐时采用秩和检验(Kruskal-Wallis法),两两比较采用LSD法;计数资料采用χ2检验;相关分析采用Pearson分析及二元Logistic回归分析。P<0.05为差异有统计学意义。
三组受试者的性别构成、年龄、受教育年限差异无统计学意义。在血管危险因素方面方面差异亦无统计学意义。SIVD-MCI组和SIVD-VaD组的MMSE评分及CAMCOG-C评分均显著低于SIVD-NCI组,差异有统计学意义(P<0.05,表1)。
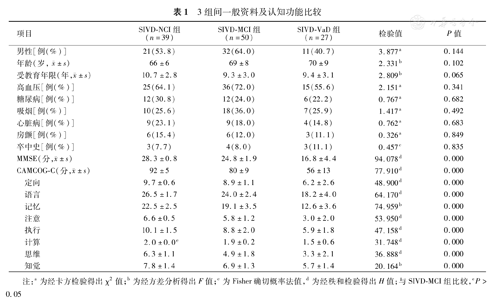
3组间一般资料及认知功能比较
3组间一般资料及认知功能比较
| 项目 | SIVD-NCI组(n=39) | SIVD-MCI组(n=50) | SIVD-VaD组(n=27) | 检验值 | P值 | |
|---|---|---|---|---|---|---|
| 男性[例(%)] | 21(53.8) | 32(64.0) | 11(40.7) | 3.877a | 0.144 | |
年龄(岁, ±s) ±s) | 66±6 | 69±8 | 70±9 | 2.331b | 0.102 | |
受教育年限(年, ±s) ±s) | 10.7±2.8 | 9.3±3.0 | 9.4±3.1 | 2.809b | 0.065 | |
| 高血压[例(%)] | 25(64.1) | 36(72.0) | 15(55.6) | 2.151a | 0.341 | |
| 糖尿病[例(%)] | 12(30.8) | 12(24.0) | 6(22.2) | 0.767a | 0.682 | |
| 吸烟[例(%)] | 10(25.6) | 18(36.0) | 7(25.9) | 1.417a | 0.492 | |
| 心脏病[例(%)] | 9(23.1) | 9(18.0) | 4(14.8) | 0.762a | 0.683 | |
| 房颤[例(%)] | 6(15.4) | 6(12.0) | 3(11.1) | 0.326a | 0.849 | |
| 卒中史[例(%)] | 3(7.7) | 4(8.0) | 3(11.1) | 0.457c | 0.835 | |
MMSE(分, ±s) ±s) | 28.3±0.8 | 24.8±1.9 | 16.8±4.4 | 94.078d | 0.000 | |
CAMCOG-C(分, ±s) ±s) | 92±5 | 80±9 | 56±13 | 77.910d | 0.000 | |
| 定向 | 9.7±0.6 | 8.9±1.1 | 6.2±2.6 | 48.900d | 0.000 | |
| 语言 | 26.5±1.7 | 24.0±2.4 | 18.2±4.0 | 64.170d | 0.000 | |
| 记忆 | 22.5±2.5 | 19.1±3.5 | 12.6±3.6 | 74.959b | 0.000 | |
| 注意 | 6.6±0.5 | 5.8±1.2 | 3.0±2.0 | 53.950d | 0.000 | |
| 执行 | 10.1±1.5 | 8.8±2.0 | 5.9±1.8 | 47.158d | 0.000 | |
| 计算 | 2.0±0.0e | 1.9±0.2 | 1.5±0.6 | 31.748d | 0.000 | |
| 思维 | 6.3±1.1 | 4.9±1.8 | 3.3±2.1 | 36.888d | 0.000 | |
| 知觉 | 7.8±1.4 | 6.9±1.3 | 5.7±1.4 | 20.164b | 0.000 | |
注:a为经卡方检验得出χ2值;b为经方差分析得出F值;c为Fisher确切概率法值,d为经秩和检验得出H值;与SIVD-MCI组比较,eP>0.05
SIVD-MCI组和SIVD-VaD组萎缩评分、额叶萎缩评分、LA评分及四个不同区域LA评分、LI数目及四个不同区域LI计数均高于SIVD-NCI组,差异均有统计学意义,SIVD-NCI组和SIVD-MCI组颞叶萎缩评分差异无统计学意义,SIVD-MCI组和SIVD-VaD组额区LA评分、基底节区LA评分、顶枕区LI数目、颞区LI数目和基底节区LI数目差异无统计学意义,顶叶萎缩评分三组间差异无统计学意义(表2)。
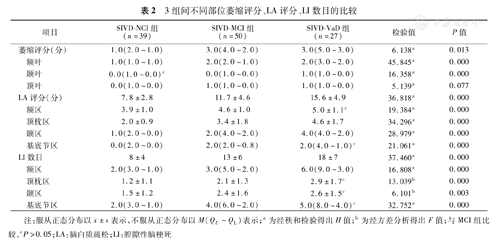
3组间不同部位萎缩评分、LA评分、LI数目的比较
3组间不同部位萎缩评分、LA评分、LI数目的比较
| 项目 | SIVD-NCI组(n=39) | SIVD-MCI组(n=50) | SIVD-VaD组(n=27) | 检验值 | P值 | |
|---|---|---|---|---|---|---|
| 萎缩评分(分) | 1.0(2.0~1.0) | 3.0(4.0~2.0) | 3.0(5.0~3.0) | 6.138a | 0.013 | |
| 额叶 | 1.0(1.0~1.0) | 2.0(2.0~1.0) | 2.0(3.0~2.0) | 45.845a | 0.000 | |
| 颞叶 | 0.0(1.0~0.0)c | 0.0(1.0~0.0) | 1.0(1.0~0.0) | 16.358a | 0.000 | |
| 顶叶 | 0.0(1.0~0.0) | 1.0(1.0~0.0) | 1.0(1.0~0.0) | 5.139a | 0.077 | |
| LA评分(分) | 7.8±2.8 | 11.7±4.6 | 15.6±4.9 | 36.818a | 0.000 | |
| 额区 | 3.9±1.0 | 4.6±1.0 | 5.0±1.1c | 19.384a | 0.000 | |
| 顶枕区 | 2.0±0.9 | 3.4±1.8 | 4.6±1.7 | 34.296a | 0.000 | |
| 颞区 | 1.0(2.0~0.0) | 2.0(4.0~2.0) | 4.0(4.0~2.0) | 28.979a | 0.000 | |
| 基底节区 | 0.0(2.0~0.0) | 2.0(2.0~0.8) | 2.0(4.0~1.0)c | 21.061a | 0.000 | |
| LI数目 | 8±4 | 13±6 | 18±7 | 37.460a | 0.000 | |
| 额区 | 2.0(3.0~1.0) | 3.0(5.0~2.0) | 6.0(9.0~3.0) | 16.808a | 0.000 | |
| 顶枕区 | 1.2±1.1 | 2.1±1.3 | 2.9±1.7c | 13.039b | 0.000 | |
| 颞区 | 1.5±1.2 | 2.4±1.6 | 2.6±1.5c | 6.101b | 0.003 | |
| 基底节区 | 2.0(3.0~1.0) | 4.0(6.0~2.0) | 5.0(8.0~4.0)c | 32.752a | 0.000 | |
注:服从正态分布以 ±s表示,不服从正态分布以M(QU~QL)表示;a为经秩和检验得出H值;b为经方差分析得出F值;与MCI组比较,cP>0.05;LA:脑白质疏松;LI:腔隙性脑梗死
±s表示,不服从正态分布以M(QU~QL)表示;a为经秩和检验得出H值;b为经方差分析得出F值;与MCI组比较,cP>0.05;LA:脑白质疏松;LI:腔隙性脑梗死
萎缩评分、LA评分及LI数目与认知功能呈负相关,其中额叶萎缩评分、顶枕区LA评分及基底节区LI数目与MMSE、CAMCOG-C及其部分子项呈显著负相关(均P<0.05),颞区LI数目与MMSE、CAMCOG-C及其各子项评分均无显著相关(均P>0.05,表3)。
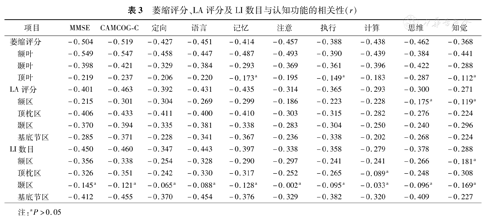
萎缩评分、LA评分及LI数目与认知功能的相关性(r)
萎缩评分、LA评分及LI数目与认知功能的相关性(r)
| 项目 | MMSE | CAMCOG-C | 定向 | 语言 | 记忆 | 注意 | 执行 | 计算 | 思维 | 知觉 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 萎缩评分 | –0.504 | –0.519 | –0.427 | –0.451 | –0.414 | –0.457 | –0.388 | –0.438 | –0.462 | –0.368 | |
| 额叶 | –0.549 | –0.547 | –0.458 | –0.447 | –0.487 | –0.493 | –0.390 | –0.439 | –0.384 | –0.441 | |
| 颞叶 | –0.398 | –0.421 | –0.329 | –0.384 | –0.293 | –0.369 | –0.361 | –0.396 | –0.422 | –0.288 | |
| 顶叶 | –0.219 | –0.237 | –0.206 | –0.220 | –0.173a | –0.195 | –0.149a | –0.183 | –0.287 | –0.112a | |
| LA评分 | –0.401 | –0.463 | –0.392 | –0.431 | –0.435 | –0.314 | –0.365 | –0.293 | –0.300 | –0.271 | |
| 额区 | –0.215 | –0.301 | –0.304 | –0.269 | –0.299 | –0.186 | –0.223 | –0.228 | –0.175a | –0.119a | |
| 顶枕区 | –0.406 | –0.433 | –0.411 | –0.400 | –0.410 | –0.303 | –0.315 | –0.282 | –0.276 | –0.224 | |
| 颞区 | –0.370 | –0.394 | –0.335 | –0.381 | –0.338 | –0.283 | –0.304 | –0.250 | –0.240 | –0.296 | |
| 基底节区 | –0.285 | –0.371 | –0.228 | –0.341 | –0.367 | –0.236 | –0.338 | –0.202 | –0.268 | –0.224 | |
| LI数目 | –0.450 | –0.460 | –0.347 | –0.443 | –0.397 | –0.338 | –0.358 | –0.279 | –0.378 | –0.288 | |
| 额区 | –0.356 | –0.338 | –0.254 | –0.328 | –0.290 | –0.297 | –0.241 | –0.241 | –0.266 | –0.181a | |
| 顶枕区 | –0.326 | –0.351 | –0.242 | –0.330 | –0.317 | –0.252 | –0.265 | –0.089a | –0.248 | –0.308 | |
| 颞区 | –0.145a | –0.121a | –0.065a | –0.088a | –0.128a | –0.002a | –0.095a | –0.033a | –0.096a | –0.169a | |
| 基底节区 | –0.412 | –0.455 | –0.370 | –0.454 | –0.376 | –0.329 | –0.382 | –0.320 | –0.409 | –0.227 | |
注:aP>0.05
根据MMSE评分将有无认知损害作为因变量,将性别、年龄、受教育年限、高血压、糖尿病、吸烟、心脏病、房颤、卒中史、LA评分及LI数目作为自变量进行Logistic逐步回归分析,发现认知损害与受教育年限、LA评分、LI数目显著相关(P<0.05)。在控制变量中添加萎缩总分后发现:LA总分与认知损害间无明显相关,而萎缩总分与认知损害相关;在控制变量中分别添加额叶、颞叶、顶叶萎缩评分后发现:LA评分与认知损害间仍无明显相关,而额叶萎缩与认知损害呈显著相关,颞叶及顶叶萎缩未见明显相关(表4)。
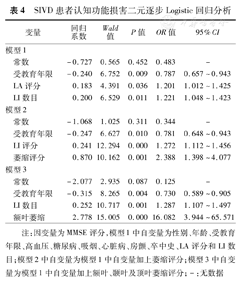
SIVD患者认知功能损害二元逐步Logistic回归分析
SIVD患者认知功能损害二元逐步Logistic回归分析
| 变量 | 回归系数 | Wald值 | P值 | OR值 | 95%CI | |
|---|---|---|---|---|---|---|
| 模型1 | ||||||
| 常数 | –0.727 | 0.565 | 0.452 | 0.483 | – | |
| 受教育年限 | –0.240 | 6.752 | 0.009 | 0.787 | 0.657~0.943 | |
| LA评分 | 0.183 | 4.391 | 0.036 | 1.201 | 1.012~1.425 | |
| LI数目 | 0.200 | 6.529 | 0.011 | 1.221 | 1.048~1.423 | |
| 模型2 | ||||||
| 常数 | –1.068 | 1.025 | 0.311 | 0.344 | – | |
| 受教育年限 | –0.247 | 6.627 | 0.010 | 0.781 | 0.648~0.943 | |
| LI评分 | 0.241 | 12.294 | 0.000 | 1.272 | 1.112~1.456 | |
| 萎缩评分 | 0.870 | 10.162 | 0.001 | 2.388 | 1.398~4.077 | |
| 模型3 | ||||||
| 常数 | –2.077 | 2.935 | 0.087 | 0.125 | – | |
| 受教育年限 | –0.315 | 8.265 | 0.004 | 0.730 | 0.589~0.905 | |
| LI数目 | 0.252 | 10.717 | 0.001 | 1.287 | 1.107~1.497 | |
| 额叶萎缩 | 2.778 | 15.005 | 0.000 | 16.082 | 3.944~65.571 | |
注:因变量为MMSE评分,模型1中自变量为性别、年龄、受教育年限、高血压、糖尿病、吸烟、心脏病、房颤、卒中史、LA评分和LI数目;模型2中自变量为模型1中自变量加上萎缩评分;模型3中自变量为模型1中自变量加上额叶、颞叶及顶叶萎缩评分;–:无数据
SIVD作为VCI和VaD重要亚型,越来越受到重视和关注。SIVD是脑内小血管动脉硬化或灌注不足致皮质下白质和深部灰质的缺血性改变,由于额叶-皮质下环路遭破坏,造成以执行功能下降为主,注意、记忆等多方面认知损害[3]。既往认为皮质下LI和LA为SIVD患者认知损害的预测指标,近年发现脑萎缩同样在SIVD中扮演重要角色[8,9]。
本研究结果显示,SIVD患者额叶萎缩明显,与既往研究[10]结果相符。推测可能在SIVD患者中,额叶较颞叶和顶叶更易受皮质下缺血性改变的影响。SIVD-NCI组和SIVD-MCI组颞叶萎缩评分无显著差异,当认知损害达痴呆,SIVD-VaD组萎缩评分显著高于前2组,提示SIVD颞叶萎缩可能为SIVD已进展为痴呆的一个生物学指标。越来越多的研究显示脑血管病与AD相互影响,海马萎缩可见于AD患者也可见于SIVD患者[11],我们推测SIVD患者特别是SIVD-VaD可能伴有AD。我们的研究结果发现,三组间顶叶萎缩差异无统计学意义,且SIVD患者顶叶萎缩不明显,可能为小血管病变很少累及顶叶,但本研究样本量较小,仅粗略地评估脑萎缩,有待于更加精确的容积测量方法评估顶叶萎缩。
2011年Duering等[12]对215例常染色体显性遗传脑动脉病合并皮质下梗死和白质脑病(CADASIL)患者应用基于体素脑损伤的脑功能定位技术,发现位于丘脑前辐及膝部、内囊前肢、前放射冠、胼胝体膝部的LI与认知功能关系密切,其中以丘脑前辐射与处理速度为突出表现,支持脑小血管病(CSVD)额叶-皮质下环路受损致认知损害学说。我们的研究结果显示,额叶萎缩及基底节区LI与认知功能关系密切,进一步说明额叶及基底节区受损可能会导致认知损害。顶枕区LA与认知损害相关,提示顶枕叶脑室旁白质病变可以影响SIVD认知功能。脑室旁白质,特别是位于帽状区域的白质,拥有一些联系大脑各个部分的纤维束穿过,如上行和下行枕额纤维束、下纵束、扣带回等,这些纤维束增加了脑室旁白质与认知功能及额叶萎缩相关的可能性[13]。不同区域LA与认知功能关系的相关研究较少,未来可考虑利用弥散张量成像(DTI)等进一步揭示SIVD患者顶枕叶LA与认知功能的关系。
回归分析发现,受教育年限为SIVD患者认知损害的保护因素,LA、LI及脑萎缩为危险因素,而国内有研究认为高血压和高同型半胱氨酸血症也为危险因素[14],有待进一步研究证实。在正常老年人群中,教育水平在认知功能中起积极作用[15]。有研究[16]显示脑萎缩是认知损害和痴呆的重要预测指标,2012年欧洲一项多中心合作项目-白质疏松和功能障碍(LADIS)研究汇聚横断面及纵向研究结果,发现脑萎缩可能为导致CSVD认知损害的独立影响因素,且脑萎缩可增强LA及LI对认知功能的影响,该研究还指出脑萎缩可能会掩盖LA对认知功能的影响[8]。Tuladhar等[17]通过对LA、皮质厚度及认知相互关系的研究发现,LA可能通过消弱皮质厚度或破坏皮质神经网络而引发一系列临床表现,并引起认知损害,此结果可解释LA对认知功能的影响被萎缩所掩盖。我们的观察也支持上述观点:在校正一般资料后,LI数目和LA评分与认知损害相关;在控制变量中添加萎缩评分或不同脑叶萎缩后,LI数目仍与认知损害相关且较前密切,萎缩评分或额叶萎缩与认知损害相关,而LA评分与认知无明显相关。我们还发现,脑萎缩在认知损害中的作用最明显,LA作用显然不如LI,此观点与Liem等[18]研究结果相似。但值得注意的是,2011年LADIS研究结果提出不同意见,其从2001年开始对处于65~84岁的639名老人进行长达10年的随访,发现LA在CSVD认知损害中的作用超过LI[19],推测可能因为所采用的研究方法不同或样本量不同。SIVD患者脑萎缩的机制尚不明确,可能与缺血性损害导致包括神经元坏死、轴突及胶质细胞丢失、皮质和皮质下灰质失联系后继发变性等有关[20],但也有研究认为可能为血管因素和神经变性共同导致[21]。
诚然,目前很多学者采用全自动容积分析法(如基于体素的形态学测量)来评估脑萎缩,其不仅可测量灰、白质体积,还可精准测量不同部位体积,但耗时长、需后处理、操作人员需培训,难以广泛应用于临床。本研究选用的视觉等级量表,不需后处理、耗时相对短,更具临床实用性。此外,由于时间有限,样本量不够大,导致部分数据可能存在偏态分布,且本研究仅为横断面研究,研究结果仅提示基线水平的萎缩、LI及LA对认知的影响,其临床价值有待进一步扩大样本量及纵向研究证实。



























