
探讨支气管肺泡灌洗液(BALF)细菌培养及药敏试验在儿童难治性肺炎治疗中的应用价值。
选取2010年8月至2011年12月在天津市儿童医院呼吸科治疗,对常规抗感染治疗超过2周仍无效的难治性肺炎患儿368例进行纤维支气管镜检查,并行支气管肺泡灌洗,BALF做细菌培养和药敏试验。
181例患儿BALF细菌培养阳性,获得分离菌195株。其中革兰阳性菌10株(肺炎链球菌7株,金黄色葡萄球菌3株),占5.1%;革兰阴性菌48株,占24.6%,以铜绿假单胞菌为主(23株,占11.8 %),其次为黏质沙雷菌、嗜麦芽窄食单胞菌(各6株,占3.1%);其中产酶菌2株,分别为金黄色葡萄球菌β内酰胺酶阳性及荧光假单胞菌AmpC酶阳性;白色念珠菌1株,占0.5%;寄生菌136株,占69.7%。革兰阳性菌对红霉素、青霉素、头孢呋辛均有较高的耐药性,对氯霉素、左氧氟沙星、万古霉素较敏感;革兰阴性菌对氨苄西林、头孢唑啉、头孢呋辛、头孢噻肟普遍耐药,对阿米卡星、头孢吡肟、头孢哌酮舒巴坦、美罗培南、亚胺培南、左氧氟沙星、头孢他啶、哌拉西林较敏感。73.2%的患儿存在混合感染,同时混合肺炎支原体感染最多。
经支气管镜取BALF培养致病菌,可获得相对准确的培养结果,药敏结果对临床治疗难治性肺炎有指导意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童肺炎的病原获得非常困难,20%~60%的病例无法做出病原学诊断[1,2],故多为经验性治疗。通过纤维支气管镜(纤支镜)下取支气管肺泡灌洗液(BALF),可使痰标本污染率明显下降,对明确病原有极大帮助。目前国内基层医院儿科尚不能常规进行纤支镜检查,有关BALF细菌培养及药敏结果的资料较少,现报告天津市儿童医院难治性肺炎患儿进行纤支镜下支气管肺泡灌洗并行细菌培养及药敏分析的结果。
收集天津市儿童医院2010年8月至2011年12月呼吸科病房收治的难治性肺炎患儿368例,诊断均符合文献[3]标准。病例入选条件:经常规抗感染治疗2周,症状、体征和胸部影像学表现无明显改善或加重,征得家长或监护人同意,并签署知情同意书者。排除条件:家长不同意进行纤支镜检查,合并呼吸衰竭、心力衰竭等,一般情况差不能进行纤支镜检查者。
所有患儿局部麻醉下行纤支镜检查并行支气管肺泡灌洗,纤支镜先端插入病变部位支气管开口处,以1 mL/(kg·次)的温盐水(37 ℃,9 g/L)灌洗3次,随即通过负压吸引将BALF回收入灭菌痰液收集器中送细菌培养,并进行药敏试验。
学龄儿童清晨嘱其漱口后,咯深部痰送检。不会咯痰者及学龄前儿童无菌操作负压吸取下呼吸道分泌物进行细菌培养,并进行药敏试验。
采用VITEK全自动微生物分析鉴定系统和美国临床和实验室标准协会的判断标准对临床分离菌株做细菌鉴定和药敏试验。
368例难治性肺炎患儿中181例患儿BALF细菌培养195株,阳性率为49.2%(181/368例)。56例患儿致病菌培养阳性,共59株。其中革兰阳性菌10株(肺炎链球菌7株,金黄色葡萄球菌3株),占5.1%;革兰阴性菌48株,占24.6%,以铜绿假单胞菌为主(23株,占11.8%),其次为黏质沙雷菌、嗜麦芽窄食单胞菌(各6株,占3.1%);其中产酶菌2株,分别为金黄色葡萄球菌β内酰胺酶阳性及荧光假单胞菌AmpC酶阳性;白色念珠菌1株(占0.5%)。3例患儿2次纤支镜BALF细菌培养均阳性,均为同一菌株,分别为鲍曼不动杆菌、嗜麦芽窄食单胞菌及铜绿假单胞菌。余均为寄生菌生长136株(草绿色链球菌115株,奈瑟菌21株,其中11例患儿草绿色链球菌及奈瑟菌混合生长),占69.7%。细菌培养阳性菌株分布见表1。
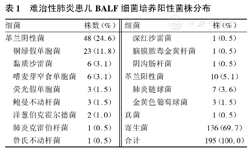
难治性肺炎患儿BALF细菌培养阳性菌株分布
难治性肺炎患儿BALF细菌培养阳性菌株分布
| 细菌 | 株数(%) | 细菌 | 株(%) | ||
|---|---|---|---|---|---|
| 革兰阴性菌 | 48(24.6) | 深红沙雷菌 | 1(0.5) | ||
| 铜绿假单胞菌 | 23(11.8) | 脑膜脓毒金黄杆菌 | 1(0.5) | ||
| 黏质沙雷菌 | 6(3.1) | 阴沟肠杆菌 | 1(0.5) | ||
| 嗜麦芽窄食单胞菌 | 6(3.1) | 革兰阳性菌 | 10(5.1) | ||
| 荧光假单胞菌 | 3(1.5) | 肺炎链球菌 | 7(3.6) | ||
| 鲍曼不动杆菌 | 3(1.5) | 金黄色葡萄球菌 | 3(1.5) | ||
| 洋葱伯克霍尔德菌 | 2(1.0) | 真菌 | 1(0.5) | ||
| 肺炎克雷伯杆菌 | 1(0.5) | 寄生菌 | 136(69.7) | ||
| 鲁氏不动杆菌 | 1(0.5) | 合计 | 195(100.0) | ||
男32例,女24例,男女比例为1.3︰1;年龄6个月~15岁,其中<1岁5例,≤1~3岁16例,<3~6岁19例,<6~15岁16例;行纤支镜检查时病程19 d~4个月(中位天数为23 d)。56例患儿均表现不同程度的咳嗽,其中发热47例,喘息9例,咯血1例;先天性支气管肺发育异常2例,粒细胞减少2例,原发性免疫缺陷病1例,支气管异物1例。影像学检查:肺实变40例,肺不张11例,胸腔积液16例,多发小空洞样病变2例。
56例患儿纤支镜均可见炎性改变、黏液栓塞,其中呼吸道炎性狭窄12例,气管支气管软化2例,呼吸道异物伴肉芽肿1例,气管管腔变形声带关闭不全1例。
56例致病菌培养阳性患儿中,34例细菌培养阳性,获得分离菌株39株,革兰阳性菌6株(肺炎链球菌4株,金黄色葡萄球菌2株),革兰阴性菌9株(铜绿假单胞菌5株,肺炎克雷伯杆菌、鲁氏不动杆菌、鲍曼不动杆菌、阴沟肠杆菌各1株),白色念珠菌1株,寄生菌23株(草绿色链球菌17株,奈瑟菌6株),其中4例草绿色链球菌及奈瑟菌混合生长,1例铜绿假单胞菌及草绿色链球菌混合生长。
二者培养结果一致18例,肺炎链球菌、铜绿假单胞菌各3例,金黄色葡萄球菌2例,肺炎克雷伯杆菌、阴沟肠杆菌各1例,余为寄生菌。
革兰阳性菌对红霉素、青霉素、头孢呋辛、磺胺甲 唑、四环素、克林霉素均有较高的耐药性,对氯霉素、左氧氟沙星、万古霉素较敏感。革兰阴性菌对氨苄西林、头孢唑啉、头孢呋辛、头孢噻肟普遍耐药,对阿米卡星、头孢吡肟、头孢哌酮舒巴坦、庆大霉素、美罗培南、亚胺培南、左氧氟沙星、头孢他啶、哌拉西林较敏感。结果见表2。
唑、四环素、克林霉素均有较高的耐药性,对氯霉素、左氧氟沙星、万古霉素较敏感。革兰阴性菌对氨苄西林、头孢唑啉、头孢呋辛、头孢噻肟普遍耐药,对阿米卡星、头孢吡肟、头孢哌酮舒巴坦、庆大霉素、美罗培南、亚胺培南、左氧氟沙星、头孢他啶、哌拉西林较敏感。结果见表2。
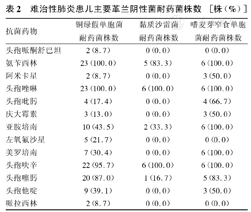
难治性肺炎患儿主要革兰阴性菌耐药菌株数[株(%)]
难治性肺炎患儿主要革兰阴性菌耐药菌株数[株(%)]
| 抗菌药物 | 铜绿假单胞菌耐药菌株数 | 黏质沙雷菌耐药菌株数 | 嗜麦芽窄食单胞菌耐药菌株数 |
|---|---|---|---|
| 头孢哌酮舒巴坦 | 2(8.7) | 0(0.0) | 0(0.0) |
| 氨苄西林 | 23(100.0) | 5(83.3) | 6(100.0) |
| 阿米卡星 | 2(8.7) | 0(0.0) | 3(50.0) |
| 头孢唑啉 | 23(100.0) | 6(100.0) | 6(100.0) |
| 头孢吡肟 | 4(17.4) | 0(0.0) | 4(66.7) |
| 庆大霉素 | 3(13.0) | 0(0.0) | 3(50.0) |
| 亚胺培南 | 10(43.5) | 2(33.3) | 6(100.0) |
| 左氧氟沙星 | 5(21.7) | 0(0.0) | 0(0.0) |
| 美罗培南 | 7(30.4) | 0(0.0) | 6(100.0) |
| 头孢呋辛 | 22(95.7) | 6(100.0) | 6(100.0) |
| 头孢噻肟 | 20(87.0) | 1(16.7) | 5(83.3) |
| 头孢他啶 | 9(39.1) | 0(0.0) | 3(50.0) |
| 哌拉西林 | 2(8.7) | 0(0.0) | 0(0.0) |
56例致病菌培养阳性患儿中合并肺炎支原体(MP)感染最多,达36例(占64.3%);EB病毒12例(占21.4%);柯萨奇病毒6例(占10.7%);微小病毒B19及副流感病毒3各3例(各占5.4%);巨细胞病毒1例(占1.8%)。
368例患儿灌洗1、2次,充分吸引分泌物,取得良好的效果。在药敏试验结果的指导下及时调整用药。患儿出院时呼吸道症状均缓解,复查胸片浸润影明显吸收。
肺炎是5岁以下儿童住院和病死最常见的原因之一。随着医学的发展及广谱抗菌药物的广泛使用,引起肺部感染的常见病原菌的种类及其对药物的敏感性在不断发生变化,因此,临床上迫切需要及时了解本地区细菌种类和药敏结果,为及时有效药物治疗提供依据。儿童肺炎血培养阳性率低,难以获得合格的痰培养标本,下呼吸道咳出的分泌物可被口咽部寄生菌污染,病原学诊断非常困难[4]。经皮肺穿刺活检或开胸肺活检虽是诊断肺炎的金标准,但二者均为创伤性检查,不能作为常规检查手段,故临床使用抗生素多为经验性治疗。多数患儿经正规抗感染治疗后病情好转,但仍有部分患儿疗效不佳,病原菌不明是重要原因之一。纤支镜下BALF直接取材于病变部位,获得细菌的机会增多,且减少口咽部对标本的污染,较痰培养更能准确反映肺部病原学[5],已成为肺炎病原学敏感而可靠的诊断方法[6]。纤支镜检查在成人已普遍应用,但由于儿童呼吸道狭窄,在检查中患儿不能很好配合等因素,儿科尚不能常规开展。天津市儿童医院开展了对肺炎患儿进行纤支镜下BALF取材并细菌培养及药敏分析,以了解细菌感染的特点,为临床合理使用抗生素提供依据。
本组资料统计显示,368例患儿BALF培养阳性菌中,革兰阳性菌10株,革兰阴性菌48株。考虑与以下因素有关:本组患儿病程均较长,行纤支镜检查时病程19 d~4个月(中位天数为23 d)。另外,患儿住院前均在基层医院或门诊诊治,经验性使用抗生素效果不佳收入院,部分患儿甚至已应用三代头孢、碳青霉烯类抗生素和(或)GC,扰乱了体内微生态平衡,促进了条件致病菌的生长繁殖,导致培养阳性率偏低且革兰阴性菌的感染率增高。与文献[7]报道基本一致。
药敏试验结果显示,革兰阳性菌对红霉素、青霉素、头孢呋辛、磺胺甲 唑、四环素、克林霉素均有较高的耐药性,革兰阴性菌对氨苄西林、头孢唑啉、头孢呋辛、头孢噻肟普遍耐药,已超过90%,考虑与儿科近年来大量使用青霉素类及头孢菌素类抗生素有关。铜绿假单胞菌对亚胺培南的耐药率已达43.5%,应引起临床医师关注。喹诺酮类和氨基糖苷类药物虽保持了较高的敏感性,但由于儿童的生理特点限制了其使用。因此,取BALF培养致病菌,可获得相对准确的培养结果,为临床选用有效的抗感染药物提供依据[8]。
唑、四环素、克林霉素均有较高的耐药性,革兰阴性菌对氨苄西林、头孢唑啉、头孢呋辛、头孢噻肟普遍耐药,已超过90%,考虑与儿科近年来大量使用青霉素类及头孢菌素类抗生素有关。铜绿假单胞菌对亚胺培南的耐药率已达43.5%,应引起临床医师关注。喹诺酮类和氨基糖苷类药物虽保持了较高的敏感性,但由于儿童的生理特点限制了其使用。因此,取BALF培养致病菌,可获得相对准确的培养结果,为临床选用有效的抗感染药物提供依据[8]。
本组患儿混合感染发生率高,考虑与病情迁延、疗效欠佳有关,尤其合并MP感染最多,达36例。MP是全球范围的呼吸道高感染率的病原体之一,发病率逐年上升[9,10]。MP内的P1黏附蛋白可与呼吸道纤毛上皮细胞的糖蛋白受体结合,发生纤毛的运动停滞,引起上皮细胞破坏,随后发生浅层黏膜广泛损伤[11,12]。由于MP与宿主细胞膜有相似的抗原成分而逃避宿主的免疫监视,可牢固地吸附于呼吸道黏膜表面,逃避黏液纤毛系统的清除作用,易形成长期寄居状态,从而继发细菌感染。
综上,BALF细菌培养是一种对小儿难治性肺炎非常有效的病因诊断措施[13]。对于经验性治疗病情迁延、疗效欠佳的肺炎患儿,早期行BALF细菌培养对发现病原、指导临床恰当用药有很好的帮助,并有利于减少抗生素滥用及延缓细菌耐药的发生,值得推广。






























