版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
我国冠心病发病呈逐年增加态势,而经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是治疗冠心病的主要措施[1]。目前,PCI的适应证大部分都是基于冠状动脉造影或腔内影像学(血管内超声或光学相干断层成像等)的结果来决定。研究表明,心肌缺血是制定冠心病治疗策略的重要决定因素。但是,冠状动脉造影或腔内影像学技术仅能对病变的解剖学进行评价,不能客观准确地评价病变与心肌缺血之间的关系[2]。近20年来,冠状动脉血流储备分数(fractional flow reserve,FFR)逐渐成为公认的有创病变功能学评价指标,以FFR指导的治疗策略被证实安全、经济,并能改善患者的预后[3]。我国和欧美等国家制定的指南均推荐应用FFR指导冠心病患者的血管重建。但是,FFR的应用在我国尚未普及。为推动FFR检测技术的规范化应用,合理筛选需要血管重建的冠心病患者,中华医学会心血管病学分会介入心脏病学组组织有关专家,在复习该领域相关资料和研究进展的前提下,结合我国的临床实践,反复讨论并达成以下共识。
冠状动脉循环由心外膜冠状动脉和心肌内微循环血管(直径<400 μm)组成。正常状态下,血流经心外膜冠状动脉传导时并不产生明显的阻力,即血管内压力由近至远保持恒定,心肌血流量的调整主要受微循环阻力变化的影响,即心肌血流量与灌注压呈正比,而与心肌内微循环阻力呈反比。临床上采用血管扩张剂诱发心肌微循环最大程度充血,可使心肌微循环阻力小到忽略不计且恒定,此时心肌血流量仅受灌注压的影响,由此认为狭窄使最大充血状态下灌注压的降低程度可反映狭窄使心肌血流量减少的程度。FFR正是基于上述冠状动脉循环的解剖和功能调节原理,定义为心外膜狭窄冠状动脉提供给支配区域心肌的最大血流量与同一支冠状动脉正常时提供给心肌的最大血流量的比值,简化定义为心肌最大充血状态下的狭窄远端冠状动脉内平均压(Pd)与冠状动脉口部主动脉平均压(Pa)的比值[4]。值得注意的是,定义中忽略了微循环阻力和中心静脉压。
FFR具有以下理论优势:(1)FFR是个比值,理论正常值为"1";(2)FFR是心外膜冠状动脉狭窄的特异性指标,其数值降低的程度反映病变本身对心肌血供的影响程度,或病变解除后心肌缺血的改善程度;(3)FFR基本不受心率、血压和心肌收缩力等血液动力学参数变化的影响,测量重复性好;(4)FFR可应用于冠状动脉三支病变患者;(5)FFR具有很好的空间分辨率,可感受微小的压力变化;(6)FFR包括了侧支循环血流量;(7)FFR所用压力导丝类似于标准PCI导丝,允许各种PCI器械操作。
Pa经造影或指引导管,通过液体压力感受器测量。推荐选用4~7 F的造影或指引导管,最好不用带侧孔的导管[5]。
Pd必须应用压力导丝测量,导丝压力感受器须跨过病变远端至少3~5 cm。
FFR概念的基础是假设在微循环血管最大充血状态下,灌注压的变化可反映血流量的变化,因此,使用血管扩张剂确保诱发微循环最大程度充血,对FFR的准确测量至关重要。
目前常用的药物为腺苷和三磷酸腺苷(ATP),两者等效。药物应用禁忌证包括:(1)二度及以上房室传导阻滞,或病态窦房结综合征(人工心脏起搏器植入者除外);(2)血液动力学不稳定;(3)痉挛性支气管哮喘;(4)腺苷或ATP超敏。罂粟碱是经典的微循环血管扩张剂,但因有严重室性心律失常等不良反应,目前已较少使用。其他药物,如硝普钠、多巴酚丁胺、尼可地尔和瑞加德松等也可诱发心肌充血,但尚需积累经验。
给药途径包括静脉输注和冠状动脉内注射。
静脉输注推荐采用中心静脉(肘正中或股静脉),建议用18 G针头经高流速静脉输液泵持续恒速给药。静脉给药几乎可使所有的患者均能获得最大充血状态,允许进行连续压力测量,且安全、不良反应少,是目前公认的FFR测量给药途径的"金标准"。给药过程中患者若不出现血压下降或未出现任何不适,需重新检查静脉输液通道是否畅顺。静脉给药适合所有病变的FFR测量,特别是左主干等开口部、单支串联或弥漫性病变、多支血管病变。
冠状动脉内"弹丸"式注射给药起效快,达峰和持续时间短,故不推荐初学者采用冠状动脉内途径给药。冠状动脉内给药的优点是避免了静脉穿刺,缩短操作时间,主要缺陷是部分患者不能获得最大充血状态,有高估FFR值的可能性,而且无法进行连续压力回撤。目前,临床上多采用逐渐增量的方法,即在右冠状动脉依次使用40、80、120 μg,左冠状动脉依次使用60、120、180、240 μg,单次最大注射剂量可达600 μg/次,每次递增剂量需在压力恢复至基线后进行。当前后两种剂量测得的FFR值一致时,则不需继续增量测量。此外,应根据左右冠状动脉解剖优势调整剂量。若冠状动脉内注射测得的FFR值在缺血界值附近时,建议采用静脉输注加以核实。注射药物前要确保导管在冠状动脉口内,但不要嵌顿冠状动脉。冠状动脉内注射给药适合评价非开口部位的孤立单个病变。
不管是静脉输注还是冠状动脉内注射,测量FFR前均需常规冠状动脉内注射硝酸甘油,以消除冠状动脉痉挛。最大充血状态表现为Pa下降10%~15%,Pd曲线"心室化"并下降,压差增大。常用微循环血管扩张剂的给药方法、剂量、达峰时间、持续时间和常见不良反应见表1。
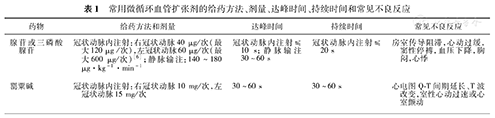
常用微循环血管扩张剂的给药方法、剂量、达峰时间、持续时间和常见不良反应
常用微循环血管扩张剂的给药方法、剂量、达峰时间、持续时间和常见不良反应
| 药物 | 给药方法和剂量 | 达峰时间 | 持续时间 | 常见不良反应 |
|---|---|---|---|---|
| 腺苷或三磷酸腺苷 | 冠状动脉内注射:右冠状动脉40 μg/次(最大120 μg /次),左冠状动脉60 μg/次(最大600 μg/次)[6];静脉输注:140~180 μg·kg-1·min-1 | 冠状动脉内注射≤10 s;静脉输注30~60 s | 冠状动脉内注射≤20 s | 房室传导阻滞,心动过缓,窦性停搏,血压下降,胸闷,心悸 |
| 罂粟碱 | 冠状动脉内注射:右冠状动脉10 mg/次,左冠状动脉15 mg/次 | 30~60 s | 30~60 s | 心电图Q-T间期延长、T波改变,室性心动过速或心室颤动 |
(1)注意体外压力感受器的高度,过高或过低都会影响FFR值。(2)尽量使用7 F以下的指引导管,过大的指引导管会引起冠状动脉嵌顿,FFR值会被高估;不宜使用带侧孔的指引导管。(3)体内压力平衡和最大充血状态压力记录期间,应撤出导引针,关紧Y阀,以免人为降低Pa,假性高估FFR值。(4)测量前用生理盐水冲洗指引导管,冠状动脉内注射硝酸甘油,避免残留对比剂和(或)冠状动脉痉挛,影响FFR值。(5)须在达到最大充血状态才能进行FFR值判断,否则会高估FFR值。(6)充血状态下Pd压力波形呈"心室化"现象,若压力曲线出现短暂的"尖峰脉冲",提示压力感受器可能贴住冠状动脉管壁,容易误认为冠状动脉远段压力增加,此时可稍微回撤或前送压力导丝数毫米。(7)测量结束时回撤压力导丝,使其感受器位于冠状动脉口部,记录的Pa和Pd两条压力曲线应完全弥合,若偏差>3 mmHg(1 mmHg=0.133 kPa),则应重复所有步骤,重新测定FFR。
FFR的理论正常值为"1"。所有FFR<0.75的病变均可诱发心肌缺血,而90%以上的FFR>0.80病变不会诱发心肌缺血。DEFER研究在325例单支冠状动脉病变计划接受PCI而没有心肌缺血证据的患者中证实,对FFR<0.75的病变进行PCI,可明显改善患者的长期预后[7];而FFR≥0.75的病变不能从PCI中获益,由这些病变导致的心原性死亡或心肌梗死年发生率<1%,且并不因行PCI而减少[7]。FAME[8]和FAME Ⅱ[9,10]研究均使用0.80作为判断心肌缺血的界值。FAME研究在1 005例多支冠状动脉病变患者中证实,只对FFR<0.80的病变进行PCI明显降低2年的主要心脏不良事件发生率,包括心原性死亡和心肌梗死发生率。FAME Ⅱ研究[10]在888例单支或多支冠状动脉病变患者中发现,PCI治疗FFR<0.80的病变可显著降低患者2年的急诊血运重建、再发心绞痛和8 d至2年的死亡或心肌梗死发生率;而对332例因病变FFR≥0.80未接受PCI患者的注册随访显示,理想药物治疗2年的联合终点事件(全因死亡、非致命性心肌梗死或急诊血运重建)发生率为9%。基于上述研究结果,目前"0.80"是建议的FFR评估心肌缺血的参考标准,FFR<0.75的病变宜行血运重建,FFR>0.80的病变为药物治疗的指征。FFR 0.75~0.80为"灰区",术者可综合患者的临床情况及血管供血的重要性,决定是否进行血运重建。例如,对临床存在典型心绞痛,病变位于供血范围大(如左主干、左前降支近段、超优势右冠状动脉或左回旋支近端)的冠状动脉,建议以FFR 0.80为界值;而对心绞痛症状不典型,病变血管供血范围小(如非优势的细小右冠、直径<2.5 mm的分支或末端血管)、影像学提示病变稳定但PCI风险高的病变及梗死相关冠状动脉,则建议以FFR 0.75为界值。
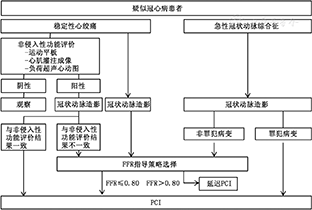
FFR主要应用于稳定性缺血性心脏病患者冠状动脉造影血管临界病变(直径狭窄30%~70%)甚或直径狭窄90%以下的无心肌缺血证据病变的功能学评价,亦可应用于急性冠状动脉综合征非罪犯血管病变、急性ST段抬高型心肌梗死发病6 d后的罪犯血管、非ST段抬高型急性冠状动脉综合征罪犯血管不明确患者的病变功能学评价,指导治疗决策制定。有明确心肌缺血客观证据的病变或治疗策略不依照FFR结果而改变时,不应常规进行FFR测量。
对于单支冠状动脉临界病变或直径狭窄在90%以下的病变,若没有心肌缺血的无创性检查客观证据,或无创性检查结果与病变血管支配区域不一致时,推荐进行FFR评估,决定病变的治疗策略[7,11]。
当多支冠状动脉病变与患者心肌缺血的关系难以从无创性检查中明确时,FFR可帮助判断哪支冠状动脉是诱发心肌缺血的罪犯血管,并可重新定义需要干预的有功能意义的病变血管数目,为血运重建提供决策依据。因此,对于多支冠状动脉病变,应采用FFR评估进行完全功能性血运重建,即对FFR≤0.80的病变行血运重建,而对FFR>0.80的病变采用内科治疗。对于复杂多支冠状动脉病变,推荐测量全部冠状动脉和(或)病变的FFR,以计算功能学SYNTAX计分,积分低危患者行PCI,中危患者可行PCI或冠状动脉旁路移植术,高危患者应建议行冠状动脉旁路移植术[8,9,12]。Nam等[13]的研究表明,FFR功能性SYNTAX计分(只对FFR≤0.80的病变计算SYNTAX计分)可使约30%的通过解剖SYNTAX评分认为不适合PCI的患者有接受PCI的机会。而且,与解剖学SYNTAX评分相比,FFR功能性SYNTAX评分能更加准确地预测治疗相关患者的预后。
左主干病变的严重程度常常被冠状动脉造影低估,建议对左主干临界病变,甚至即使是直径狭窄30%~40%的左主干病变,均应进行FFR测量,FFR>0.80时采用内科治疗是安全的[13,14,15]。对于左主干开口或体部单纯病变,FFR检查是准确的;而当左主干病变合并左前降支和左回旋支病变时,FFR值可能会被轻微高估[12],即当左前降支和左回旋支中某一支血管存在高度狭窄病变时,在另一支血管内测量的FFR值可能假性升高,即低估左主干病变的严重程度。对于左主干病变,FFR评估联合血管内超声检查可能是理想选择,以指导干预策略和获得理想的即刻结果。左主干病变FFR测量的注意事项包括:(1)选用5~7 F不带侧孔的指引导管,避免导管嵌顿或诱发口部痉挛;(2)若为口部病变,进行体内压力平衡和FFR测量期间,应将导管略离开冠状动脉口部;(3)分别测量左前降支和左回旋支的FFR值,并记录连续压力回撤曲线,以明确左主干病变对缺血的贡献;(4)若左前降支和左回旋支中某一支血管存在高度狭窄病变,应在对高度狭窄病变成功PCI后,再行左主干病变的FFR测量。
对于单支串联或弥漫性病变,无创性检查常常难以区分罪犯病变,而FFR对于此类病变具有独特的优势。可以通过测量FFR时记录的连续压力回撤曲线,决定病变血管是否需要血运重建,而且可明确需要处理的靶病变。方法学上,应将压力导丝感受器送过最远端病变,首先确定病变血管的FFR值。如FFR>0.80,提示所有病变均不需要干预,可采用内科治疗;若FFR≤0.80,再通过连续压力回撤技术,评价每个病变与心肌缺血的关系。在连续压力曲线上某个跨病变的压力(Pd)陡峭回升超过10~15 mmHg,说明该病变严重限制血流,需接受PCI。压力回升越大的病变,对血流影响越严重,建议优先处理。如病变的严重程度类似,则先干预远端病变,之后再重复上述过程,直到血管的最终FFR>0.80。值得注意的是,最严重的病变会掩盖其他病变的压力变化,在最严重病变得到处理后,其他病变的压力阶差可能会增加。例如,在解除远端病变前,近端病变的FFR值往往假性增高,因此,不能通过某一节段的FFR绝对数值来判断该病变是否诱发缺血。弥漫性病变的特点是连续压力曲线呈现持续和逐渐的压力回升,而不伴有与某一孤立病变有关的陡峭压力阶差,因此,不宜进行介入治疗。
若根据心电图改变和(或)冠状动脉造影特征不能明确引起缺血的罪犯血管时,FFR有辅助判定罪犯血管的作用;相反,根据心电图改变和(或)冠状动脉造影特征能够明确罪犯血管或病变时,不建议测量靶血管FFR;对非罪犯血管临界病变测量FFR的价值与稳定性缺血性心脏病相同[18,19]。
ST段抬高型心肌梗死急性期(发病<6 d),因血管内血栓、血管的舒缩状态、微血管功能以及心肌的功能状态都极度不稳定,微循环对血管扩张剂的反应也可能随梗死持续或时间的延长而变化,此时,梗死相关血管临界病变的FFR测定结果可能存在很大变异[20],如严重微血管功能不良导致FFR值升高,会大大地低估跨病变压力阶差的变化[21]。因此,不推荐在ST段抬高型心肌梗死急性期使用FFR评价梗死相关血管临界病变和指导决定治疗策略[22]。但是,FFR评价发病≥6 d的梗死相关血管临界病变的价值仍是可靠的。对于ST段抬高型心肌梗死患者的非梗死相关血管临界病变,可考虑进行直接PCI的同时进行FFR测量,以根据病变功能学结果决定后续的治疗策略。
成功支架置入后的冠状动脉血流应该接近正常,即FFR接近理论值"1"。注册研究显示,术后FFR值与6个月预后相关。PCI后FFR值越高,严重不良心脏事件发生率越低,提示FFR是预测支架术后预后的独立因素[22]。因此,建议将FFR>0.90作为评价支架置入术后效果良好的指标。
FFR测量也存在不足之处,并非所有病变都能通过FFR的测量来指导干预策略。对以下情况,FFR的使用及FFR值的解读应慎重:(1)微血管病变。存在微血管病变时,FFR可能被高估。(2)左心室肥厚。血管床的增加与心肌细胞肥大的增加并不成比例,使心肌血管床的正常流量储备降低,用FFR 0.75或0.80的界值可能不适合于判断左心室肥厚时的心肌血供状态,FFR的临界值可能更高。(3)冠状动脉窃血。当其他冠状动脉存在严重狭窄时,存在临界病变的血管可能为其提供侧支循环,因而增加了自身的供血区域,此时测量的FFR值较低,而当解除其他血管的严重狭窄病变后,测得的FFR值会有增加。建议测量提供侧支循环血管病变的FFR时,最好是在解除受供冠状动脉严重病变后进行。(4)冠状动脉痉挛。FFR不能评价这种病理现象。(5)中心静脉压力。中心静脉压力明显升高时,可能影响FFR值。(6)易损斑块在急性冠状动脉综合征的发生、发展过程中起重要作用,但FFR不能评价易损斑块。因此,在上述情况下,不能简单地用FFR<0.80.作为判断心肌缺血的界值,而应该结合临床综合评估。
FFR的临床应用强化了病变功能学评价的重要性,并进而催生了冠状动脉功能性血运重建的冠心病治疗新理念,建议对于疑似冠心病患者参照流程图(图1)[23]进行病变功能学评价。
FFR测量操作简单、安全、快捷,可用于不同病变(单支冠状动脉临界病变、多支冠状动脉病变、分叉病变、串联或弥漫性病变、左主干病变)和支架术后评估,指导临床治疗策略的选择及判断预后[13]。美国(Ⅱa,A)、欧洲心脏病学会(Ⅰ,A)和我国(Ⅱa,A)的指南都推荐应用FFR评价临界病变是否存在功能性缺血,指导血运重建[24,25,26]。2014年欧洲心脏病学会更新的心肌血运重建指南增加了以FFR指导多支冠状动脉病变的PCI(Ⅱa,B)[27]。FFR将成为指导血运重建的常规手段,功能性血运重建是今后冠状动脉介入治疗的趋势,能够推动国内整体冠心病介入治疗水平的提高[28]。
随着对冠状动脉病变功能学评价认识的提高,目前一些基于FFR的其他冠状动脉功能学评价方法[如瞬时无波形比值(intanstaneous wave-free ratio,iFR)、静息Pd/Pa、对比剂FFR及冠状动脉CT血管成像FFR]也在不断涌现。iFR是在不使用血管扩张剂的情况下进行冠状动脉功能学评价,可缩短操作时间,避免药物不良反应,拓宽适用人群[29]。CT血管成像FFR是在冠状动脉CT血管成像基础上无创评价冠状动脉病变功能学,兼有解剖学和功能学双重优势,避免不必要的有创冠状动脉功能学评估,有助于在有创操作之前决定复杂病变的治疗策略。但是,这些新的技术方法仍在经验积累阶段,尚不建议广泛替代FFR。
写作组成员:王建安(浙江大学医学院附属第二医院),郭丽君(北京大学第三医院),张永珍(北京大学第三医院),胡新央(浙江大学医学院附属第二医院),李伟(河北医科大学第二医院)
专家组成员(按姓氏拼音排序):白锋(兰州大学第二医院),陈纪言(广东省人民医院),陈绍良(南京市第一医院),陈玉国(山东大学齐鲁医院),陈韵岱(解放军总医院),丛洪良(天津市胸科医院),杜志民(中山大学第一附属医院),傅向华(河北医科大学第二医院),傅国胜(浙江大学医学院附属邵逸夫医院),高传玉(河南省人民医院),葛均波(复旦大学附属中山医院),葛雷(复旦大学附属中山医院),郭丽君(北京大学第三医院),韩雅玲(沈阳军区总医院),霍勇(北京大学第一医院),贾国良(东莞康华医院),贾绍斌(宁夏医科大学总医院),蒋学俊(武汉大学人民医院),荆全民(沈阳军区总医院),李保(山西省心血管病医院),李国庆(新疆维吾尔自治区人民医院),李浪(广西医科大学第一附属医院),李拥军(河北医科大学第二医院),梁春(第二军医大学长征医院),刘斌(吉林大学第二医院),刘俊明(新疆生产建设兵团总医院),刘启明(中南大学湘雅二医院),刘喜(内蒙古自治区医院),吕树铮(首都医科大学附属北京安贞医院),马根山(东南大学附属中大医院),马礼坤(安徽省立医院),彭建军(首都医科大学附属北京世纪坛医院),乔树宾(中国医学科学院 北京协和医学院 阜外医院),邱春光(郑州大学第一附属医院),沈珠军(中国医学科学院 北京协和医学院 北京协和医院),宋耀明(第三军医大学新桥医院),孙福成(北京医院),孙勇(浙江大学医学院附属第二医院),王海昌(第四军医大学西京医院),王建安(浙江大学医学院附属第二医院),王乐丰(首都医科大学附属北京朝阳医院),王伟民(北京大学人民医院),温尚煜(大庆油田总医院),吴永健(中国医学科学院 北京协和医学院 阜外医院),杨清(首都医科大学附属北京安贞医院),杨天和(贵州省人民医院),余再新(中南大学湘雅医院),袁祖贻(西安交通大学医学院第一附属医院),张澄(山东大学齐鲁医院),张立(四川大学华西医院),张奇(上海交通大学医学院附属瑞金医院),张钲(兰州大学第一医院),赵学忠(吉林大学第一医院),周玉杰(首都医科大学附属北京安贞医院)
无