
探讨利用3D打印心脏模型帮助超声引导多发房间隔缺损(ASD)封堵治疗的可行性。
2016年4至8月,中国医学科学院阜外医院21例多发ASD患者经采集CT和三维超声图像,通过3D打印技术制作心脏疾病模型。利用模型进行模拟封堵测试,确定最佳封堵方案。在经胸超声心动图引导下行ASD经皮封堵术,并于术后1个月随访复查心电图和超声心动图。
共21例患者,男8例,女13例,均成功实施封堵治疗,其中5例患者存在少量残余分流,该5例患者中3例术后1个月残余分流消失,住院及随访期间无死亡、血管损伤、心律失常、封堵器脱落、血栓形成、瓣膜功能障碍等并发症。
应用3D打印心脏模型进行模拟测试有助于制定多发ASD封堵方案,经超声引导的经皮介入技术可以实现预定方案,且短期随访结果良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
房间隔缺损(ASD)是常见的先天性心脏病之一,其中继发孔型ASD约占80%。自20世纪70年代King等[1,2]首先报道经导管封堵ASD以来,随着导管介入技术的日益成熟,放射线下经皮封堵治疗ASD取得了满意的疗效[3]。但是多发ASD一直是介入封堵治疗的难题[4,5],存在选定封堵器置入位置困难、残余分流率高等问题。为了解决这一难题,本研究应用3D打印模型在体外测试不同封堵器在各缺损置入后的封堵效果,制定最佳治疗方案,并采用经胸超声心动图引导经皮介入技术[6]实现预定方案。
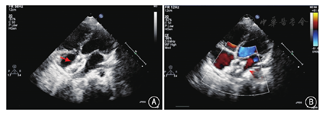
2016年4至8月在中国医学科学院阜外医院心脏外科门诊接受经胸超声心动图检查,满足以下条件的ASD患者入选本研究:(1)缺损数量>2个;(2)累计缺损直径≥5 mm;(3)年龄≥2岁。排除标准:(1)原发孔型ASD及静脉窦型ASD;(2)心内膜炎及出血性疾患;(3)封堵器安置处有血栓存在,导管插入处有静脉血栓形成;(4)严重肺动脉高压导致右向左分流;(5)左室射血分数<50%;(6)合并需外科处理的其他心脏畸形。封堵成功标准:封堵器稳定、形态正常、未压迫重要组织,无恶性心律失常,残余分流≤4 mm。所有患者入院后由同一名超声科医师重新进行超声检查,明确缺损数量、大小及缺损间距离(图1)。2016年4至8月,经超声检查初筛排除不适宜行封堵治疗的病例后,共入选21例患者,其中男8例,女13例,年龄3~48(20.33±16.64)岁,体重14~68(39.64±19.71)kg。本研究通过中国注册临床试验伦理审查委员会审批(ChiECRCT-2013036),所有患者均签署知情同意书。
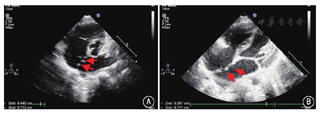

以三维超声心动图及心脏CT检查采集更详细的影像学资料(图2),运用计算机软件(Mimics Innovation Suite 19,比利时Materialise公司)合成图像并进行三维重建,选用软质硅胶材料,利用3D打印机制作心脏模型。
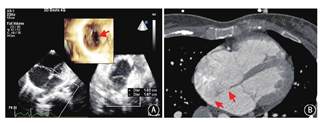

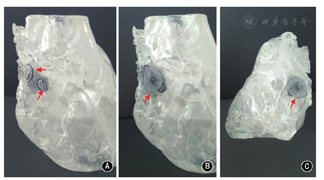
选用不同型号的ASD或卵圆孔未闭(PFO)封堵器(由厂商提供,专供示教演示使用)在各缺损处进行封堵测试,观察封堵器置入后的形态、各缺损的覆盖情况以及与二尖瓣环的距离(图3),最后选定一枚置入后形态良好、尽可能覆盖全部缺损同时不压迫二尖瓣的封堵器,记录封堵的型号和置入位置。

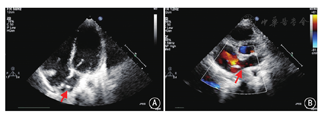
成年患者在局部麻醉下接受治疗,不能配合的患儿在镇静状态下(自主呼吸)下接受治疗,封堵治疗全程在经胸超声引导下进行,手术开始前再次通过不同超声切面及三维图像,确定目标封堵孔的位置。术前予静脉注射肝素80 U/kg抗凝。消毒、铺单后,经股静脉穿刺送入导管和导丝至右心房。在超声监视下,后撤导丝,调整导管方向和位置,将导管经预先选定的ASD送入左心房(图4)。经导管推送导丝进入左心房,退出导管。沿导丝将输送鞘管送入左心房,退出导丝。在超声监视下,经输送鞘推送根据3D打印模型选定的封堵器进行封堵(图5)。封堵器置入后,超声评估封堵器位置和形态、封堵效果,确认封堵器对二尖瓣、肺静脉及冠状静脉窦等周围结构无影响后,释放封堵器,退出输送鞘管,穿刺点压迫止血,绷带加压包扎。如果封堵后残余分流>5 mm,在增加封堵器尺寸或个数后仍不能成功封堵缺损,则患者改常规外科手术。


术后当日安置心电监护,静脉给予抗生素2 d预防感染,术后24 h内低分子肝素皮下注射抗凝,每日口服阿司匹林3 mg/kg,共半年。术后第1、3个月门诊随访,行体格检查及心电图、超声心动图复查。
21例患者均以1枚封堵器成功进行了封堵治疗,5例患者存在≤4 mm的残余分流,其中3例术后1个月复查超声心动图显示残余分流消失(表1)。为达到更好的封堵器形态和满意的封堵效果,21例患者中17例使用ASD封堵器,4例使用PFO封堵器。
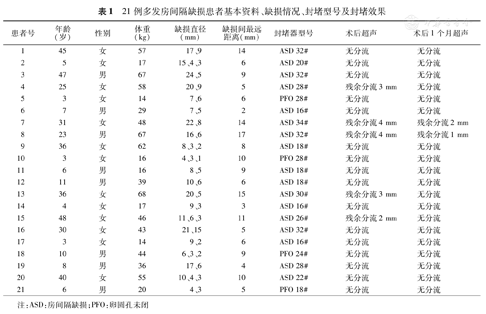
21例多发房间隔缺损患者基本资料、缺损情况、封堵型号及封堵效果
21例多发房间隔缺损患者基本资料、缺损情况、封堵型号及封堵效果
| 患者号 | 年龄(岁) | 性别 | 体重(kg) | 缺损直径(mm) | 缺损间最远距离(mm) | 封堵器型号 | 术后超声 | 术后1个月超声 |
|---|---|---|---|---|---|---|---|---|
| 1 | 45 | 女 | 57 | 17、9 | 14 | ASD 32# | 无分流 | 无分流 |
| 2 | 5 | 女 | 17 | 15、4、3 | 6 | ASD 20# | 无分流 | 无分流 |
| 3 | 47 | 男 | 67 | 24、5 | 9 | ASD 32# | 无分流 | 无分流 |
| 4 | 25 | 女 | 58 | 20、9 | 5 | ASD 28# | 残余分流3 mm | 无分流 |
| 5 | 3 | 女 | 14 | 7、6 | 6 | PFO 28# | 无分流 | 无分流 |
| 6 | 7 | 男 | 29 | 7、5 | 2 | ASD 16# | 无分流 | 无分流 |
| 7 | 31 | 女 | 48 | 22、8 | 14 | ASD 34# | 残余分流4 mm | 残余分流2 mm |
| 8 | 23 | 男 | 67 | 16、6 | 17 | ASD 32# | 残余分流4 mm | 残余分流1 mm |
| 9 | 36 | 女 | 62 | 8、3、2 | 8 | ASD 18# | 无分流 | 无分流 |
| 10 | 3 | 女 | 16 | 4、3、1 | 10 | PFO 28# | 无分流 | 无分流 |
| 11 | 6 | 男 | 16 | 8、5 | 9 | ASD 18# | 无分流 | 无分流 |
| 12 | 11 | 男 | 39 | 10、6 | 6 | ASD 18# | 无分流 | 无分流 |
| 13 | 36 | 女 | 68 | 20、5 | 15 | ASD 30# | 残余分流3 mm | 无分流 |
| 14 | 4 | 女 | 17 | 9、3 | 3 | ASD 16# | 无分流 | 无分流 |
| 15 | 48 | 女 | 46 | 11、6、3 | 11 | ASD 26# | 残余分流2 mm | 无分流 |
| 16 | 30 | 女 | 43 | 21、15 | 5 | ASD 32# | 无分流 | 无分流 |
| 17 | 3 | 女 | 14 | 9、2 | 6 | ASD 16# | 无分流 | 无分流 |
| 18 | 10 | 男 | 44 | 6、3、2 | 9 | PFO 24# | 无分流 | 无分流 |
| 19 | 8 | 男 | 36 | 17、6 | 4 | ASD 28# | 无分流 | 无分流 |
| 20 | 40 | 女 | 55 | 10、4、3 | 10 | ASD 22# | 无分流 | 无分流 |
| 21 | 6 | 男 | 20 | 4、3 | 5 | PFO 18# | 无分流 | 无分流 |
注:ASD:房间隔缺损;PFO:卵圆孔未闭
术后住院及随访期间无死亡、外周血管损伤、心脏穿孔、心包积液、心律失常、封堵器脱落、血栓形成、瓣膜功能障碍等并发症(见表1)。
多发ASD由于缺损数量、大小、相互间位置关系存在很大的差异性,一直是介入封堵治疗的难题。由于无法准确预估封堵器的置入位置和封堵效果,使用1枚封堵器可能无法覆盖全部缺损而出现残余分流,使用多枚封堵器不但费用高,而且封堵器之间的相互影响亦会带来稳定性欠佳、内皮化困难等问题。近年来3D打印技术迅速发展,在临床上展示出特有的优越性[7]。3D打印制作的心脏疾病模型能清晰显示病变结构及其与周围组织的关系,为体外模拟封堵治疗提供了可能性。本研究通过在3D打印的心脏模型上进行试封堵,评估不同类型、不同尺寸的封堵器封堵不同缺损的效果,在封堵器不压迫二尖瓣的情况下,尽可能减少残余分流,从而制定出最佳封堵方案。然而仅靠3D打印技术制定最佳治疗方案尚不能让患者获益,因为传统放射线引导的介入治疗无法引导导丝导管准确进入最佳缺损孔进行封堵,如果在错误的缺损孔中尝试释放封堵器,可能会撕裂房间隔,造成缺损扩大。为了解决这一困难,本研究采用超声心动图引导进行经皮介入治疗,在超声引导下,通过结构及多普勒图像可以准确找到目标封堵孔,并引导导管将最佳封堵器置入目标封堵孔中,而且在术中避免使用放射线,有效保护医护人员。
虽然3D重建技术及打印材料都取得了长足的进步,但是打印出来的毕竟不是真实的心脏,为了获得良好的3D模型进行模拟封堵,本研究采用CT和超声心动图影像叠加技术建模并采用与组织相近的硅胶进行打印。本研究优秀的封堵效果表明,在现有技术条件下获得的3D模型能够有效地为多发ASD患者制定最佳治疗方案。
残余分流是封堵多发ASD最大的问题,由于ASD干预指征为缺损直径>5 mm,所以在本研究中我们接受残余分流≤4 mm,共有5例患者术后即刻残余分流≤4 mm,术后1个月复查超声发现残余分流量均减少,其中3例患者残余分流完全消失,这与封堵器的内皮化进程有关,亦与文献报道[8,9]一致。在制定封堵方案时,为了最大限度的减少残余分流,我们为部分患者放弃了传统封堵大孔的方法,而采用PFO封堵器封堵小孔。因为目前使用的ASD封堵器伞盘比腰部仅大4~6 mm,覆盖周围缺损的能力有限。如果缺损孔相距较远,将被迫使用大尺寸封堵器以获得更广的覆盖范围,就会造成封堵器腰部不能充分伸展,导致两侧伞盘无法贴合,这样形态不好的封堵器不但影响了封堵效果,也增加了脱落风险,甚至可能撕裂房间隔。因此,本组中4例患者采用较大尺寸的PFO封堵器封堵小的缺损孔,利用伞盘覆盖其他缺损孔,取得了满意的封堵效果。
3D打印技术可以准确地制作多发ASD模型,并通过试封堵制定最佳封堵方案,超声引导经皮介入技术能准确地实现该方案,3D打印技术与超声引导经皮介入技术的联合应用为多发ASD提供了可靠的治疗效果,也为结构性心脏病的个体化介入治疗提供了新的思路。



























