
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者,男,53岁,因"颜面、双下肢水肿8个月余"入院。患者8个月前无明显诱因出现颜面部、双下肢水肿,否认光过敏、皮疹、关节痛、脱发及雷诺现象。外院查尿常规提示尿蛋白(3+),尿潜血(1+),异型红细胞占60%;24 h尿蛋白3.76 g;Scr 61.5 μmol/L,BUN 4.67 mmol/L,Alb 40.5 g/L,TG 5.26 mmol/L,TC 6.85 mmol/L;IgG 6.44 g/L↓,IgA、IgM、C3、C4均正常;ANA、ANCA、抗dsDNA均阴性;空腹血糖5.4 mmol/L,餐后2 h血糖9.11 mmol/L。全身PET-CT、泌尿系超声未见异常。当地肾脏穿刺活检诊断为"重度系膜增生性肾小球病变" 。予雷公藤多苷10 mg每日3次治疗3个月及中药治疗(具体不详),水肿有消退,复查尿蛋白(±)。停药后尿中泡沫再次增多,无明显水肿,尿蛋白(3+)。为进一步诊治收入本院。既往有高血压病10余年,最高至180/110 mmHg,目前口服非洛地平片5 mg qd,血压维持在120~150/70~90 mmHg;脂肪肝、高脂血症10余年(曾服用阿托伐他汀钙片,血脂控制情况不详);肠息肉7年,电切后定期复查肠镜均未见异常;诊断慢性淋巴细胞性甲状腺炎4个月。个人有吸烟史40余年,平均20支/d;饮酒史30余年,平均150 g/d。家族有冠心病、高血压病史。入院查体:BP 146/78 mmHg,P 81次/min,BMI 24.91 kg/m2,eGFR-EPI 108.02 ml·min-1·(1.73 m2)-1,心肺腹(-),双下肢无水肿。完善相关检查:血WBC 7.23×109/L,Hb 147 g/L,PLT 311×109/L;Scr 74 μmol/L,BUN 4.91 mmol/L,Alb 35 g/L,TC 6.00 mmol/L,TG 3.21 mmol/L;尿蛋白0.3 g/L,RBC 37.3/μl,异形红细胞90%;24 h尿蛋白4.04 g;血沉26 mm/h;血清蛋白电泳正常;IgG 6.36 g/L↓,IgA、IgM、C3、C4正常;ANCA、ANA、抗dsDNA(-);M蛋白相关检查:血κ轻链731 mg/dl,λ轻链302 mg/dl,κ/λ 2.42;血游离κ轻链13.9 mg/dl,λ轻链10.4 mg/dl,κ/λ 1.34;尿轻链(-);血、尿免疫固定电泳(-);血冷球蛋白(-);2 h口服葡萄糖耐量试验(OGTT):Glu (0 h)5.0 mmol/L,Glu(2 h)10.8 mmol/L,提示糖耐量减低;监测指血:空腹血糖5.8 mmol/L,餐后2 h血糖7.0~7.4 mmol/L。甲功:抗甲状腺过氧化物酶抗体(A-TPO)438.20 IU/ml↑,FT3、FT4、TSH(-);HBsAg(-)。泌尿系超声:左肾长径12.6 cm,右肾长径11.8 cm,未见异常。肝胆胰脾超声:轻度脂肪肝、肝囊肿。肾动脉、肾静脉、下肢深静脉超声(-)。眼科检查:双视网膜血管走行正常,A∶V为1∶2。
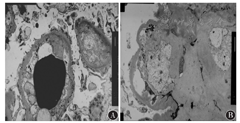
本科阅读外院肾脏穿刺病理切片结果示:光镜下可见27个肾小球,其中2个小球全球硬化,余小球呈弥漫性重度系膜增生,系膜基质明显增多呈结节状,毛细血管腔受压明显狭窄,脏层及壁层上皮肿胀。肾小管上皮颗粒变性,灶状萎缩,肾间质灶状淋巴、单核细胞浸润伴纤维化。部分小叶间动脉、入球小动脉及出球小动脉见玻璃样变。PAS(+),PASM(+),Masson(+),刚果红染色(-)。见图1。免疫荧光为IgG(2+),沿毛细血管壁线状沉积;C3(+)。见图2。电镜见肾小球系膜细胞和基质明显增生,基底膜轻度增厚,系膜区及基底膜内未见异常电子致密物沉积,上皮足突大部分融合,肾小管上皮溶酶体增多。见图3。
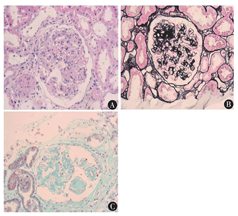

注:A:PAS染色;B:PASM染色;C:Masson染色
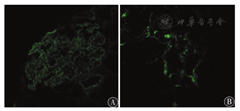

注:A:IgG(2+);B:C3(+)

诊断为特发性结节性肾小球硬化症(idiopathic nodular glomerulosclerosis,ING)、高血压病、高脂血症、糖耐量减低,嘱患者戒烟,少食多餐,适当增加运动量,并给予口服非洛地平5 mg qd、奥美沙坦20 mg qd、辛伐他汀20 mg qn治疗。出院后监测血压维持在120~130/70~80 mmHg,3个月后门诊随诊:血Hb 145 g/L,Scr 89 μmol/L,BUN 6.15 mmol/L,Alb 40 g/L,TC 4.99 mmol/L,TG 3.77 mmol/L;24 h尿蛋白0.82 g。
结节样肾小球硬化的肾脏穿刺病理结果主要表现为弥漫性结节状系膜硬化、基底膜增厚、动脉硬化,部分还可有糖尿病肾病的特点,如鲍曼囊透明变性、肾小球微动脉瘤、肾小管基底膜增厚及小动脉玻璃样变等,最初由Kimmelstiel等[1]用以描述糖尿病肾病的病理特征。常见病因有糖尿病肾小球硬化、单克隆免疫蛋白沉积病、淀粉样变性、II型膜增生性肾小球肾炎、冷球蛋白血症、Ⅲ型胶原肾小球病、免疫触须样肾小球病、大动脉炎等,认真除外以上病因后方可考虑诊断为ING,其发病机制目前尚未明确[2]。在多数病例中,免疫荧光及电镜特点有助于不同病因的鉴别诊断,具体见表1[3,4,5]。
| 疾病 | 光镜 | 免疫荧光 | 电镜 |
|---|---|---|---|
| 糖尿病肾小球硬化 | 肾小球及肾小管基底膜增厚,系膜扩张, Kimmelstiel-Wilson 结节 | 可见肾小球和肾小管基底膜轻至中度线性沉积 | 系膜区基质、细胞增多,体积增大,GBM增厚,血细胞减少 |
| 膜增生性肾小球肾炎 | 系膜细胞增多,插入GBM和内皮细胞间形成双轨征,GBM弥漫性增厚 | 弥漫性颗粒状GBM增厚,单克隆或多克隆 IgG 、C3沉积于系膜区 | 内皮下、基底膜、系膜区和上皮可见电子致密物沉积 |
| 淀粉样变性 | 刚果红染色(+),系膜内嗜酸性物质增多,GBM增厚,肾小管萎缩 | 非特异的免疫球蛋白和补体C3、C1q沉积于系膜区及毛细血管袢,κ、λ轻链沉积 | 系膜区见到小片状、毛细血管基膜上皮下小团状杂乱分布的细纤维结构,纤维无分支,直径8~10 nm |
| 纤维性肾小球肾炎 | 刚果红染色阴性的纤维样物质增多,毛细血管袢开放欠佳,囊周纤维化 | IgG 、C3沉积于系膜区和(或)血管袢,表现为点状、类线样、假线样或飘带样 | 肾小球系膜区增宽,见无分枝、无序排列的纤维丝,直径10~30 nm,混有颗粒状或块状电子致密物 |
| 免疫触须样肾小球肾炎 | 刚果红染色阴性的淀粉样物质沉积在系膜区或GBM,肾小球处可见"双轨化""钉突" | IgG 、 IgM 、C3沿系膜区毛细血管袢呈颗粒状或块状沉积 | 病变肾小球系膜区或GBM内直径30~50 nm排列规则的中空微管状结构沉积 |
| 慢性缺血性状态(如大动脉炎) | 小叶中心系膜增厚,透明样物质沉积于肾小球、出入球动脉(呈马赛克样),微动脉瘤生成 | IgG 、 IgM 、C3沉积于膜内及系膜区 | 膜内及系膜区有电子致密物质沉积 |
| 特发性结节性肾小球硬化 | GBM增厚,动脉玻璃样变 | IgG 、白蛋白线样沉积于GBM和管腔膜 | 系膜基质显著增多,无电子致密物质沉积 |
注:GBM:肾小球基底膜
"特发性结节性肾小球硬化症"这一概念是由Herzenberg等[6]首次提出,其在1999报道的27例结节性肾小球硬化病例中发现16例患者无明显病因,由此发现ING,并指出此病可能与高血压、肥胖相关。随后Markowits等[7]复习了23例ING病例,发现患者平均发病年龄为68.2岁,男性占78.3%,95.7%患者有长期高血压病史,91.3%有严重吸烟史,90%有高脂血症,82.6%出现肾功能受损,69.6%出现大量蛋白尿,21.7%表现为肾病综合征。2014年上海第二军医大学的Wu等[8]总结了来自上海肾脏组织病理学中心的20例ING患者的临床病理特点,亦发现患者以男性为主,95%患者为超重,90%有长期高血压病史,85%有吸烟史。进一步提示此病与吸烟、肥胖、高脂血症、高血压有着密切关系,相应的致病机制可能如下[8,9,10,11]:(1)吸烟可刺激肾素合成,进一步激活肾素-血管紧张素-醛固酮系统,引起组织纤维化、硬化,并导致蛋白尿出现;尼古丁的吸入还可通过活化生长因子、缺氧诱导因子、内皮素1等引起内皮细胞增殖、血管生成。(2)肥胖与入球小动脉扩张有关,可引起小球间压力增加,导致肾小球肥大、超滤损伤、肾小球硬化等,肾小球肥大还会增加足细胞的需求,导致足细胞过度生长、功能不足,进一步加重硬化过程。肥胖患者血中瘦素、脂联素、血管紧张素Ⅱ、肿瘤坏死因子α等细胞因子水平变化亦可能与ING发病相关。(3)高血压小鼠血管平滑肌细胞可产生糖基化终末产物(AGEs),与高灌注损伤、慢性缺氧、氧化应激增加等因素共同作用,导致结节性肾小球硬化的发生。由此看来,ING的发病与高血压、吸烟、高脂血症、肥胖等因素密切相关,但具体机制尚未明确。目前国内外有关此病的报道较少,治疗方案有限,国外文献提出戒烟、尽早使用血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂(ACEI/ARB)类药物以及控制血压、血脂,可延缓患者病情进展[10]。患者预后情况可能与其病理严重程度、年龄等因素相关。Wu等[8]报道的20例患者中有6例患者行肾脏穿刺活检时已达到终末期肾病,随后逐渐发展至透析治疗阶段,这些患者肾间质纤维化及肾小管萎缩程度较其他患者严重,而非终末期肾病的9例患者在随诊期间血肌酐水平维持稳定或好转(所有患者均给予氨氯地平降压,半数患者予降脂治疗)。
结合本患者的肾穿刺活检病理结果,光镜下见肾小球系膜弥漫性增生,系膜基质增多呈结节状,部分动脉见玻璃样变;免疫荧光示IgG(2+),并沿毛细血管壁线状沉积;电镜下见系膜细胞及基质增多,未见电子致密物沉积。由此明确为结节样肾小球硬化。在病因鉴别方面,本患者有长期高血压病、吸烟史、高脂血症病史,实验室检查虽有糖耐量减低,但监测日常空腹及餐后2 h血糖水平尚可,仅在高糖负荷后出现轻度血糖升高,病情程度尚未达到引起糖尿病肾病的可能,同时血尿免疫电泳、血尿轻链、冷球蛋白及刚果红染色阴性等结果亦可排除了单克隆蛋白沉积病、淀粉样变、II型膜增生性肾小球肾炎、冷球蛋白血症,因此诊断为ING。给予患者ACEI/ARB类药物及降压、降脂治疗,同时嘱患者戒烟、控制饮食、加强运动。随诊过程中,患者一般情况尚可,无明显水肿及肾功能受损表现,血压、血脂降低,尿蛋白减少,病情稳定,不过仍需在治疗和随访过程中密切观察,继续调整生活方式。



























