
研究成人原发免疫性血小板减少症(ITP)患者疲劳症状,分析疲劳严重程度的影响因素。
采用中文版慢性病治疗功能评估疲乏量表(FACIT疲劳量表)、匹兹堡睡眠质量指数(PSQI)、医院焦虑抑郁量表(HADS)及一般情况调查表对就诊于中国医学科学院血液病医院的成人ITP患者进行调查研究,运用多元线性回归分析方法筛选影响疲劳严重程度的相关因素。
共纳入207例ITP患者,中位年龄42(18~72)岁,男70例(33.8%),女137例(66.2%),总体FACIT疲劳量表得分为(37.50±9.05)分。ITP患者FACIT疲劳量表得分与血小板计数呈正相关(r= 0.307,P<0.001),与出血严重程度、睡眠质量、抑郁情绪、焦虑情绪呈负相关(r值分别为-0.276、-0.654、-0.598、-0.616,P值均<0.001)。多因素线性回归分析显示,血小板计数(P<0.001)、出血程度(P=0.004)、睡眠质量(P<0.001)、抑郁情绪(P<0.001)与ITP患者的疲劳严重程度显著相关,血小板计数偏低、出血程度越重、睡眠质量越差、抑郁情绪越明显,提示疲劳程度越严重。
ITP患者的疲劳症状受多种因素影响,改善睡眠质量、消除抑郁情绪、提高血小板数目、改善出血症状等措施有助于缓解疲劳程度。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发免疫性血小板减少症(ITP)是一种免疫异常介导的出血性疾病,主要表现为外周血小板计数减少,皮肤、黏膜及内脏出血,颅内出血的发生率为0.1%~0.5%[1]。尽管ITP患者发生严重致命性出血事件的风险低,但是大部分成人ITP患者进展为慢性ITP[2],相当一部分患者需要药物维持治疗,病情反复发作、对出血的焦虑、工作和日常活动受限、频繁血常规检测及长期用药使患者的生活质量受到严重影响。ITP的治疗目标是将患者血小板计数维持在安全水平、降低出血风险。另外,健康相关生活质量(health-related quality of life,HRQoL)的改善越来越受到重视,已成为ITP患者疗效评价的重要指标[3]。
疲劳是健康相关生活质量的重要组成部分,是慢性病患者的常见症状,主要表现为一种主观上的虚弱、精力不足、疲倦的感受[4]。近几年,ITP相关的疲劳症状逐渐引起国外研究者的重视[4,5,6]。由于疲劳症状主观性强,因此,选择合适的疲劳症状评估量表是开展疲劳研究的基础。慢性病治疗功能评估疲乏量表(functional assessment of chronic illness therapy-fatigue,FACIT疲劳量表)是有效、独立的疲乏自评或他评量表[7],题目简短、容易理解。我们应用FACIT疲劳量表对中国成人ITP患者的疲劳症状进行评估并研究其影响因素。
2015年4月1日至2015年10月31日在中国医学科学院血液病医院诊治的207例ITP患者纳入本研究。所有患者的诊断符合文献[8,9]。纳入标准:①年龄>18岁;②PLT<100×109/L,白细胞计数及血红蛋白浓度正常;③意识清楚,具有一定的阅读和理解能力;④自愿参与本研究。排除标准:①继发性血小板减少;②有严重合并症(感染、药物、肿瘤、免疫缺陷病、心脑血管疾病病史、结缔组织病等);③合并贫血者(男性HGB<120 g/L,女性HGB<110 g/L)。所有患者均知情同意。
由医务人员对入组患者进行评估,并指导患者完成疲劳及相关因素的问卷调查。疲劳的相关因素的问卷内容包括:①一般情况调查表:包括性别、年龄、病程、教育背景、职业、家庭情况、合并症等。②疾病相关指标:包括血小板计数、疾病分期、治疗手段。应用ITP出血评估工具(ITP-BAT)版本1.0[10]对患者就诊时的出血严重程度进行评估。③疲劳症状评估:采用FACIT疲劳量表评估患者上周的疲乏程度及其对认知、生理、心理、社交方面的影响。量表总分范围0~52分,分值越高,表明患者的疲乏程度越轻。该量表在ITP患者中具有良好的可重复性、内部一致性,并且和其他疲乏测量工具及疾病特征指标相关性良好,可作为独立的疲乏自评或他评量表广泛使用[7,11]。④情绪评估:医院焦虑抑郁量表(hospital’s anxiety and depression scale,HADS)包括焦虑(HADS-A)和抑郁(HADS-D)2个分量表,得分越高,焦虑或抑郁越严重[12]。⑤匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI):由主观睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物的应用及日间功能障碍7个项目构成,每项按0(很好)、1(较好)、2(较差)、3(很差)来计分,累计得分即为PSQI总分。总分范围为0~21分,总分越高,睡眠质量越差[13]。
采用SAS 9.2进行统计学描述与分析。定量资料符合正态分布者用 ±s表示。计数资料以百分数(%)表示。不同临床参数分组FACIT疲劳量表得分差异比较运用t检验,相关性分析采用Pearson相关分析。多因素线性回归分析用于分析ITP患者疲劳的相关因素。以P<0.05为差异有统计学意义。运用Bootstrap重采样过程对线性回归分析的结果进行敏感性分析。
±s表示。计数资料以百分数(%)表示。不同临床参数分组FACIT疲劳量表得分差异比较运用t检验,相关性分析采用Pearson相关分析。多因素线性回归分析用于分析ITP患者疲劳的相关因素。以P<0.05为差异有统计学意义。运用Bootstrap重采样过程对线性回归分析的结果进行敏感性分析。
总计发放问卷210份,收回有效问卷207份(占98.6%)。患者一般情况见表1。男∶女为0.51∶1。中位年龄为42(18~72)岁,≤60岁150例,>60岁57例。入组时中位PLT为35(1~350)×109/L,PLT<30×109/L 93例(44.9%),PLT(30~100)×109/L 91例(44%),PLT>100×109/L 23例(11.1%)。142例患者(68.4%)有出血表现,122例(85.9%)仅有皮肤黏膜出血,20例(14.1%)有器官出血。全部患者中,68例(32.7%)合并其他疾病(高血压20例,糖尿病20例,慢性扁桃体炎5例,甲状腺良性结节10例,肝功能损害4例,高脂血症5例,末梢神经炎2例,糖皮质激素相关骨质疏松2例)。全部患者中位PSQI得分为6(0~20)分,中位HADS-D得分为2(0~16)分,中位HADS-A得分为3(0~19)分。

207例原发免疫性血小板减少症(ITP)患者的一般临床资料
207例原发免疫性血小板减少症(ITP)患者的一般临床资料
| 指标 | 结果 | |
|---|---|---|
| 年龄[岁,M(范围)] | 42(18~72) | |
| 性别[例(%)] | ||
| 男 | 70(33.8) | |
| 女 | 137(66.2) | |
| 教育背景[例(%)] | ||
| 小学及以下 | 113(54.5) | |
| 中学及以上 | 94(45.5) | |
| 职业状态[例(%)] | ||
| 在职 | 135(65.0) | |
| 无业 | 72(35.0) | |
| 婚姻状况[例(%)] | ||
| 单身(未婚、丧偶、离异) | 46(22.4) | |
| 已婚 | 161(77.6) | |
| 疾病分期[例(%)] | ||
| 新诊断ITP | 59(28.6) | |
| 持续性ITP | 42(20.4) | |
| 慢性ITP | 106(51.0) | |
| 血小板计数[例(%)] | ||
| <30×109/L | 93(44.9) | |
| (30~99)×109/L | 91(44.0) | |
| ≥100×109/L | 23(11.1) | |
| ITP相关治疗措施[例(%)] | ||
| 无 | 90(43.5) | |
| 1种 | 91(44.0) | |
| ≥2种 | 26(12.5) | |
| 合并症[例(%)] | ||
| 无 | 68(32.7) | |
| 有 | 139(67.3) | |
| 出血严重程度[例(%)] | ||
| 无出血 | 65(31.4) | |
| 轻度出血 | 60(29.0) | |
| 中度出血 | 60(29.0) | |
| 大量出血 | 16(7.7) | |
| 严重出血 | 6(2.9) | |
ITP患者FACIT疲劳量表得分为(37.50±9.05)分。按性别、教育程度、婚姻状况、疾病分期、用药情况及合并症分组,各亚组间患者的疲劳严重程度差异无统计学意义(P值均> 0.05)(表2)。
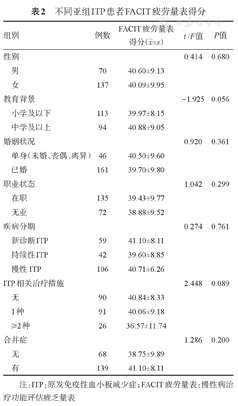
不同亚组ITP患者FACIT疲劳量表得分
不同亚组ITP患者FACIT疲劳量表得分
| 组别 | 例数 | FACIT疲劳量表得分( ±s) ±s) | t/F值 | P值 | |
|---|---|---|---|---|---|
| 性别 | 0.414 | 0.680 | |||
| 男 | 70 | 40.60±9.13 | |||
| 女 | 137 | 40.09±9.95 | |||
| 教育背景 | -1.925 | 0.056 | |||
| 小学及以下 | 113 | 39.97±8.15 | |||
| 中学及以上 | 94 | 40.88±9.05 | |||
| 婚姻状况 | 0.920 | 0.361 | |||
| 单身(未婚、丧偶、离异) | 46 | 40.50±9.60 | |||
| 已婚 | 161 | 39.70±9.80 | |||
| 职业状态 | 1.042 | 0.299 | |||
| 在职 | 135 | 39.43±9.77 | |||
| 无业 | 72 | 38.88±9.52 | |||
| 疾病分期 | 0.274 | 0.761 | |||
| 新诊断ITP | 59 | 41.10±8.11 | |||
| 持续性ITP | 42 | 39.60±8.85 | |||
| 慢性ITP | 106 | 40.71±6.26 | |||
| ITP相关治疗措施 | 2.448 | 0.089 | |||
| 无 | 90 | 40.84±8.33 | |||
| 1种 | 91 | 40.06±9.18 | |||
| ≥2种 | 26 | 36.57±11.74 | |||
| 合并症 | 1.286 | 0.200 | |||
| 无 | 68 | 38.75±9.89 | |||
| 有 | 139 | 41.10±8.11 | |||
注:ITP:原发免疫性血小板减少症;FACIT疲劳量表:慢性病治疗功能评估疲乏量表
FACIT疲劳量表得分与血小板计数呈正相关(r= 0.307,P < 0.001),与出血严重程度、睡眠质量、抑郁情绪、焦虑情绪呈负相关( r值分别为-0.276、-0.654、-0.598、-0.616,P值均<0.001),与年龄无相关性(r=-0.071,P= 0.309)。
以患者FACIT得分为因变量,以患者相关影响因素为自变量构建患者相关模型,结果显示,影响ITP患者疲劳严重程度的因素有睡眠质量(P<0.001)、焦虑情绪(P<0.001)、抑郁情绪(P<0.001)。ITP患者睡眠质量越差、焦虑情绪越明显、抑郁情绪越明显,则疲劳症状越严重。以患者FACIT得分为因变量,以疾病相关影响因素为自变量构建疾病相关模型,结果显示,血小板计数(P<0.001)和出血严重程度(P<0.001)是ITP患者疲劳严重程度的影响因素。血小板计数越低、出血严重程度越重的ITP患者疲劳程度越严重。详见表3。
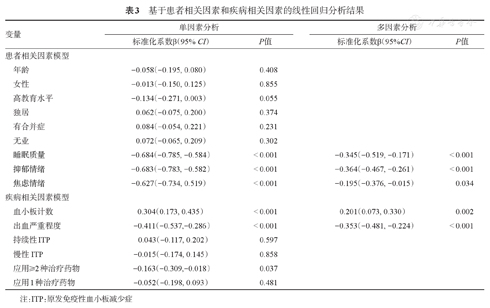
基于患者相关因素和疾病相关因素的线性回归分析结果
基于患者相关因素和疾病相关因素的线性回归分析结果
| 变量 | 单因素分析 | 多因素分析 | |||
|---|---|---|---|---|---|
| 标准化系数β(95% CI) | P值 | 标准化系数β(95%CI) | P值 | ||
| 患者相关因素模型 | |||||
| 年龄 | -0.058(-0.195, 0.080) | 0.408 | |||
| 女性 | -0.013(-0.150, 0.125) | 0.855 | |||
| 高教育水平 | -0.134(-0.271, 0.003) | 0.055 | |||
| 独居 | 0.062(-0.075, 0.200) | 0.374 | |||
| 有合并症 | 0.084(-0.054, 0.221) | 0.231 | |||
| 无业 | 0.072(-0.065, 0.209) | 0.302 | |||
| 睡眠质量 | -0.684(-0.785, -0.584) | < 0.001 | -0.345(-0.519, -0.171) | < 0.001 | |
| 抑郁情绪 | -0.683(-0.783, -0.582) | < 0.001 | -0.364(-0.467, -0.261) | < 0.001 | |
| 焦虑情绪 | -0.627(-0.734, 0.519) | < 0.001 | -0.195(-0.376, -0.015) | 0.034 | |
| 疾病相关因素模型 | |||||
| 血小板计数 | 0.304(0.173, 0.435) | < 0.001 | 0.201(0.073, 0.330) | 0.002 | |
| 出血严重程度 | -0.411(-0.537,-0.286) | < 0.001 | -0.353(-0.481, -0.224) | < 0.001 | |
| 持续性ITP | 0.043(-0.117, 0.202) | 0.597 | |||
| 慢性ITP | -0.015(-0.174, 0.145) | 0.858 | |||
| 应用≥2种治疗药物 | -0.163(-0.309,-0.018) | 0.037 | |||
| 应用1种治疗药物 | -0.052(-0.198, 0.093) | 0.481 | |||
注:ITP:原发免疫性血小板减少症
将上述模型中有意义的变量作为自变量纳入最终的多因素分析模型,结果显示,血小板计数(P<0.001)、出血程度(P=0.004)、睡眠质量(P<0.001)、抑郁情绪(P<0.001)是ITP患者疲劳严重程度的影响因素,详见表3。运用基于5 000个自提生成的仿真数据集进行的自提法(Bootstrap)重采样过程对线性回归分析的结果进行敏感性分析,结果显示,纳入率最高的4个因素分别为PSQI(99.98%)、血小板计数(98.3%)、HADS-D(96.22%)和出血严重程度(85.26%),详见表4。
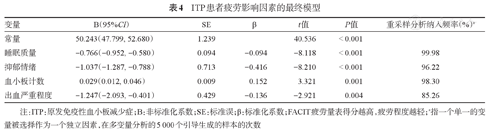
ITP患者疲劳影响因素的最终模型
ITP患者疲劳影响因素的最终模型
| 变量 | B(95%CI) | SE | β | t值 | P值 | 重采样分析纳入频率(%)a |
|---|---|---|---|---|---|---|
| 常量 | 50.243(47.799, 52.680) | 1.239 | 40.536 | < 0.001 | ||
| 睡眠质量 | -0.766(-0.952, -0.580) | 0.094 | -0.094 | -8.118 | < 0.001 | 99.98 |
| 抑郁情绪 | -1.037(-1.287, -0.788) | 0.713 | -0.416 | -8.210 | < 0.001 | 96.22 |
| 血小板计数 | 0.029(0.012, 0.046) | 0.009 | 0.152 | 3.321 | 0.001 | 98.30 |
| 出血严重程度 | -1.247(-2.093, -0.401) | 0.429 | -0.136 | -2.921 | 0.004 | 85.26 |
注:ITP:原发免疫性血小板减少症;B:非标准化系数;SE:标准误;β:标准化系数;FACIT疲劳量表得分越高,疲劳程度越轻;a指一个单一的变量被选择作为一个独立因素,在多变量分析的5 000个引导生成的样本的次数
目前,国内外针对ITP患者疲劳的研究较少。Newton等[5]运用疲劳影响量表(fatigue impact scale, FIS)对585例英国ITP患者及93例美国ITP患者进行疲劳评估,结果发现,疲劳发生率分别为39%及22%。Sarpatwari等[14]通过横断面调查研究发现,12.5%的ITP患者因疲劳而"总是或经常"为工作或上学而请假。本课题组曾运用SF-36对ITP患者进行生活质量评估,结果发现,ITP患者精力维度得分对于正常人[15]。本研究中,ITP患者FACIT疲劳量表得分(37.5±9.05)分,低于文献[16]中报道的正常健康人群的FACIT疲劳量表得分。
我们收集了患者的年龄、性别、婚姻状况、受教育程度、居住条件等患者的一般资料。结果显示,FACIT疲劳量表得分与年龄无相关性,与文献[5]结果一致。性别、婚姻状况、受教育程度、职业状态对FACIT疲劳量表得分无影响。Newton等[5]应用FIS对有出血症状的ITP患者进行多因素分析时发现,女性是ITP患者疲劳的危险因素。女性被认为是疲劳症状的易感群体,但具体机制未明[4,5]。本研究未纳入伴有贫血的ITP患者,而此类患者多为女性,以泌尿生殖系统出血多见,推测本研究结果与文献[4,5]差异与此有关。
近期研究证实,ITP患者存在明显的焦虑、抑郁状态,引起生活质量的下降[17]。以往研究结果显示,ITP患者存在日间困倦问题[5],25%的ITP患者需要应用药物辅助睡眠[18]。另外,慢性病相关疲劳与睡眠和情绪问题相关[4,19]。因此,本研究还分析了情绪及睡眠质量对ITP相关疲劳的影响。结果显示,患者睡眠质量愈差,疲劳程度越严重;而焦虑和抑郁情绪越明显,疲劳程度越严重,与文献报道一致。Suvajdzic等[20]应用SF-36(Medical Outcomes-36)对ITP患者进行生活质量评估时发现,焦虑和抑郁情绪与精力维度得分负相关。Newton等[5]研究发现,日间困倦是影响无出血表现ITP患者的危险因素。另外,本研究中,多因素分析结果显示,抑郁情绪和睡眠质量是影响ITP患者疲劳严重程度的预测因素。
本研究中,ITP患者FACIT疲劳量表得分与血小板计数正相关,多因素分析显示血小板计数是ITP患者疲劳严重程度的重要影响因素之一。目前文献中关于疲劳与血小板计数之间的关系报道并不一致。Newton等[5]研究发现,PLT<100×109/L是伴有出血表现ITP患者疲劳症状的独立危险因素,而PLT<30×109/L是无出血表现ITP患者疲劳症状的独立危险因素。一项关于罗米司亭的临床试验显示,治疗后PLT>50×109/L者疲劳症状较治疗前明显改善[21]。本课题组应用SF-36进行生活质量调查时发现,按照PLT<30×109/L、(30~100)×109/L、>100×109/L分组,血小板计数并非精力维度的预测因素[15]。血小板减少通过何种机制影响ITP患者疲劳仍不清楚,有待进一步研究。
ITP作为一种出血性疾病,出血的部位、症状及程度对疲劳症状的影响不容忽视。Newton等[5]通过患者自评方式评估皮肤瘀斑频率(有时/经常/总是/很少/从不)和出血症状,结果显示,皮肤瘀斑和出血症状与ITP患者疲劳相关。本研究中应用的ITP-BAT评估工具能标准化描述患者起病和疾病不同时期的出血情况、指导治疗和评估止血疗效[10]。本研究发现,出血严重程度越重,FACIT疲劳量表得分越低,而多因素分析发现,出血严重程度是ITP患者疲劳严重程度的重要影响因素之一。另外,皮肤瘀斑可造成社交尴尬,限制患者社会活动和休闲活动,进而降低患者的生活质量[4]。
ITP相关疲劳的发生机制仍不清楚。有研究者提出"炎症性疾病行为"解释此现象[4]。IL-1、IL-6、TNF-α等通过血脑屏障,激活中枢神经系统的炎症反应通路(如NF-κB,MAPK等)改变中枢神经递质代谢和内分泌系统,进而促进发热导致睡眠干扰,快感消失。
需要指出的是,本研究属于横断面研究,无法观察到患者病情变化对疲劳症状的影响,无法确定睡眠质量、情绪与疲劳的因果关系。因此,今后有必要进行前瞻性研究,进一步了解ITP患者疲劳症状的动态变化。
感谢中国医学科学院肿瘤医院夏昌发老师协助进行数据分析



























