
通过应用不同剂量地塞米松干预新生小鼠全身炎症反应综合征(SIRS),检测血清细胞因子IL-8、IL-4、TNF-α的表达变化,探讨地塞米松在SIRS过程中的作用。
50只新生小鼠随机分为5组:空白对照组、盐水对照组和治疗组A、B、C,盐水对照组和治疗组小鼠建立SIRS模型。治疗组A:一次性皮下注射地塞米松2 mg/kg;治疗组B:皮下注射地塞米松1 mg/kg,每12小时1次,总量2 mg/kg;治疗组C:皮下注射地塞米松0.5 mg/kg,每12小时1次,总量2 mg/kg;盐水对照组:一次性皮下注射同体积生理盐水(0.4 ml/kg)。建模72 h后所有50只小鼠取尾静脉血清进行ELISA检测各组小鼠IL-4、IL-8、TNF-α水平。
盐水对照组和治疗组A、B、C小鼠IL-4、IL-8、TNF-α表达均高于空白对照组(P均<0.05);治疗组A、B、C小鼠IL-4、IL-8、TNF-α表达均低于盐水对照组(P均<0.05);治疗组B、C小鼠TNF-α、IL-8表达均低于治疗组A(P均<0.05),IL-4水平在治疗组A、B、C间无明显差异(P>0.05)。
新生小鼠SIRS时应用地塞米松可使促炎因子IL-8、TNF-α及抑炎因子IL-4表达降低,且小剂量多次给予的效果明显优于大剂量单次给予。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)为机体在遭受到外源或内源性刺激时,体内的促炎反应系统与抑炎反应系统失衡,产生过多的炎症介质而引起组织损伤的全身性炎症反应[1]。SIRS在儿科发病率及病死率较高,在新生儿其发病率占同期危重新生儿总数的45.3%~71.7%,病死率高达35.8%[2]。糖皮质激素(GC)是减轻炎症反应强度的重要甾体类激素,已经被广泛地应用于临床治疗SIRS,为探讨其在新生儿SIRS中的作用,我院于2011年10月至2012年10月间以新生小鼠注射脂多糖(LPS)构建SIRS模型,应用酶联免疫吸附实验(ELISA)检测不同剂量地塞米松干预新生小鼠SIRS时肿瘤坏死因子(TNF)-α、白细胞介素(IL)-4、IL-8的表达变化,探讨地塞米松在SIRS中的作用,为新生儿SIRS的早期诊治及预后判断提供理论基础。
新生(出生48 h内)健康BALB/c小鼠50只(由郑州大学医学院实验动物中心提供,雌雄不拘),分别以3%戊巴比妥钠30 mg/kg腹腔注射麻醉后,随机分为5组,每组10只:空白对照组、盐水对照组和治疗组A、B、C。盐水对照组和治疗组小鼠尾静脉注射LPS 5 mg/kg后24 h建立SIRS模型,建模成功后,治疗组A:一次性皮下注射地塞米松2 mg/kg;治疗组B:皮下注射地塞米松1 mg/kg,每12小时1次,总量2 mg/kg;治疗组C:皮下注射地塞米松0.5 mg/kg,每12小时1次,总量2 mg/kg;盐水对照组:一次性皮下注射同体积生理盐水(0.4 ml/kg)。新生小鼠在未完成实验前死亡时,取正常小鼠按相应处理方法补充。以上各组处理完毕后,按统一建模72 h后抽取所有50只小鼠尾静脉血。
脂多糖(LPS,E.coli O55:B5),美国Sigma公司;地塞米松,湖北天药药业股份有限公司(国药准字H12020514)。
标本置于室温放置2 h或4 ℃过夜后于1 000转/min离心20 min,离心半径8 cm。应用ELISA检测各组小鼠血清IL-4、IL-8、TNF-α水平。
采用SPSS 15.0软件做统计处理,所有数据均符合正态分布,计量资料数据采用均数±标准差( ±s)表示,计量资料比较采用方差分析,组间比较采用t检验,P<0.05认为差异有统计学意义。
±s)表示,计量资料比较采用方差分析,组间比较采用t检验,P<0.05认为差异有统计学意义。
盐水对照组和治疗组A、B、C小鼠血清IL-4、IL-8、TNF-α表达水平均高于空白对照组(P均<0.05)。治疗组A、B、C小鼠IL-4、IL-8、TNF-α表达水平均低于盐水对照组(P均<0.05)。治疗组B、C小鼠TNF-α、IL-8表达水平均低于治疗组A(P<0.05),IL-4水平在治疗组A、B、C间无明显差异(P>0.05);治疗组B、C两组间IL-4、IL-8、TNF-α水平无明显差异(P>0.05)(表1)。
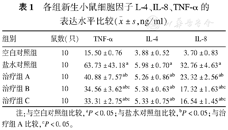
各组新生小鼠细胞因子L-4、IL-8、TNF-α的表达水平比较( ±s,ng/ml)
±s,ng/ml)
各组新生小鼠细胞因子L-4、IL-8、TNF-α的表达水平比较( ±s,ng/ml)
±s,ng/ml)
| 组别 | 鼠数(只) | TNF-α | IL-4 | IL-8 |
|---|---|---|---|---|
| 空白对照组 | 10 | 15.50±0.76 | 3.88±0.52 | 3.70±0.83 |
| 盐水对照组 | 10 | 63.73±43.18a | 5.98±0.70a | 32.76±4.63a |
| 治疗组A | 10 | 40.88±7.57ab | 5.26±0.86ab | 23.32±2.56ab |
| 治疗组B | 10 | 34.56±3.62abc | 5.38±0.63ab | 17.32±1.63abc |
| 治疗组C | 10 | 33.31±2.75abc | 5.33±0.75ab | 16.54±1.45abc |
注:与空白对照组比较,aP<0.05;与盐水对照组比较,bP<0.05;与治疗组A比较,cP<0.05。
SIRS是机体内促炎与抑炎两大系统失衡造成组织及多器官损伤的全身性炎症反应,其本质是炎症介质的超常释放。体内的促炎与抑炎介质存在复杂的多环反馈调节体系以保持机体免疫系统的动态平衡,在外界刺激下,促炎症介质明显升高打破了这种平衡,从而诱发SIRS[3]。SIRS发病原因多种多样,非感染因素是早发新生儿SIRS的主要原因,以缺血、缺氧及分娩时异物吸入等因素为主;感染因素则是晚期新生儿SIRS的主要病因[4]。国内外多以大鼠注射LPS构建SIRS模型研究其发病机制,已经证实许多炎症介质与SIRS的发生、发展相关。其中促炎因子如TNF、内毒素、血小板活化因子以及IL-1、IL-6、IL-8等;抑炎因子如IL-4、IL-10、IL-13及转化生长因子-β等[5]。本实验以新生小鼠注射LPS构建SIRS模型,经检测SIRS模型组新生小鼠促炎因子TNF-α、IL-8及抑炎因子IL-4的表达均高于空白对照组,证实新生小鼠SIRS时体内促炎与抑炎因子表达均有升高。
研究表明,机体遭受刺激后,靶细胞迅速产生急性期蛋白-1、核因子-κB等细胞因子,这些细胞因子又激活、释放大量其他炎症细胞因子,产生促炎的"瀑布样"效应[6]。同时,下丘脑-垂体-肾上腺皮质轴兴奋释放GC来减低炎症反应强度。GC是由肾上腺皮质分泌的甾体类激素,能够降低毛细血管的通透性,减轻内毒素对上皮细胞的损伤,防止细胞膜和溶酶体膜破裂;还可以抑制血小板的聚集、白细胞活化,减轻组织损伤程度。GC需要与糖皮质激素受体(GR)结合才能发挥生物学效应[7,8]。目前,SIRS治疗主要有抗炎症介质治疗、激素治疗、血液净化、基因治疗等,其中应用GC最为普遍,临床上亦有较好的疗效。地塞米松是临床应用较广的GC,多年来用于治疗成人及小儿SIRS,因其具有抑制生长等多种不良反应,新生儿应用GC的剂量与指征始终争议不断。本实验应用不同剂量地塞米松注射观察SIRS模型各组新生小鼠细胞因子IL-4、IL-8、TNF-α表达发现:(1)治疗组A、B、C小鼠IL-4、IL-8、TNF-α表达水平均低于盐水对照组(P<0.05),说明应用地塞米松可降低新生小鼠促炎因子TNF-α、IL-8及抑炎因子IL-4的表达,从而可用来治疗SIRS;(2)小剂量治疗组B、C小鼠IL-8、TNF-α水平均低于大剂量治疗组A(P<0.05),而IL-4水平与治疗组A无明显差异;小剂量治疗组B、C两组间IL-4、IL-8、TNF-α水平无明显差异。表明治疗新生小鼠SIRS时小剂量多次给予地塞米松的效果要明显好于大剂量单次给予,应用较小的剂量即可达到治疗SIRS的目的,这可能与GR的表达有关:新生小鼠在遭受LPS刺激时TNF-α、IL-8等促炎因子大量表达,GC-GR复合物可直接或者间接抑制IL-6、IL-8及TNF-α等炎性因子的合成、释放,从而发挥其显著的抗炎与抗免疫作用[9,10];而研究发现,TNF和IL家族中的促炎因子对GR调控的靶基因还具有抵抗作用[11],GR调控能力受到抑制,影响GC发挥效应,故而引发GC抵抗,造成大剂量使用GC后,GR表达减少,与GC的亲和力亦下降,影响GC发挥其抗炎作用[12]。因此,地塞米松小剂量多次给予的效果要明显优于大剂量单次给予,从而可避免小儿应用大剂量GC的多种不良反应,本研究为新生儿SIRS的激素治疗提供了理论基础。






























