
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
体外膜肺(ECMO)是一种改良后的心肺分流治疗,用于较长时间的持续心肺替代支持,主要用于对传统治疗无效的心肺衰竭患者。ECMO通过以血流泵与氧合器组成核心设备进行气体交换,血管接入方式分为胸内和胸外两种。ECMO临床应用已有60余年历史。至2014年底,全球已有6万余例登记注册的ECMO临床治疗病例,发达国家现已在专业化的治疗中心内开展ECMO治疗,由于治疗费用昂贵及其技术限制,全球各地的临床应用分布差异较大,其中欧美等发达国家占有明显优势。
ECMO衍生于心外科的体外循环。1937年Gibbon等将心外科体外心肺循环技术在实验室改良形成初期ECMO。之后,虽然心外科技术迅速发展,包括排空心脏、心脏停搏等技术应用,使心外科医师有充裕的时间打开心腔进行手术,但ECMO却未得到同步发展。1955年,出现了一次性泡型体外氧合器,以后又诞生了膜氧合器。氧合器与体外循环血泵的组合,从硬件上基本满足了新生儿及儿童的应用需求。在开展全身肝素化辅助抗凝后,ECMO技术逐步成熟。但在以后的数年里,ECMO因疗效并未显示出优势,其临床应用也未得到广泛认可。1976年Bartlett医师首先报道了ECMO抢救首例新生儿成功病例。患儿为胎粪吸入综合征合并严重的呼吸衰竭,在呼吸机最大支持下婴儿仍不能纠正缺氧,PaO2降至12 mmHg(1 mmHg=0.133 kPa),Bartlett将ECMO机从实验室搬至NICU床旁,进行了第1例婴儿病例的ECMO治疗。72 h后婴儿病情好转,最终恢复正常。病房护士在婴儿存活后为其取名为Esperanza(字意为希望)。在得到初步临床经验后,ECMO进入了持续发展阶段。
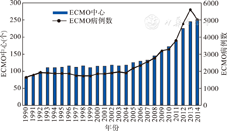
在以后的发展中,ECMO的疗效、并发症及应用发展问题一直受到关注。为了收集ECMO的应用经验,1980年美国密西根大学建立了ECMO登记注册制度,1984年由John Toomasain医师创建了新生儿ECMO登记注册。1989年国际体外生命支持组织(extracorporeal life support organi-sation,ELSO)机构正式建立,为促进国内及国际多院校合作研究及交流提供了平台。随后有大量病例样本在ELSO注册登记,每年登记的治疗病例数也在增加(图1)。ELSO将当今的治疗病例模块分为新生儿/儿童/成人以及严重呼吸衰竭/心外科/急诊复苏两组进行组合(表1),其中急诊心肺复苏上世纪后期才得到发展。在40年的ECMO统计病例中,以新生儿病例最多,其次为儿童和成人。病种分类中最多的是呼吸系统疾病,其次为心血管系统疾病和急诊心肺复苏病例。近年来由于新生儿呼吸管理技术的提高,呼吸系统疾病治疗例数逐渐减少,而后两组年龄段的患者比例有增多趋势。虽然呼吸支持技术的提高减少了ECMO治疗的患者数,但ECMO至今仍是那些对一般抗呼吸衰竭治疗无效患者的一种最后挽救方法。

2015年ELSO累计注册登记病例
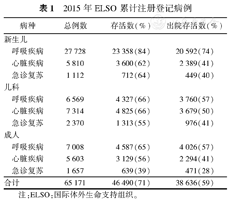
2015年ELSO累计注册登记病例
| 病种 | 总例数 | 存活数(%) | 出院存活数(%) | |
|---|---|---|---|---|
| 新生儿 | ||||
| 呼吸疾病 | 27 728 | 23 358(84) | 20 592(74) | |
| 心脏疾病 | 5 810 | 3 600(62) | 2 389(41) | |
| 急诊复苏 | 1 112 | 712(64) | 449(40) | |
| 儿科 | ||||
| 呼吸疾病 | 6 569 | 4 327(66) | 3 760(57) | |
| 心脏疾病 | 7 314 | 4 825(66) | 3 679(50) | |
| 急诊复苏 | 2 370 | 1 313(55) | 976(41) | |
| 成人 | ||||
| 呼吸疾病 | 7 008 | 4 587(65) | 4 026(57) | |
| 心脏疾病 | 5 603 | 3 129(56) | 2 294(41) | |
| 急诊复苏 | 1 657 | 639(39) | 471(28) | |
| 合计 | 65 171 | 46 490(71) | 38 636(59) | |
注:ELSO:国际体外生命支持组织。
在ECMO发展的40多年里,ECMO硬件及经验也得到了明显的提高。在硬件方面,核心部件中初期使用的滚轴血泵已逐步被离心泵取代,后者在应用稳定性、降低机械并发症风险方面更具优势。另一核心部件氧合器也由初期的泡型氧合器、膜氧合器被目前的高质量中空纤维氧合器所取代,后者及体外循环管路采用特殊材料聚甲基戊烯及肝素表面处理技术,显著改善了氧合器渗漏和管壁表面的生物反应性,降低了体外循环中凝血激活而产生的并发症。中空纤维氧合器与离心泵组合大幅度简化了设备构成和体外管路长度。此外,设备的稳定性、小型化也在不断进步。ECMO在应用技术方面也在不断发展,治疗模式除两种传统基本模式外,还引入了体外CO2清除以及转运ECMO。
经典的ECMO标准配置见图2。主要包括体外循环导管、血泵、氧合器、热交换器、供气系统、循环加热系统、抗凝系统及电子控制系统等部分。该系统基本工作原理如下。
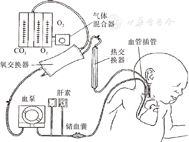

转流血泵主要作为维持体外血液持续流动的动力,将氧合后的血液回输至患者体内。目前使用较多的血泵为滚轴泵(roller pump)和离心泵(centrifugal pump)两种。其中以前者使用最广泛。后者在近年使用比例逐步增加。离心泵在低流量时使用时间较长容易出现溶血。但引血不依赖重力,设备简单、体积小,便于转运。离心泵运转时应避免右心房引血端负压过高,否则可导致局部组织损伤。滚轴泵引血采用被动方式(重力),需要高床、储血囊(bladder)等条件,其操作安全性及简便性不如离心泵。
氧合器(oxygenator)是ECMO的气体交换单元。硅胶膜(silicone membrane)氧合器现已很少应用。目前流行的主要是新型中空纤维(hollow-fibre)氧合器,体外膜肺中"膜肺"已不再符合氧合器的确切含义。氧合器需配置热交换器以便对体外血液进行加温,补偿体外丢失的热量。中空纤维氧合器的热交换器集合在氧合器内部。热交换的水流与血流呈反方向流动,这样可以取得较高的热交换效率。
(1)CPB中全部体循环血流与体外循环形成总循环血流,肺内血流处于停滞状态,并需要体外有一个较大的储血容器。因此CPB需要对血液进行完全抗凝处理。ECMO则与CPB不同,它是一个密闭系统,系统内所有血液均在持续流动,因而肝素化程度的要求较CPB低,低度抗凝状态有利于降低出血并发症。(2)在CPB过程中,针对出现的氧债和代谢性酸中毒一般通过降低患者体温处理,使其在氧输送和氧消耗之间达到平衡。ECMO则通过使血红蛋白完全氧饱和,维持红细胞压积来最大限度地提供氧输送来维持内环境平衡,而不采用降温处理。
ECMO技术还包括将血引入体外循环、进行气体交换、加温后反输回体内的过程,其中关键及技术瓶颈为置入导管内径和抗凝剂应用。在低体重婴儿导管插入较为困难,脑室内出血也使抗凝剂使用的危险性增加。近年来已出现体外循环肝素化管路系统,目的为降低和减少ECMO期间全身肝素应用的剂量,降低创伤、有出血倾向的患者在ECMO期间的出血并发症。
ECMO基本模式分为静脉-动脉(VA-ECMO)和静脉-静脉(VV-ECMO)两种,前者能提供有效氧合血流至动脉系统,提供有效动脉血流和氧输送,起到心肺功能完全支持作用;后一种模式引血方式同VA-ECMO,回输时氧合血流注入静脉系统,使静脉氧分压提高,起到呼吸支持的作用。由于VV法技术简单,其并发症相对较轻。此外,一些拓展模式如体外CO2清除模式等,也适用于呼吸衰竭患者的呼吸支持。
VV与VA两种循环模式的区别在于回流血途径不同。两者的引出血均来自静脉系统(通常为右颈静脉插管至右心房),大年龄患者为获得足够血量有时会采用双血管引流。VA-ECMO的氧合血回流至体循环动脉系统。常选择动脉为右颈总动脉或股动脉。婴儿及儿童的动脉血回流导管通常经右颈动脉插至主动脉弓上方,并在ECMO撤离时进行右颈动脉结扎。颈动脉的置管和结扎阻断了右侧颈动脉血流,在一定程度上影响了该侧颈动脉血流供应;但小儿的脑血流能很快通过椎动脉和左颈动脉经Willis环交通支得到代偿。至今尚无研究证明颈动脉结扎导致严重脑功能异常。但这一危险性使得临床上对低氧性呼吸衰竭患者更倾向于将VV方式作为首选。
在VV-ECMO中,氧合血回输至腔静脉或右心房,在进入肺动脉前与体内静脉血混合。该模式避免了颈动脉插管和结扎。同时,静脉氧分压增高可缓解肺动脉低氧时产生的痉挛。由于VV模式的氧输送需有良好的心功能状态作为保证,故只适用于心功能良好的低氧血症患者。在减少ECMO创伤方面,近年来在VV-ECMO中开始使用单根双腔导管法。应用时只需将一根双腔导管经右颈静脉置入右心房,引流血与回流血分别从导管的一个管腔内行走。导管正确放置可以降低血流重复循环(称为recirculation)。单根双腔导管的另一个优点为可直接经皮穿刺置管,进一步降低了局部创伤和体外循环抗凝后的伤口出血。单根双腔导管目前适宜于2.2~12.0 kg体重患儿。
ECMO的氧交换主要由氧合器完成。影响氧合器氧交换的因素包括氧合器弥散功能,膜厚度及表面积,以及膜两侧的氧分压差梯度。患者治疗初期所需的氧输送主要来自氧合器氧合及体外循环血流,而CO2清除依赖氧合器中通过的气流量。氧合器中红细胞的停留时间与体外血流量有关,氧合器有最高血流量限制,在设定流量范围内氧合器能提供最大氧合,例如表面积0.8 m2的氧合器的流量上限为1 000 ml/min,每分钟能提供50 ml氧。氧合器应用时应根据患者年龄或体重选择相应的规格。在ECMO血流低于氧合器额定上限值时,红细胞能得到充分氧合,能满足氧输送所需的氧含量。但如果血流超出氧合器的额定上限值,则会影响输出血流的氧含量。在ECMO支持下患者肺进行的氧交换一般很少,在计算氧输送时可以忽略。但VA-ECMO时患者的心输出量变化会影响总体氧输送量。在VV-ECMO中,患者PaO2和SaO2会分别与右心房混合血PvO2和SvO2一致。SaO2不会超过95%,重症患者SaO2一般在80%左右或更低,PaO2在40 mmHg左右。此时只要患者有足够的心输出量,可以满足机体所需的氧输送。血红蛋白含量在氧输送中也具有重要地位。当有贫血但静脉氧含量并不低时,氧合器中的氧交换量仍会出现下降,此时通过输血可以提高氧交换效率及血氧含量。提高氧合器氧气输入流量及增加体外循环血流是提高血氧含量的常用措施。
CO2产生量与氧代谢相关,其生成量可通过氧耗量和呼吸商进行计算,呼吸商一般为0.7~0.8,纯碳水化合物代谢则为1.0。ECMO中CO2清除不受血红蛋白及心输出量影响,而与通气量有关。由于CO2肺弥散能力远大于氧弥散,膜肺治疗中很少存在CO2清除障碍。氧合器中的CO2弥散梯度在40~45 mmHg左右(气流侧近似为零)。CO2清除还取决于氧合器特性,无论硅胶膜或中空纤维氧合器,应用时通过控制氧合器气流量来调节CO2交换平衡。在ECMO治疗中有时会采用控制体内CO2水平来提高疗效,如降低血液CO2水平来降低肺动脉压力,减轻脑水肿等。调节CO2水平不宜太快,一般在4~8 h后达到目标值。
人体代谢存在氧消耗(VO2),是指机体组织进行有氧代谢所消耗的氧量。正常人VO2:新生儿5~8 ml/(kg·min),儿童4~6 ml/(kg·min),成人3~5 ml/(kg·min)。氧输送(DO2)定义为动脉系统供应至周围组织的氧容量,一般在20 ml/(kg·min)左右。在生理情况下,DO2/VO2比值为4~5(图3)。在VO2发生改变时,DO2会出现相应变化。在病理情况下,DO2可能会不满足上述比值,此时会导致无氧代谢和酸中毒。
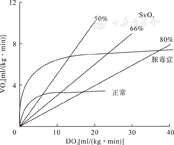

正常时DO2保持在VO2的4~5倍;当DO2降至5 ml/(kg·min)以下时,会出现器官组织显著缺氧;脓毒症状态下组织氧耗显著增高;3根直线分别代表不同静脉氧饱和度时VO2与DO2的关系。
VO2反映了组织血流灌注(或心输出量)及组织氧摄取(动静脉氧含量差值)状态。血氧含量(CxO2)及氧消耗可分别用下列公式表示:CaO2=[Hb×SO2×1.36]+0.00031×PO2;VO2=CO×(CaO2-CvO2);其中Hb为血红蛋白含量,SO2为血氧饱和度,PO2为血氧分压,CO为心输出量,CaO2为动脉氧含量,CvO2为静脉氧含量。低氧血症及贫血均可导致血氧含量下降(图4)。当CO不变,VO2增大时,出现静脉氧含量下降或动静脉氧含量差值变宽。静脉氧含量较低的血红蛋白在肺循环氧合时获取氧量增加,结果动脉血氧含量不变。由此,在动静脉氧含量差值变宽条件下,仍可以满足并维持组织氧消耗需求。由此临床上将静脉氧饱和度(SvO2)作为氧消耗和组织灌注的评价指标。在SvO2显著降低时应增加ECMO氧输送量。非ECMO治疗患者在VO2增大时,机体代偿形式为增加CO和肺氧合量,从而提高DO2。当无法继续提高CO或肺血无法达到代偿及目标氧合时,可视为ECMO支持的指征。
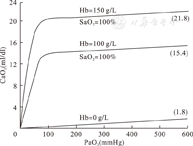

ECMO的重要价值在于提供DO2,DO2可用以下公式表示:DO2=CaO2×CO。人体SvO2一般在75%左右,VO2约为DO2的20%~25%。ECMO治疗中SvO2下降提示组织供氧不足,反之则提示氧供改善及氧需求下降。ECMO治疗的SvO2为右心房水平的混合静脉血氧饱和度,当应用VV-ECMO,或存在左右心腔血液分流(如先天性心脏病)时,SvO2值的意义会发生偏差。VV-ECMO模式存在SvO2误差是因为存在再重复循环(recirculation)现象。VA-ECMO模式下患者的动脉血流主要来自体外循环血流,即使心肺功能很差也能维持目标DO2。当固定ECMO流量不变条件下,PaO2增高提示肺功能好转。VV-ECMO患者病情改善后,SaO2及SvO2会出现同步增高。


























