
在BALB/c小鼠哮喘气道重塑模型中,探讨支气管上皮间质转化(epithelial-mesenchymal transformation,EMT)是否参与哮喘气道重塑,以及吸入型糖皮质激素治疗对其的影响。
选取30只BALB/c小鼠随机分为对照组、哮喘组、布地奈德(Budesondine,BUD)组;通过检测支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中白细胞总数及嗜酸性粒细胞百分比来评价气道炎症及血OVA-sIgE含量,评价过敏状态来验证BALB/c小鼠哮喘模型;通过测量HE染色、Masson染色监测气道重塑程度;通过ELISA检测BALF中转化生长因子(transforming growth factor,TGF)-β蛋白含量,免疫组织化学检测观察成纤维细胞特异性蛋白1(fibroblast specific protein-1,FSP-1)在肺组织中表达区域,蛋白免疫印迹及实时定量PCR法检测E-钙黏蛋白(E-Caderin)、FSP-1、波形蛋白(Vimentin)蛋白及mRNA表达趋势来评价肺组织支气管EMT。
哮喘组与对照组相比,BALF中白细胞总数增加,嗜酸性粒细胞百分比明显增加,血浆OVA-sIgE明显升高,支气管壁增厚及胶原沉积面积增多(P<0.01),BUD组上述指标低于哮喘组(P<0.01);哮喘组BALF中TGF-β表达增多,在支气管上皮区域出现FSP-1的表达,实时定量PCR及蛋白质免疫印迹结果均显示,与对照组相比,哮喘组肺组织中E-Caderin表达减少,FSP-1及Vimentin表达增多。而BUD组与哮喘组相比,E-Caderin表达增多,TGF-β及Vimentin的表达略减少,而FSP-1表达量与哮喘组无差别。
哮喘气道重塑的肺组织中出现了EMT现象,发生早期EMT的部位为支气管上皮区域;传统的雾化吸入BUD治疗不能完全抑制哮喘早期支气管EMT的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管哮喘(哮喘)是当今世界最常见的慢性呼吸道疾病之一,其发病率逐年增高,已成为严重的公共卫生问题。哮喘是以气道慢性非特异性炎症、气道高反应性和不可逆性气道重塑为特点。气道重塑是指气道在慢性炎症刺激下所发生的气道壁结构变化,导致肺功能持续性与进行性损害,是重症及难治性哮喘病理改变的重要基础。目前其机制仍很不明确,传统的观念认为气道重塑主要包括气道平滑肌细胞增生和肥大,细胞外基质沉积、基底膜增厚,炎症细胞浸润和腺体增生肥大。近年来研究显示气道上皮细胞在气道重塑起到重要作用[1,2],支气管上皮作为气道内外环境的第一道屏障,在哮喘时气道上皮发生损伤和损伤后的异常修复可能是哮喘发病中的关键环节,那么上皮细胞损伤后将会发生什么改变?是否会以支气管上皮间质转化(epithelial-mesenchymal transformation,EMT)的形式来参与哮喘气道重塑的进展?这是本研究想要解决的问题。
吸入型糖皮质激素药物(inhaled glucocorticoid,ICS)是GINA方案(Global Initiative for Asthma)推荐的用于哮喘治疗的一线药物[3],是目前缓解和控制哮喘发作最有效的药物之一,可有效控制哮喘气道炎症[4,5]。但也有研究认为,ICS不能抑制哮喘的进程,对气道重塑的治疗效果还有待进一步研究。布地奈德(budesondine,BUD)是常用的吸入型糖皮质激素之一。因此,本研究拟在建立小鼠哮喘气道重塑模型的基础上,观察支气管EMT相关标志物在肺组织表达情况及BUD对其影响。
生后6周、体重18~20 g及饲养条件一致的清洁级雌性BALB/c小鼠30只,随机分为3组,每组10只,分别为对照组、哮喘组、BUD组。(1)对照组:小鼠在致敏阶段注射0.5 ml生理盐水,激发阶段给予生理盐水雾化吸入;(2)哮喘组:按照BALB/c小鼠哮喘气道重塑模型制作[5],即实验第1、8、15天腹腔注射以生理盐水溶解的20 μg OVA和2 mg氢氧化铝混合液0.5 ml致敏,实验第22天开始,给予OVA(生理盐水配制)雾化吸入,每次30 min,每天1次,连续14 d;(3)BUD组:致敏和激发的方法同哮喘组,实验第22天开始,OVA激发前1 h吸入生理盐水溶解的BUD雾化液5 ml(含BUD 1mg)持续30 min,每天1次持续14 d。
每只小鼠在末次OVA激发24 h内固定,经眼球取血,收集血清,用于ELISA分析。小鼠仰卧,打开胸腔,气管切开后,留置针置入,缝线固定,以PBS 0.3 ml灌洗3次,回收率80%以上,3 000 r/min(离心半径10 cm)离心5 min,上清为支气管肺泡灌洗液(BALF),保存在-80 ℃冰箱中待测定。分离肺组织,右肺经液氮速冻后置-80 ℃保存,用于蛋白免疫印迹及实时定量PCR检测,左肺浸入4%多聚甲醛固定,72 h后石蜡包埋,制成4 μm切片,用于肺组织HE染色、Masson染色及免疫组织化学检测。
用Image Pro-Plus 6.0图像处理测量分析软件对HE及Masson染色图像分析和测定。选择完整不含软骨的细小气管横断面进行测量,HE染色测量总管壁面积(Wat,μm2)和支气管基底膜周径(Pbm,μm),以Wat/Pbm表示管壁厚度。Masson染色每张切片取2个有完整同级支气管的视野,计算视野内胶原沉积面积占标本染色总面积百分比,计算其均值。
严格按照试剂盒要求操作步骤如下:设标准孔、待测样品孔、空白孔,分别加样,37 ℃温育1 h,洗板5次,加入A、B显色液,37 ℃温育30 min,加入终止液终止,于440 nm处酶标仪下测吸光度OD值,根据标准曲线计算样品待测指标浓度。
小鼠右肺组织切取50 mg组织在冰上剪成碎片,加入0.5 ml预冷的蛋白裂解液;超声匀浆30 s,12 000 r/min 4 ℃离心10 min,取上清分装,-80 ℃保存。分别灌10%的分离胶和5%的浓缩胶上样后进行SDS-PAGE,分离蛋白质并转到PVDF膜。5%脱脂奶粉封闭1 h,4 ℃一抗过夜,二抗室温孵育2 h,ECL发光法显影拍照;所得的图像用Image J分析软件进行灰度值分析。
取100 mg肺组织加1 ml Trizol进行匀浆,按照反转录及扩增试剂盒说明书,将RNA反转录为cDNA,取cDNA2 μl、SYBR预混液16 μl、上下游引物2 μl共计20 μl总反应体系行实时定量PCR。引物序列如下:E-caderin上游引物:5'-ATTGCAAGTTCCTGCCATCCT-3',下游引物:5'-CACATTGTCCCGGGTATCATCA-3';Vimentin上游引物5'-CCTATGTGACCCGGTCCTCG-3',下游引物5'-AAGGTCAAGACGTGCCAGAG-3';FSP-1上游引物5'-GGAGGCCCTGGATGTAATTGTG-3',下游引物5'-AAGGTCAAGACGTGCCAGAG-3';GAPDH为内参,引物序列如下:上游引物5'-CCTCTGCGCCCTTGAGCTAGGA-3',下游引物5'-CACAAGAAGATGCGGCCGTCTC-3'。反应条件:95 ℃变性30 s,60 ℃退火1 min,72 ℃延伸30 s,共40个循环。荧光定量PCR仪(ABI7500)自动分析并计算每个样本CT值,目的基因mRNA相对表达量以2-△△Ct形式得出。
鸡卵蛋白(OVA,Sigma公司),氢氧化铝分析纯(上海山浦化工有限公司),吸入用BUD混悬液(1 mg/2 ml,AstraZeneca公司),便携式PARIBOY雾化吸入器(德国PARI公司),兔抗小鼠FSP-1多抗购自proteintech公司,大鼠抗小鼠E-caderin单克隆抗体购自Abcam公司;Vimentin抗体购自Santa公司;SP免疫组化试剂盒购自北京中杉金桥公司;Masson染色试剂盒购自福建迈新公司;TRIsol购自life technology公司;RNA反转录试剂盒及DNA扩增试剂盒购自宝生物公司;SDS-PAGE凝胶配制试剂盒及全蛋白提取试剂盒购自碧云天公司;OVA-sIgE及TGF-β ELISA试剂盒购自R&D公司。
采用SPSS 17.0软件进行统计学分析,数据分析以均数±标准差( ±s)表示,组间比较用t检验,两变量的相关分析采用Pearson等级相关分析,以P<0.05为差异有统计学意义。
±s)表示,组间比较用t检验,两变量的相关分析采用Pearson等级相关分析,以P<0.05为差异有统计学意义。
哮喘组小鼠BALF中白细胞总数及嗜酸性粒细胞数明显高于对照组,尤以嗜酸性粒细胞数增多更明显(P<0.05)。BUD组BALF中白细胞总数及嗜酸性粒细胞数较哮喘组减少,但仍高于对照组(P<0.05),见表1。
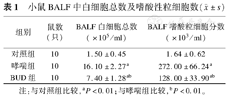
小鼠BALF中白细胞总数及嗜酸性粒细胞数( ±s)
±s)
小鼠BALF中白细胞总数及嗜酸性粒细胞数( ±s)
±s)
| 组别 | 鼠数(只) | BALF白细胞总数(×105/ml) | BALF嗜酸粒细胞分数(×103/ml) |
|---|---|---|---|
| 对照组 | 10 | 1.50±0.45 | 1.64±0.62 |
| 哮喘组 | 10 | 16.10±2.27a | 272.00±66.24a |
| BUD组 | 10 | 7.40±1.28ab | 128.00±33.90ab |
注:与对照组比较,aP<0.01;与哮喘组比较,bP<0.01。
哮喘组与对照组相比,小鼠血浆中OVA-sIgE明显增高(P<0.05)。BUD组的OVA-sIgE明显低于哮喘组(P<0.05)(表2)。
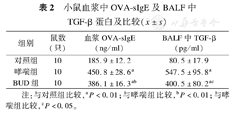
小鼠血浆中OVA-sIgE及BALF中TGF-β蛋白及比较( ±s)
±s)
小鼠血浆中OVA-sIgE及BALF中TGF-β蛋白及比较( ±s)
±s)
| 组别 | 鼠数(只) | 血浆OVA-sIgE(ng/ml) | BALF中TGF-β(pg/ml) |
|---|---|---|---|
| 对照组 | 10 | 185.9±12.2 | 80.5±17.9 |
| 哮喘组 | 10 | 450.8±28.6a | 547.5±95.8a |
| BUD组 | 10 | 386.1±16.3ab | 400.5±80.2ac |
注:与对照组比较,aP<0.01;与哮喘组比较,bP<0.01;与哮喘组比较,cP<0.05。
HE染色(图1A、图1B、图1C)及Masson染色(图1D、图1E、图1F)显示:对照组支气管上皮、黏膜肌层结构完整,细小支气管壁及平滑肌层较薄,管壁周围无炎症细胞浸润,上皮下胶原层较薄,肺泡间隔无明显增宽。哮喘组与对照组相比,肺组织病变明显,支气管壁增厚,黏膜皱袋增多,支气管上皮细胞肿胀,部分上皮细胞脱落,管腔内黏液增多,同级支气管管径及管壁面积增大,管壁及上皮下基底膜增厚及胶原明显增多,管壁及血管周围可见大量的炎症细胞浸润,肺泡间隔增宽。BUD组较哮喘组炎症细胞浸润、管壁增厚减轻。
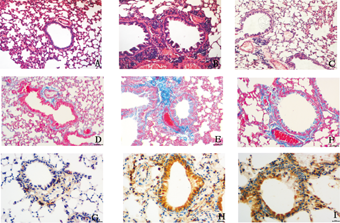

A-C:HE染色;D-F:Masson染色;G-I:FSP-1免疫组织化学染色;A,D,G:对照组;B,E,H:哮喘组;C,F,I:BUD治疗组。
哮喘组与对照组相比,Wam/Pbm及胶原沉积面积百分比明显增加(P<0.01)。BUD组与哮喘组相比,Wam/Pbm及胶原沉积面积百分比略有减少,但与对照组相比仍明显增多(P<0.01)。见表3。

小鼠Wat/Pbm及胶原沉积面积百分比的比较( ±s)
±s)
小鼠Wat/Pbm及胶原沉积面积百分比的比较( ±s)
±s)
| 组别 | 鼠数(只) | Wat/Pbm(μm) | 胶原沉积面积百分比(%) |
|---|---|---|---|
| 对照组 | 10 | 15.60±2.80 | 16.72±1.89 |
| 哮喘组 | 10 | 96.87±6.72a | 52.93±6.48a |
| BUD组 | 10 | 55.24±8.37ab | 37.34±4.07ab |
注:与对照组比较,aP<0.01;与哮喘组比较,bP<0.01。
哮喘组与对照组相比,小鼠BALF中TGF-β蛋白含量明显升高(P<0.01);BUD组与哮喘组相比,蛋白表达量略减少(P<0.05),与对照组相比,仍明显升高(P<0.01),见表1。
显微镜下观察显示,对照组可见肺间质以及支气管基底膜部,血管周围可见少量FSP-1表达,而支气管上皮处基本未见FSP-1染色;然而哮喘组及BUD组支气管上皮细胞均出现FSP-1大量表达,光镜下观察无明显差别,见图1G、图1H、图1I所示。
哮喘组与对照组相比,上皮细胞标志物E-caderin蛋白含量明显下降(P<0.01)。BUD组与哮喘组相比,蛋白表达量明显增高(P<0.01),与对照组相比,差异无统计学意义(P>0.05)(图2、图3);哮喘组与对照组相比,成纤维细胞表达标志物FSP-1蛋白含量明显升高(P<0.01);BUD组与哮喘组相比,蛋白表达量差异无统计学意义(P>0.05),与对照组相比,仍明显升高(P<0.01);哮喘组与对照组相比,间质细胞标志物Vimentin蛋白含量明显升高(P<0.01);BUD组与哮喘组相比,蛋白表达量略减少(P<0.05),与对照组相比,仍明显升高(P<0.01)。
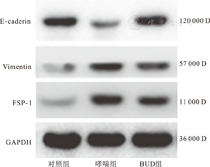

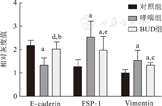

与对照组相比,aP<0.01;与对哮喘组相比,bP<0.01;与哮喘组相比,cP<0.05;与对照组相比,dP>0.05;与哮喘组相比,eP>0.05。
如图4所示,哮喘组与对照组相比,上皮细胞标志物E-caderin mRNA量明显下降(P<0.01)。BUD组与哮喘组相比,mRNA表达量明显增高(P<0.01),与对照组相比,差异无统计学意义(P>0.05);哮喘组与对照组相比,成纤维细胞表达标志物FSP-1 mRNA量明显升高(P<0.01);BUD组与哮喘组相比,mRNA量差异无统计学意义(P>0.05),与对照组相比,仍明显升高(P<0.01);哮喘组与对照组相比,间质细胞标志物Vimentin mRNA量明显升高(P<0.01);BUD组与哮喘组相比,mRNA量略减少(P<0.05),与对照组相比,仍明显升高(P<0.01)。
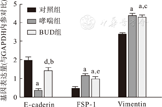

与对照组相比,aP<0.01;与对哮喘组相比,bP<0.01;与哮喘组相比,cP<0.05;与对照组相比,dP>0.05;与哮喘组相比,eP>0.05。
本研究通过OVA致敏及连续反复激发制作哮喘气道重塑模型。首先,哮喘气道重塑模型需要以下两方面证明:(1)哮喘是与特应性因素相关的慢性气道炎症性疾病,通过在血浆中检测OVA特异性IgE(OVA-sIgE)及通过BALF中嗜酸性粒细胞计数来评价BALB/c小鼠对OVA产生过敏反应的程度;(2)哮喘的反复发作易导致气道上皮和气道壁结构的改变,当出现上皮下纤维化、平滑肌增生、胶原蛋白沉积时即为气道重塑[6]。可通过HE染色、Masson染色观察BALB/c小鼠气道重塑程度。HE可以评价支气管周围及血管周围炎症细胞浸润程度支气管壁厚度;Masson染色可以观察支气管管腔黏液分泌(管腔内蓝染)以及胶原纤维明显增多。可见这些气道壁结构改变是哮喘气道重塑重要组成部分。那么,构成气道重塑的因素是否可能来源于EMT是本研究的设想。在本研究中,我们在哮喘肺组织检测到与EMT相关的指标发生了变化,上皮表达标志物表达减少,而间质表达标志物及成纤维细胞表达标志物表达增多,提示哮喘组小鼠肺组织出现了早期纤维化的现象,这可能是慢性哮喘肺功能进行性下降的病理因素[7]。并且在BALF中也发现TGF-β表达量明显增加。TGF-β是一种重要的促纤维化细胞因子,在哮喘患者的气道中,当上皮细胞、嗜酸性粒细胞、平滑肌细胞受到慢性过敏原刺激后可分泌大量的TGF-β[8],而分泌出的TGF-β反过来又加重支气管上皮细胞损伤甚至出现早期EMT现象。
哮喘组光镜下表现为支气管上皮细胞水肿、局灶性破坏和脱落以及杯状细胞增生,透射电镜下可见纤毛上皮细胞脱落以及纤毛排列紊乱,胞浆空泡增多以及杯状细胞黏液分泌颗粒明显增多,细胞间连接略松懈。这些结果都显示了哮喘组明显出现了支气管上皮细胞的损伤及形态变化[9]。气道上皮细胞作为在呼吸系统中介于宿主及环境之间,用于抵抗病原微生物、有毒气体以及过敏原的第一道防线[10]。当这道防线在反复接受变应原和病毒刺激后,天然的呼吸道屏障受到破坏,产生并活化,释放一系列的炎性介质、细胞因子、趋化因子和黏附分子等,主动参与哮喘的慢性炎症[11,12]。已遭受损伤的支气管上皮细胞在TGF-β的刺激下可发生EMT现象,进一步加重气道重塑[13,14]。本研究免疫组织化学结果显示,FSP-1在哮喘组支气管上皮区域表达,FSP-1是成纤维细胞特异性蛋白-1,属于钙结合蛋白质S100家族,是经典的成纤维细胞标志物,常用检测Ⅱ型EMT过程,在器官纤维化形成中,大部分发生Ⅱ型EMT的上皮细胞在转化早期即表达FSP-1[15]。FSP-1的表达主要局限于过渡阶段的上皮细胞和成纤维细胞,而哮喘模型组的支气管上皮出现FSP-1表达,提示上皮下成纤维细胞可能部分来源于支气管上皮细胞,即部分支气管上皮细胞可能出现了早期的EMT现象。
吸入糖皮质激素作为目前最有效的控制哮喘症状的治疗措施,成为哮喘治疗的基石,而吸入型BUD是常用的吸入型短效糖皮质激素之一[3]。本研究显示BUD组与哮喘组比较,血浆中OVA-sIgE,支气管周围炎症细胞浸润,支气管壁厚度及胶原沉积面积明显减少,但仍高于对照组;这些结果都提示吸入BUD可以缓解哮喘气道炎症,改善过敏状态,缓解部分气道重塑的进展。有研究表明,糖皮质激素对哮喘气道重塑的主要作用表现在可以有效抑制支气管平滑肌的增生及转型[16],在一定程度上减轻了气道重塑,但在哮喘气道重塑病理过程中,除了气道的慢性炎症的参与,支气管平滑肌的增生,可能存在更多的致病环节,糖皮质激素并不能抑制疾病的内在进程,扭转气道重塑的进展[17]。
E-caderin是气道上皮结构完整性的主要组成部分,可维持细胞膜稳定性以及上皮间屏障功能,本研究结果显示BUD可以抑制哮喘肺组织E-caderin降低,即糖皮质激素对维持上皮细胞膜形态是有利的,以往的研究也同样支持以上观点[18]。但值得注意的是,在本研究中发现BUD保护气道上皮细胞,修复支气管上皮的作用并不是完全的,治疗后的支气管上皮细胞仍存在异常的分泌,有研究显示糖皮质激素的治疗并不能抑制TGF-β所造成的EMT作用[19,20]。本研究也验证了此观点,在BALF中检测到TGF-β以及肺组织中Vimentin仅比哮喘组略减少,与对照组相比仍明显增多,而且无论是从病理免疫组织化学染色还是蛋白免疫印迹及实时定量PCR定量分析显示,BUD组与哮喘组FSP-1表达量均无明显差异,FSP-1仍大量出现在支气管上皮区域,即糖皮质激素不能完全抑制气道重塑发生,尤其是没有缓解早期EMT的发展。这也许可以解释糖皮质激素不能有效解决慢性哮喘肺功能进行性下降的问题。因此,我们仍需寻求更有效治疗慢性哮喘重塑尤其是控制支气管EMT的药物和治疗方法,避免发生严重气道重塑患者反复使用高剂量的糖皮质激素治疗,这也是目前研究的热点以及我们将来的研究方向[21,22,23,24]。
综上所述,慢性哮喘气道重塑的肺组织中出现了EMT现象,而支气管上皮细胞的损伤以及BALF中异常分泌的TGF-β以及FSP-1在支气管上皮的表达,表明发生早期EMT的部位为支气管上皮细胞;传统的雾化吸入BUD治疗一定程度上保护了支气管上皮,不能完全抑制哮喘小鼠早期支气管EMT的发生。



























