
分析利奈唑胺治疗儿童重症感染性疾病的疗效及安全性。
回顾性总结分析我院PICU接受利奈唑胺治疗的重症感染患儿53例。根据细菌培养结果或临床经验给予利奈唑胺治疗。53例患儿疗程6~43 d不等。观察患儿症状好转及阳性体征消失时间,评价其临床疗效。并于用药前、治疗3 d、疗程结束后监测血WBC、C反应蛋白、PLT、肝肾功能,以评估其安全性。
53例患儿中,痊愈40例(75.4%),显效7例(13.2%),进步自动出院3例(5.6%),无效3例(5.6%)。临床有效率88.6%(47/53)。53例中共检出革兰阳性菌24株,总体细菌清除率95.8%(23/24)。患儿于接受利奈唑胺治疗3 d时血WBC计数、C反应蛋白明显降低(P<0.05);治疗结束时进一步降低(P<0.001)。疗程结束后较用药前谷丙转氨酶、PLT、尿素氮、血肌酐无明显变化(P>0.05)。治疗过程中发生轻度腹泻2例,皮疹1例,PLT下降1例,中性粒细胞减少1例,监测肝、肾功能无异常。不良反应发生率9.4%。
利奈唑胺治疗儿童重症革兰阳性球菌感染临床疗效好,细菌清除率高,儿童耐受性好,安全性较高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
利奈唑胺是第一个应用于临床的新型口,恶唑烷酮类抗生素,主要适用于治疗耐药革兰阳性球菌所致的感染。2000年获得美国食品药品管理局批准上市。该药2007年8月在我国上市,儿童应用较成人相对晚。本文回顾性总结分析我院在PICU住院并接受利奈唑胺治疗的53例患儿的临床资料,以评价该药治疗儿童重症感染的疗效及安全性。
2008年12月1日至2011年12月30日,回顾性研究在北京儿童医院PICU住院并接受利奈唑胺治疗的患儿共53例。53例患儿小儿危重病例评分均≤90分[1],其中男26例,女27例;年龄1个月~12岁;疗程6~43 d。所有患儿在应用利奈唑胺前均应用过2~3种以上抗菌药物,包括阿莫西林-舒巴坦、头孢哌酮-舒巴坦、万古霉素、替考拉宁、美罗培南等,均因疗效欠佳或培养结果为耐药革兰阳性球菌而改用或加用利奈唑胺。53例患儿中14例用药前曾应用替考拉宁、30例曾应用万古霉素,因症状反复无法控制或药物不良反应停用,改为利奈唑胺治疗。患儿原发病及基础疾病见表1。

患儿原发病及基础疾病[例(%)]
患儿原发病及基础疾病[例(%)]
| 原发病 | 病例 | 基础疾病 | 病例 |
|---|---|---|---|
| 肺炎 | 6(11.3) | 免疫功能低下 | 6(11.3) |
| 肺炎合并脓胸/气胸 | 28(52.8) | 先天性心脏病 | 3(5.6) |
| 肺炎合并脓毒症 | 4(7.5) | 噬血细胞综合征 | 2(3.7) |
| 化脓性脑膜炎 | 3(5.6) | 急性白血病 | 1(1.8) |
| 肺炎合并化脓性脑膜炎 | 4(7.5) | 手足口病 | 1(1.8) |
| 骨髓炎 | 4(7.5) | 气道狭窄 | 1(1.8) |
| 肺炎合并感染性休克 | 4(7.5) | 甲基丙二酸血症 | 1(1.8) |
| 合计 | 53 | 合计 | 15 |
静脉或口服利奈唑胺剂量均为10 mg/(kg·次),每8小时1次。部分患儿合并其他病原体感染,根据临床具体情况,可联合头孢哌酮-舒巴坦、美罗培南及抗真菌药物。
按卫生部药政局1998年颁发的《抗菌药物临床研究指导原则》,抗菌药物疗效分级为痊愈、显效、进步、无效。痊愈:症状、体征、实验室检查[血WBC计数、PLT计数、C反应蛋白(CRP)、ALT、BUN、Cr]和细菌学检查等4项指标均恢复正常;显效:病情明显好转,但上述4项指标有1项未完全恢复正常;进步:用药后病情有所好转,但不明显;无效:用药72 h后病情无明显好转或加重。痊愈及显效作有效计,据此统计临床有效率。细菌学疗效按细菌清除(治疗后无致病菌生长)、未清除(治疗后原致病菌仍存在)来评定。
采用SPSS 19.0进行统计分析。对符合正态分布的计量资料用均数±标准差( ±s)表示,治疗前后组间比较采用方差分析;对非正态分布的计量资料用中位数(四分位数间距)表示,组间比较采用秩和检验;P<0.05为差异有统计学意义。
±s)表示,治疗前后组间比较采用方差分析;对非正态分布的计量资料用中位数(四分位数间距)表示,组间比较采用秩和检验;P<0.05为差异有统计学意义。
53例患儿疗程6~43 d不等。其中40例应用利奈唑胺治疗3 d内体温高峰下降,体征好转。8例在4~7 d症状、体征均好转。2例肺炎、脓胸患儿在用药第2~3周内体温下降,肺部体征好转。3例患儿治疗无效死亡:其中1例为先天遗传代谢病(甲基丙二酸血症)终末期;1例肺炎、脓胸、急性呼吸窘迫综合征合并噬血细胞综合征、多脏器功能衰竭、休克,治疗12 d家长放弃治疗;1例为先天气道狭窄合并冠状动脉发育异常导致呼吸衰竭、心力衰竭死亡。
患儿于接受利奈唑胺治疗3 d后血WBC计数、CRP明显降低(P<0.05),至治疗结束时WBC计数、CRP进一步降低(P<0.001)。疗程结束后较用药前谷丙转氨酶、PLT、BUN、Cr无明显变化(P>0.05),见表2。

53例患儿利奈唑胺治疗前后实验室指标变化
53例患儿利奈唑胺治疗前后实验室指标变化
| 时间 | WBC(×109/L) | CRP(mg/L) | PLT( ±s,×109/L) ±s,×109/L) | ALT(IU/L) | BUN( ±s,mmol/L) ±s,mmol/L) | Cr( ±s,μmol/L) ±s,μmol/L) |
|---|---|---|---|---|---|---|
| 治疗前 | 13.74(9.0,20.63) | 57.0(24.0,109.5) | 361.4±227.9 | 22.0(15.0,43.5) | 4.01±2.04 | 37.04±8.35 |
| 治疗3 d | 10.8(7.90,13.56) | 12.0(8.0,38.0) | 476.7±266.9 | 23.0(15.0,43.0) | 3.72±1.34 | 38.2±8.3 |
| 疗程结束 | 7.87(6.09,9.83) | 8.0(8.0,8.0) | 376.9±199.9 | 20.0(13.0,37.5) | 3.64±1.38 | 38.0±8.75 |
| F值 | - | - | 3.815 | - | 0.786 | 0.305 |
| P值 | 0.000 | 0.000 | 0.024 | 0.611 | 0.457 | 0.738 |
注:PLT、BUN及Cr符合正态性分布,采用方差检验;WBC、CRP及ALT为非正态分布数据,故采用秩和检验。
本组患儿应用利奈唑胺前共检出革兰阳性菌24株,其中肺炎链球菌11株,金黄色葡萄球菌9株[其中4例为耐甲氧西林金黄色葡萄球菌(MRSA)],木糖葡萄球菌1株,溶血性葡萄球菌1株,屎肠球菌1株,路邓葡萄球菌1株。药敏结果对利奈唑胺均敏感。其他病例中检出支原体3例,铜绿假单胞菌3株,不动杆菌3株,余20例培养阴性。不同部位及标本的细菌学检查结果见表3。
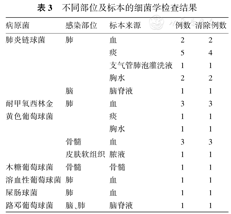
不同部位及标本的细菌学检查结果
不同部位及标本的细菌学检查结果
| 病原菌 | 感染部位 | 标本来源 | 例数 | 清除例数 |
|---|---|---|---|---|
| 肺炎链球菌 | 肺 | 血 | 2 | 2 |
| 痰 | 5 | 4 | ||
| 支气管肺泡灌洗液 | 1 | 1 | ||
| 胸水 | 2 | 2 | ||
| 脑 | 脑脊液 | 1 | 1 | |
| 耐甲氧西林金 | 肺 | 血 | 3 | 3 |
| 黄色葡萄球菌 | 痰 | 1 | 1 | |
| 胸水 | 1 | 1 | ||
| 骨髓 | 血 | 3 | 3 | |
| 皮肤软组织 | 脓液 | 1 | 1 | |
| 木糖葡萄球菌 | 骨髓 | 骨髓 | 1 | 1 |
| 溶血性葡萄球菌 | 肺 | 血 | 1 | 1 |
| 屎肠球菌 | 肺 | 血 | 1 | 1 |
| 路邓葡萄球菌 | 脑、肺 | 脑脊液 | 1 | 1 |
本组利奈唑胺治疗后,痊愈40例(75.4%),显效7例(13.2%),进步自动出院3例(5.6%),无效3例(5.6%)。临床有效率88.6%(47/53)。总体细菌清除率95.8%。
共5例出现药物不良反应,发生率9.4%(5/53)。其中轻度呕吐、腹泻2例,皮疹1例,经对症处理后好转;53例患儿中,33例疗程超过2周,用药期间监测血常规发现PLT下降1例,中性粒细胞减少1例,2例均发生在用药7 d后,停药后逐渐好转。用药期间每周监测血生化,未发现肝、肾功能损害。
革兰阳性球菌是社区和院内感染的重要病原菌,近年来随着抗生素的广泛应用,细菌耐药情况日趋严重。MRSA、耐万古霉素肠球菌、耐青霉素肺炎链球菌临床检出率逐年升高,并有耐药细菌向社区蔓延趋势。自1999年美国CDC报告明尼苏达州和北达科他州农村4例儿童死于MRSA感染,目前MRSA正以惊人的速度向院外蔓延[2]。耐药革兰阳性球菌感染已给临床抗菌药物的选择带来严峻的挑战。糖肽类药物万古霉素一直作为治疗MRSA感染的首选药物,但近年来,万古霉素在治疗葡萄球菌,特别是MRSA感染时出现部分临床失败病例,同时药物敏感监测显示,尽管万古霉素对MRSA仍在敏感范围内,但其最小抑菌浓度(MIC)逐年上升,形成所谓"MIC漂移"现象。2002年,美国CDC先后报道了2例耐万古霉素金黄色葡萄球菌(VRSA)感染病例[3,4],VRSA的出现使寻找万古霉素的替代抗生素变得刻不容缓。利奈唑胺为一类新型化学合成抗菌药,其作用机制为抑制细菌蛋白质合成,通过与细菌核糖体的50S亚基结合,抑制70S初始复合物的形成,作用于细菌蛋白质合成的起始阶段,最终产生抑菌作用[5]。其体外活性试验结果显示利奈唑胺对甲氧西林敏感和耐药葡萄球菌、万古霉素敏感和耐药的肠球菌、青霉素敏感和耐药的肺炎链球菌均显示良好的抗菌活性[6]。临床主要用于治疗耐药革兰阳性球菌感染引起的肺炎、皮肤软组织感染、脑膜炎、心内膜炎、菌血症、骨髓炎等。但近几年,多个国家尤其是欧洲国家利奈唑胺耐药的葡萄球菌迅速增多,日本和韩国也出现了耐药株[7,8,9],迄今为止尚未见国内有利奈唑胺耐药葡萄球菌的报道。还应该警惕今后可能出现的耐利奈唑胺的金黄色葡萄球菌和肠球菌,一旦发现需立即采取有效的隔离措施,防止耐药菌的播散和院内感染的流行。
本组53例患儿中,39例为肺部感染,病原菌以肺炎链球菌、金黄色葡萄球菌为主,其中27例用利奈唑胺前曾应用万古霉素,因疗效不满意或过敏等不良反应换药。Kollef等[10]研究显示,利奈唑胺与万古霉素相比,治疗医院获得性肺炎(包括呼吸机相关性肺炎)患者的生存率和临床治愈率均好于后者。主要因为利奈唑胺在肺组织内的渗透性好于万古霉素,能够达到有效的治疗浓度。有研究表明万古霉素较利奈唑胺在肺组织中浓度低,上皮细胞液内浓度未超过血浆浓度的20%,以标准剂量的万古霉素治疗,仍有40%的患者血药浓度达不到有效浓度[11]。而利奈唑胺与白蛋白结合力低,组织穿透性强,对肺部组织穿透性达100%,故利奈唑胺在肺组织中的药物浓度远远高于万古霉素。但这并不意味着所有革兰阳性菌引起的肺部感染都选用该药治疗。一些学者推荐,当万古霉素MIC≤0.5 mg/ml时可用其治疗MRSA肺炎。当MIC≥1.0 mg/ml,且原有肾功能衰竭或同时需要肾脏支持治疗时,建议应用利奈唑胺治疗[12,13]。除肺组织外,利奈唑胺在皮肤软组织、肌肉、脂肪组织、骨、脑脊液中也能达到足够大的浓度[14,15]。本组包括4例骨髓炎、7例化脓性脑膜炎患儿。4例骨髓炎患儿中有3例曾应用万古霉素、替考拉宁治疗3~5 d,因效果不明显而换用利奈唑胺,换药后1~3 d体温均有下降,炎性指标好转。另外1例患儿因万古霉素引起听力损害而换用利奈唑胺治疗。4例患儿应用利奈唑胺治疗后均好转出院。因儿童化脓性脑膜炎危害性大,发病急,进展快,预后差,7例化脓性脑膜炎患儿中有4例初始即根据临床经验应用利奈唑胺治疗,另外3例应用利奈唑胺前均应用过万古霉素,因病情危重,不能等待而换用利奈唑胺,用药1~5 d内体温均有下降,病情好转。提示因利奈唑胺组织穿透能力强,在骨、脑脊液中也能达到足够大的浓度,对治疗儿童革兰阳性球菌所致的脑膜炎及骨髓炎疗效较好。
Bishop等[16]研究发现,利奈唑胺的不良反应发生率达到64%(28/44),其中PLT减少13例,贫血7例,胃肠道反应12例,周围神经病变1例,血清素综合征1例;因不良反应中途停药比例为1.4%。而本组观察53例患儿中,31例用药时间超过2周,最长用药时间43 d,仅1例发生轻度PLT减低,1例发生中性粒细胞减少,停药并对症处理后很快恢复正常。并且也有4例因脓毒症致PLT减少,患儿经过利奈唑胺治疗后,随感染控制PLT逐渐恢复正常。本组观察用药前后肝、肾功能无明显变化,且停药后不良反应可恢复,安全性较高,不用为维持最佳的血药浓度和防止药物毒性而持续监测血药浓度。有研究显示利奈唑胺剂量调整与肾功能损害无关,在已知肾功能不全的患者中亦可应用[17]。但近两年也有报道:肾功能不全的患者应用利奈唑胺后,血药浓度明显高于肾功能正常患者,更易发生骨髓抑制(尤其是血小板减少症)[18,19]。故建议长期应用应监测血常规。
综上所述,通过对53例儿童重症感染性疾病临床资料分析发现,利奈唑胺治疗儿童耐药革兰阳性球菌感染临床疗效好,细菌清除率高,组织穿透性强,对于儿童耐受性好,安全性高。在万古霉素疗效欠佳或发生不良反应时可推荐使用。



























