
观察并比较B型脑钠肽(B type brain natriuretic peptide,BNP )、N端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)对新生儿窒息后发生心力衰竭的辅助诊断价值,优化早期临床诊断。
回顾性分析2013年1月至2015年10月我院收治的124例出生后窒息新生儿的临床资料,根据有无心力衰竭分为心衰组53例和对照组71例,48 h内股静脉穿刺采血检测并比较,将存在差异的指标进行Logistic回归分析,计算BNP、NT-proBNP与窒息患儿左室射血分数的相关性,通过受试者工作特征(ROC)曲线计算BNP、NT-proBNP对新生儿窒息后发生心力衰竭的诊断效能。
心衰组患儿BNP[(835.8±154.7) pg/ml vs. (235.4±38.5) pg/ml]、NT-proBNP(25 903.8 pg/ml vs. 6 974.5 pg/ml)、心肌肌钙蛋白T[(0.21±0.06) ng/ml vs. (0.11±0.03) ng/ml]、CK-MB[(61.3±11.7) U/L vs. (40.8±9.5) U/L]均显著高于对照组 (P<0.05);Logistic回归分析提示BNP、NT-proBNP与窒息新生儿发生心力衰竭密切相关(ORBNP=3.013,P<0.001;ORNT-proBNP=3.808,P=0.006);BNP、NT-proBNP与左室射血分数呈明显负相关(rBNP=-0.650,P=0.007;rNT-proBNP= -0.721,P<0.001)。ROC曲线提示BNP、NT-proBNP对新生儿窒息后发生心力衰竭的诊断效能分别为0.868、0.911,截断值分别取268.8 pg/ml、3 972.3 pg/ml时诊断一致性最高。
血浆BNP与NT-proBNP均是反映新生儿窒息后发生心力衰竭的高效特异性指标,对新生儿心力衰竭具有辅助诊断价值,相比较而言NT-proBNP的早期诊断意义更高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新生儿窒息是儿科常见病,窒息可引起全身性缺氧缺血,造成心肌及多器官受损,严重窒息患儿可发生心力衰竭(心衰),国内报道新生儿窒息时心肌损害发生率为40%~73.3%,心衰发生率达33.3%[1]。新生儿心衰的早期临床症状并不典型,无明显的阳性体征,早期诊断困难,但病情发展迅速,若未得到及时救治,将会大大增加窒息患儿病死率。因此,寻求客观反映心肌损害与心功能的高效临床指标一直是儿科临床医师努力的方向。B型脑钠肽(B type brain natriuretic peptide,BNP )和N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)是反映心功能的特异性标志物,目前已广泛应用于成年人心衰的辅助诊断,但对小儿心衰尤其是新生儿窒息引发的心衰的早期辅助诊断价值报道较少[2],临床一直多沿用心肌肌钙蛋白(cardiac troponin,cTn)、心肌酶谱等指标对窒息新生儿心肌受损的程度做出判断[3]。本研究通过回顾性分析探讨并比较BNP、NT-proBNP在新生儿窒息后发生心衰的诊断价值,报道如下。
回顾性分析2013年1月至2015年10月在本院治疗的出生后窒息的124例新生儿的临床资料。新生儿纳入标准:出生后1 min Apgar评分0~7分、5 min Apgar评分<7分、脐动脉血pH<7,出生后有窒息史,出生后48 h内BNP、NT-proBNP、CK-MB、cTnT数据完整,治疗方案经家长知情同意。排除标准:合并有严重先天心脏畸形、新生儿败血症、原发性肝肾功能障碍、水电解质平衡紊乱、极低出生体重儿、颅内出血患儿。
124例窒息新生儿,其中男67例,女57例;早产儿68例,平均胎龄 (33.5±2.0)周,足月儿56例;经阴道分娩60例,剖宫产64例;发生心衰53例(心衰组),未发生心衰71例(对照组),心衰患儿与未发生心衰患儿的基础临床特征比较见表1。另选择50例健康新生儿为正常对照组,其中男28例,女22例,平均胎龄 (38.2±2.4)周。
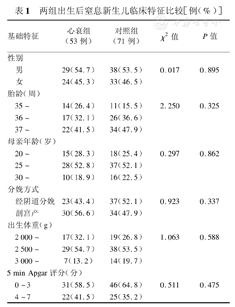
两组出生后窒息新生儿临床特征比较[例(%)]
两组出生后窒息新生儿临床特征比较[例(%)]
| 基础特征 | 心衰组(53例) | 对照组(71例) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 29(54.7) | 38(53.5) | 0.017 | 0.895 | |
| 女 | 24(45.3) | 33(46.5) | |||
| 胎龄(周) | |||||
| 35~ | 14(26.4) | 11(15.5) | 2.250 | 0.325 | |
| 36~ | 17(32.1) | 26(36.6) | |||
| 37~ | 22(41.5) | 34(47.9) | |||
| 母亲年龄(岁) | |||||
| 20~ | 15(28.3) | 18(25.4) | 0.297 | 0.862 | |
| 25~ | 28(52.8) | 37(52.1) | |||
| 30~ | 10(18.9) | 16(22.5) | |||
| 分娩方式 | |||||
| 经阴道分娩 | 23(43.4) | 37(52.1) | 0.923 | 0.337 | |
| 剖宫产 | 30(56.6) | 34(47.9) | |||
| 出生体重(g) | |||||
| 2 000~ | 17(32.1) | 19(26.8) | 1.063 | 0.588 | |
| 2 500~ | 29(54.7) | 38(53.5) | |||
| 3 000~ | 7(13.2) | 14(19.7) | |||
| 5 min Apgar评分(分) | |||||
| 0~3 | 31(58.5) | 46(64.8) | 0.511 | 0.475 | |
| 4~7 | 22(41.5) | 25(35.2) | |||
所有患儿出生24 h内均行彩色多普勒超声心动图检查,明确是否存在心脏解剖畸形,记录左室射血分数(left ventricular ejection fraction,LVEF),LVEF<0.55判定为异常。新生儿心衰诊断依据文献[4]与第4版《实用新生儿学》[5]心衰诊断标准:(1)有可能引起心衰的病因。(2)提示心衰:①心率>160次/min或<120次/min;②呼吸频率>60次/min;③超声心动显示心脏扩大;④肺淤血伴肺底部湿啰音。(3)确定心衰:①肝大≥2 cm;②奔马律;③明显肺水肿。具备上述(2)中的4条+(3)中的1条或(2)中的2条+(3)中的2条或(1)+(2)中的3条+(3)中1条即可诊断。
比较心衰组、对照组患儿及正常对照组新生儿出生48 h内的BNP、NT-proBNP、心肌酶等实验室指标,对组间差异显著的上述变量进行Logistic回归分析,探讨BNP、NT-proBNP是否是窒息后发生心衰的危险因素,并将BNP、NT-proBNP与LVEF进行相关性分析,采用受试者工作特征(receiver operating characteristic curve,ROC)曲线评价BNP、NT-proBNP对新生儿窒息后发生心衰的诊断效能。
本研究涉及的窒息患儿与正常新生儿采血前均获得儿童家属知情同意。所有患儿均于出生后48 h内经股静脉穿刺采血4 ml,置于含有抑肽酶和乙二胺四乙酸抗凝剂的预冷试管中,3 000 r/min低温离心10 min,离心半径10 cm,吸取血浆,置于-80 ℃冰箱冻存待检。采用美国雅培ASYM全自动酶联免疫分析及配套试剂盒(ELISA法)测定血浆BNP及NT-proBNP浓度。采用罗氏E170全自动免疫分析仪及配套试剂盒(电化学发光法) 测定心肌肌钙蛋白T(cTnT)浓度,采用日立7600全自动生化分析仪及配套试剂盒(免疫抑制法)测定肌酸激酶同工酶 (CK-MB)浓度。
采用SPSS 19.0软件进行统计学分析。符合正态分布的计量数据用均数±标准差( ±s)表示,三组间比较采用方差分析,两组间比较采用t检验,不符合正态分布的计量数据用中位数M(P25,P75)表示,三组间比较采用Kruskal-Wallis H秩和检验(χ2统计量),两组间比较采用Mann-Whitney U秩和检验(Z统计量);组间计数资料比较采用χ2检验;采用二分类(心衰=1,无心衰=0)非条件Logistic回归模型探求心衰的独立危险因素,采用逐步回归法进行变量筛选,纳入水准、剔除水准分别取双侧0.10、0.15;采用皮尔逊相关系数计算关联性;采用ROC曲线分析实验室指标对窒息新生儿发生心衰的诊断效能及诊断敏感度及特异度。
±s)表示,三组间比较采用方差分析,两组间比较采用t检验,不符合正态分布的计量数据用中位数M(P25,P75)表示,三组间比较采用Kruskal-Wallis H秩和检验(χ2统计量),两组间比较采用Mann-Whitney U秩和检验(Z统计量);组间计数资料比较采用χ2检验;采用二分类(心衰=1,无心衰=0)非条件Logistic回归模型探求心衰的独立危险因素,采用逐步回归法进行变量筛选,纳入水准、剔除水准分别取双侧0.10、0.15;采用皮尔逊相关系数计算关联性;采用ROC曲线分析实验室指标对窒息新生儿发生心衰的诊断效能及诊断敏感度及特异度。
经检验BNP、cTnT、CK-MB数值符合正态分布,NT-proBNP属偏态分布;新生儿出生48 h内BNP、NT-proBNP、cTnT、CK-MB组间差异有统计学意义(P<0.05),心衰组上述指标数值高于对照组和正常对照组;心衰组与对照组比较差异亦均有统计学意义(t/Z值分别为:27.623、-6.752、11.138、10.442,P均<0.001),见表2。
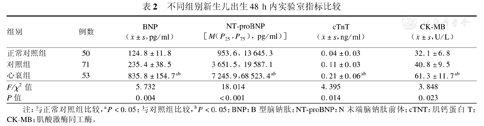
不同组别新生儿出生48 h内实验室指标比较
不同组别新生儿出生48 h内实验室指标比较
| 组别 | 例数 | BNP( ±s,pg/ml) ±s,pg/ml) | NT-proBNP[M(P25,P75), pg/ml)] | cTnT( ±s,ng/ml) ±s,ng/ml) | CK-MB( ±s,U/L) ±s,U/L) |
|---|---|---|---|---|---|
| 正常对照组 | 50 | 124.8±11.8 | 953.6, 13 645.3 | 0.04±0.03 | 32.1±6.8 |
| 对照组 | 71 | 235.4±38.5 | 3 651.5, 19 587.1 | 0.11±0.03 | 40.8±9.5 |
| 心衰组 | 53 | 835.8±154.7ab | 7 245.9,68 523.4ab | 0.21±0.06ab | 61.3±11.7ab |
| F/χ2值 | 5.732 | 18.014 | 4.395 | 3.848 | |
| P值 | 0.004 | <0.001 | 0.014 | 0.023 |
注:与正常对照组比较,aP<0.05;与对照组比较,bP<0.05;BNP:B型脑钠肽;NT-proBNP:N末端脑钠肽前体;cTNT:肌钙蛋白T;CK-MB:肌酸激酶同工酶。
将心衰组、对照组基础特征与实验室结果差异有统计学意义的变量纳入Logistic回归模型,结果提示BNP、NT-proBNP与窒息新生儿发生心衰密切相关,见表3。
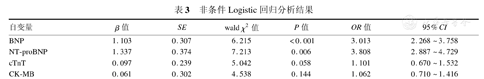
非条件Logistic回归分析结果
非条件Logistic回归分析结果
| 自变量 | β值 | SE | wald χ2值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| BNP | 1.103 | 0.307 | 6.215 | <0.001 | 3.013 | 2.268~3.758 |
| NT-proBNP | 1.337 | 0.374 | 7.213 | 0.006 | 3.808 | 2.887~4.729 |
| cTnT | 0.097 | 0.239 | 5.042 | 0.058 | 1.101 | 0.670~1.532 |
| CK-MB | 0.061 | 0.302 | 4.538 | 0.144 | 1.062 | 0.710~1.416 |
将窒息新生儿BNP、NT-proBNP与LVEF进行线性相关分析,结果表明二者均与LVEF呈明显负相关(rBNP=-0.650,P=0.007;rNT-proBNP= -0.721,P<0.001)。
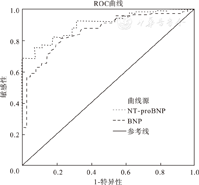
ROC曲线表明BNP、NT-proBNP对新生儿窒息后发生心衰的诊断效能分别为0.868、0.911,见表4、图1。当BNP截断值为268.8 pg/ml时,诊断敏感度为90.2%,特异度为87.5%;当NT-proBNP截断值为3 972.3 pg/ml时,诊断敏感度为92.4%、特异度为90.8%。
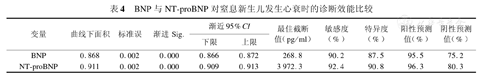
BNP与NT-proBNP对窒息新生儿发生心衰时的诊断效能比较
BNP与NT-proBNP对窒息新生儿发生心衰时的诊断效能比较
| 变量 | 曲线下面积 | 标准误 | 渐进Sig. | 渐近95%CI | 最佳截断 值(pg/ml) | 敏感度 (%) | 特异度 (%) | 阳性预测 值(%) | 阴性预测 值(%) | |
|---|---|---|---|---|---|---|---|---|---|---|
| 下限 | 上限 | |||||||||
| BNP | 0.868 | 0.002 | 0.000 | 0.866 | 0.872 | 268.8 | 90.2 | 87.5 | 95.5 | 75.2 |
| NT-proBNP | 0.911 | 0.002 | 0.000 | 0.909 | 0.913 | 3 972.3 | 92.4 | 90.8 | 96.3 | 80.3 |

新生儿窒息是胎儿出生后最常见的紧急情况。首先,窒息引起的全身性低氧血症、酸中毒易导致心脏能量代谢障碍,心肌收缩力减弱、输出量下降,心脏血流灌注减少;其次,能量代谢发生障碍导致心肌细胞膜钙泵衰竭,Ca2+内流,胞质内H+浓度增高与Ca2+竞争结合肌钙蛋白,破坏兴奋收缩耦联机制,心功能受严重影响;再次,缺血缺氧导致氧自由基与血管内皮素生成增加,缺血缺氧基础上血流恢复可导致心肌再灌注损伤,加重心肌损害;新生儿窒息后上述因素共同促进了心衰或心源性休克的发生。
目前对新生儿心衰的临床诊断主要依据临床表现与影像学检查[6],心肌损害发生早期患儿可无特异性临床症状,即便到了心衰期,受原发病的影响,早期诊断亦较为困难,且与呼吸困难/窘迫难以鉴别。伴随病情进展,心肌酶谱、肌钙蛋白检测可提示心衰的发生,血清cTnT是反映心肌损伤的特异性标志物,可于心肌损伤后3~6 h迅速升高,24 h达高峰,10~14 d后下降至正常,正常范围为0~0.14 μg/L[1],但cTnT水平的升高多反映的是心肌细胞的不可逆损伤,如急性心肌梗死等,新生儿窒息早期多为一过性的心肌缺氧缺血,心肌细胞坏死程度较轻,故cTnT对早期诊断新生儿窒息后心衰的敏感性相对较低[3]。CK-MB是诊断心肌受损的经典指标,于心肌损伤后3~5 h升高,16~20 h达峰值,2~3 d恢复正常,正常范围为0~39 U/L[1],但正常新生儿心肌酶水平在出生时较高,72 h后才明显下降,因此临床多在出生72 h采血查心肌酶以减少假阳性率。考虑到目前仍没有统一的新生儿心衰的诊断标准,因此进一步探求客观、高效的早期心肌损伤的生物学标志物对尽早发现并正确诊断该病具有重要临床意义。
脑利钠肽家族是多肽类心脏神经激素,参与血压、血容量以及水盐平衡的调节,是人体用来抵御容量负荷过度及高血压的主要内分泌系统。其中,BNP是一种主要由心室、心房肌细胞分泌的由32个氨基酸组成的多肽神经激素,具有利尿、排钠及拮抗肾素-血管紧张素-醛固酮系统的缩血管作用。正常人血液中仅有低浓度BNP,心衰时心室负荷增加,心室壁张力增大,心室肌细胞BNP代偿性分泌增加,发挥扩张动脉、利尿、利钠功效[7]。心衰时心室肌细胞同时产生一种BNP前体(preproBNP),preproBNP在蛋白水解酶的作用下裂解成为有生物学活性的BNP与无活性的含76个氨基酸的NT-proBNP,与BNP相比,NT-proBNP出现更早、半衰期更长(120 min vs. 22 min)、更加稳定(体外实验降解时间72 h vs. 4 h)、血浆浓度更高,更适于实验室检测[8]。对于成人心衰的研究证实,BNP、NT-proBNP均是临床诊断的可靠标志物[9]。ROC分析显示NT-proBNP对成年人慢性心衰的诊断效能优于BNP[0.956(95%CI 0.932~0.980)vs.0.906(95%CI 0.865~0.946)][10],提示NT-proBNP对心衰的诊断效力相对于BNP可能更为敏感。有研究表明改良ROSS评分、NT-proBNP、BNP、小儿慢性心衰严重程度评分 (New York university pediatric heart failure index,NYU PHFI)对先天性心脏病引起小儿心衰的诊断效力分别为0.985(95%CI 0.950~1.021)、0.981(95%CI 0.962~1.000)、0.880(95%CI 0.818~0.943)、0.964(95%CI 0.934~0.994)[11]。国外报道,BNP、NT-proBNP二者数值均伴随心功能分级严重程度的增加而上升,且NT-proBNP对3岁以下儿童充血性心衰的诊断效能优于BNP[12]。本研究结果显示,新生儿出生48 h内心衰组BNP、NT-proBNP与cTnT、CK-MB变化有一致趋势,BNP、proBNP数值与LVEF均呈显著负相关,Logistic回归显示BNP、NT-proBNP均与新生儿窒息后心衰的发生密切相关,且关联程度高于cTnT与CK-MB,说明BNP、proBNP同样适用于新生儿窒息后心衰的辅助诊断,且早期诊断价值优于cTnT与CK-MB。
笔者对比了BNP、NT-proBNP对新生儿窒息后发生心衰的辅助诊断效能,结果显示NT-proBNP的诊断效能高于BNP,这可能与NT-proBNP分子量大、无生物学活性、体外稳定性更高有关,与LVEF的相关性分析也进一步佐证了这一点。Lin等[13]通过ROC曲线分析得出结论:NT-proBNP诊断小儿心衰的效能高达0.979 (95%CI 0.948~0.994),当截断值 ≥598 pg/ml,结合改良ROSS评分≥4时,诊断效率最高。结合上述论断,笔者认为血浆NT-proBNP检测是辅助诊断新生儿窒息后发生心衰的良好生物学标志物。ROC分析表明当NT-proBNP截断值为3 972.3 pg/ml时,诊断效能最高,研究中发现窒息患儿NT-proBNP离散度较大,该截断值与成年人心衰辅助诊断的截断值差距较大,这可能与新生儿出生后NT-proBNP一过性升高有关。有报道,新生儿出生72 h内NT-proBNP即明显升高,新生儿脐带血NT-proBNP的平均水平约为母体水平的12倍,而出生后1 d数值又是出生时的3倍[14]。
综上所述,BNP、NT-proBNP在新生儿窒息后心肌损伤评估方面均有较高的辅助诊断价值,对二者进行检测可尽早发现心肌损害,降低新生儿病死率,相比而言,NT-proBNP对新生儿窒息后发生心衰的辅助诊断效能更高。但由于本研究涉及样本量过少,NT-proBNP分布较离散,为此,有待通过大样本数据进一步寻求较为客观的诊断截断值。



























