
分析神经性厌食合并重度营养不良的临床特征、治疗和预后并进行文献复习。
对2016年11月在我院确诊的1例神经性厌食合并重度营养不良患儿的临床表现、实验室检查、治疗和转归等临床资料进行总结分析。以"anorexia nervosa"和"severe malnutrition"为关键词,在Web of Science、Pubmed等数据库中检索1990年1月至2017年5月以来的相关文献,系统性复习神经性厌食合并重度营养不良的临床表现、检查结果及预后。
患儿女,11岁,因"纳差、进行性消瘦3个月,加重4 d"入院,3个月中体重从40 kg下降至入院前22.5 kg。住院期间最低体重21.5 kg,身高157 cm,BMI 8.7 kg/m2;入院时呈全身恶病质,伴多器官功能损害:心肌受损、肝功能不良、骨髓抑制、血管性紫癜、甲状腺功能减退和电解质紊乱。患儿接受肠外营养逐渐过渡到经鼻肠管行肠内营养,联合抗精神病药物、生长激素、甲状腺素、促红细胞生成素等多系统支持治疗,住院65 d,出院时已恢复自主进食,体重增至27 kg,出院后4个月随访体重40 kg,BMI 16.2 kg/m2,且一般情况良好,开始恢复上学。
神经性厌食合并重度营养不良病死率极高,最佳的肠内外营养摄入联合抗精神药物、多种促生长激素和家庭情感支持是提高救治成功率和减少复发的关键。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经性厌食是青少年常见的精神疾病之一,以厌食和体重下降为主要表现,可导致不同程度的营养不良及各种机体并发症,但大多数并发症随着营养摄入、体重回升而缓解,而神经性厌食合并重度营养不良临床上极为罕见,常常合并多脏器功能受损,病死率高,早诊断早治疗是保证其长期完全康复的关键[1]。然而,国内对于神经性厌食合并重度营养不良患儿治疗过程中营养康复治疗尚缺乏足够的经验。
患儿,女,11岁,因"纳差、进行性消瘦3个月,加重4 d"入院,患儿3个月前因保持体形而节食,体重从40 kg下降至入院前22.5 kg,身高157 cm,BMI 9.1 kg/m2。入院时呈全身恶病质,伴多器官功能损害:心肌受损、肝功能不良、骨髓抑制、血管性紫癜、甲状腺功能减退和电解质紊乱。入院后采取多系统综合治疗方案。
第1天采用经口低盐、低脂饮食;第2天患儿即拒食,故采用经鼻置入胃管,鼻饲喂养短肽型肠内营养制剂和静脉补液(未加脂肪乳)。第5天肠内营养未完全建立,患儿体重无增长(22.5 kg),故经外周静脉行中心静脉置管(PICC),并启用肠外营养[初始量:氨基酸1 g/(kg·d),脂肪乳1 g/(kg·d),葡萄糖2~3 g/(kg·d),肠外营养热卡约22 kcal/(kg·d)],并缓慢增加肠外营养热卡,第9天热卡增至约51 kcal/(kg·d)[氨基酸3 g/(kg·d),脂肪乳2.3 g/(kg·d),糖4.6 g/(kg·d)],但肠内营养仍不耐受,更改肠内营养制剂为低渗透压的深度水解配方奶,患儿体重下降至最低值21.5 kg,故继续增加肠外营养葡萄糖量至6.8 g/(kg·d),而后体重稍有增长。从第14天开始患儿反复出现消化道出血和胃潴留,肠内营养暂停,患儿体重再次降至最低值21.5 kg,随后脂肪乳和葡萄糖继续加量,肠外营养最大量约70 kcal/(kg·d)[氨基酸3 g/(kg·d),脂肪乳3 g/(kg·d),糖8.5 g/(kg·d)]。第22天患儿体重开始增长;第28天,患儿器官功能较前恢复,经鼻空肠置管行肠内营养,并逐渐增加肠内营养量,降低肠外营养量,肠内营养由24 h持续输注逐渐过渡至白天间断输注;肠内营养制剂由早期低渗透压深度水解奶过渡至短肽型肠内营养制剂以提供高热卡。第45天停用肠外营养;第51天拔出PICC;第59天患儿已完全能经口喂养,予拔出鼻肠管。第65天出院,出院时体重27 kg,BMI 11.0 kg/m2(住院期间体重变化和肠内外营养热量曲线如图1)。出院后随访1个月,体重31 kg并开始上学,出院后2个月时体重35 kg,BMI 14.2 kg/m2,4个月时体重40 kg,BMI 16.2 kg/m2。
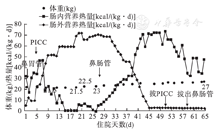

患儿入院当天精神以兴奋为主,第2天转为抑郁,无法对答;入院第10天,患儿生命体征稳定、肝功能损害恢复时开始口服盐酸氟西汀,起始量2.5 mg/d,逐渐加量至10 mg/d并持续至出院后2周;患儿于第14天精神抑郁逐渐好转,开始眼神交流、言语交流,后期可配合口服药物和肠内营养等治疗。
患儿入院后第1周合并肺炎、呼吸衰竭,给予无创呼吸机辅助通气支持、抗感染、雾化等治疗,肺炎恢复后停用抗生素。第50天,患儿出现发热,PICC、鼻肠管、血培养均培养出同种细菌,考虑为导管相关性感染可能,给予抗感染治疗后体温逐渐稳定,并先后拔出PICC和鼻肠管。住院期间,同时给予磷酸肌酸钠护心、阿拓莫兰护肝、补充电解质、多种维生素等对症支持治疗,以及神经节苷脂、二十二碳六烯酸(DHA)营养脑神经治疗。
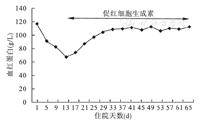
患儿住院前两周因脱水和反复消化道出血,血红蛋白水平持续下降至最低值68 g/L,考虑存在促红细胞生成素分泌不足,予肌注促红细胞生成素4 000 U/次,隔日1次,血红蛋白水平升至100 g/L时改为每周1次,同时每日口服铁元素40 mg/d(住院期间血红蛋白水变化如图2)。患儿入院后查甲状腺功能提示T3、T4、TSH均低下,考虑营养不良导致整体激素合成减少,予口服甲状腺素片替代治疗。入院第3周时,患儿体重未增长,并反复出现消化道出血,加用少量短效生长激素1.5 U/d(0.05~0.10 U/kg)促进蛋白质合成生长修复。

避开消化道出血期间,予口服益生菌调节肠道菌群、多潘立酮促胃动力等治疗。
治疗后期请康复科医师进行患儿肌肉功能恢复、躯体功能锻炼等康复治疗。
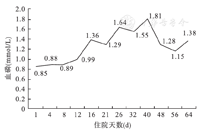
患儿住院治疗期间监测项目如下:血压每4~8小时1次(第1周每4小时1次)、心率、经皮氧饱和度、血气(前2周)、心电图(每周1次)、血糖(早期每12小时1次,稳定时每天1次至隔日1次)、血常规每周1次、生化(早期每周2次,稳定时每周1次)、甲状腺功能(每周1次至每2周1次),凝血功能(每周1次至每2周1次)。患儿住院期间血红蛋白和血磷变化如图2、图3。

分别以"神经性厌食"、"重度营养不良"和"鼻肠管"为关键词在中国知网、万方、维普等中文数据库检索建库至2017年5月的相关文献,仅检索到1篇神经性厌食合并重度营养不良患者(BMI 12.9 kg/m2)的病例报告[2]。以"anorexia nervosa"、"severe malnutrition"和"nasointestinal tube"等词为关键词,在Web of Science、Pubmed数据库中检索1990年1月至2017年5月以来文献,根据时效性和相关性提取近十年相关文献20余篇,系统性复习神经性厌食合并重度营养不良的临床表现、检查结果及预后。
营养康复治疗是神经性厌食合并重度营养不良患者住院治疗的第一步,有助于患者后续心理和精神康复治疗,是决定能否完全康复的关键[3,4]。目前国外对于神经性厌食所致营养不良患儿的营养治疗指南推荐从低热卡开始摄入然后逐渐加量,以避免再喂养综合征的发生:建议开始热量按10~40 kcal/(kg·d),或者按每天需要热量的20%~80%给予,强调缓慢增加每天摄入热量[5,6]。
再喂养综合征是机体在长期饥饿或营养不良的情况下,重新摄入营养物质后的初始2周内,出现以电解质紊乱(低磷、低钾和低镁血症)、维生素缺乏和水钠潴留为特征的一系列症状。再喂养综合征的病理机制被认为是喂养后葡萄糖进入肠道引起胰岛素分泌激增,并使葡萄糖、水和电解质迅速进入细胞内,从而导致调控细胞内环境的钠钾泵因缺乏磷酸腺苷提供泵能量而衰竭,最终出现严重电解质紊乱、低磷血症(<1.0 mmol/L)、心脏衰竭和死亡[7]。然而,O′Connor和Goldin[8]回顾文献发现,23例神经性厌食合并重度营养不良患儿尽管给以低热量[27 kcal/(kg·d)]起始的再喂养方案仍发生了再喂养综合征。同时,部分研究者发现早期给予重度营养不良患儿高热量摄入可以获得快速体重增长,缩短住院时间,且患儿耐受性良好,未出现再喂养综合征等不良反应[9,10,11,12]。以上说明,起始摄入热量并不是再喂养综合征的主要危险因素。Kraaijenbrink等[13]回顾了178例急诊入院的患者,将BMI<16 kg/m2、近3~6个月体重下降>15%或超过10 d未进食作为评价指标,满足一条则考虑为发生再喂养综合征的高危患者。在178例患者中,97例被认为存在高危因素,但最终仅14例患者发生再喂养综合征,说明再喂养综合征的发生存在多因素原因,与原发病、患者的基础营养状态和体内微环境关系密切,需要更多前瞻性研究寻找其他危险因素。
本例患儿住院期间最低BMI仅8.7 kg/m2,入院时呈全身恶病质,合并心肌损伤、肝功能不良、骨髓抑制、血管性紫癜、甲状腺功能减退和电解质紊乱等多脏器功能受损。根据指南推荐,该患儿以35~40 kcal/(kg·d)(约每日需要热量的60%)的总摄入量为起始,逐渐增加至80~90 kcal/(kg·d);患儿体重从住院3周后开始稳定增长,每周约增长1 kg,仅住院前12天合并低磷血症,未出现水钠潴留等不良反应,体重增长速率与英国神经性厌食治疗管理指南提出的体重增长目标(0.5~1.4 kg/周)一致[14]。但患儿住院前3周体重未增长,考虑与患儿机体持续自身消耗、早期肠内营养建立不佳和肠外增长缓慢有关;3周后肠外营养增至足量,患儿体重开始稳定增长。
重度营养不良的患儿在肠内营养在1周内不能有效建立或者体重增长欠佳时(小于400 g/周),可肠外营养补充[15]。在2010年中国儿科肠内肠外营养支持临床应用指南中,大于6岁儿童,肠外营养推荐摄入量中氨基酸1~2 g/(kg·d)、脂肪乳1~2 g/(kg·d)、葡萄糖<10 g/(kg·d)[16]。但在重度营养不良、自身极度消耗的患儿中,完全肠外营养下氨基酸和脂肪乳推荐摄入量是明显不够的。在本病例中氨基酸最大量至3 g/(kg·d)、脂肪乳最大量至3 g/(kg·d),定期检测血清生化结果示,肝功能和甘油三酯未见明显异常,体重增长理想,提示患儿代谢需求更高且耐受良好。因仅个例报道,所以需更多病例来证明较高剂量的氨基酸和脂肪乳的安全性。国外文献表明神经性厌食的青少年可以耐受极高肠内营养热量(2 400~3 000 kcal/d),且相对较安全[12],高热量肠外营养的安全性和不良反应暂无循证依据。
Rigaud等[17]对41例神经性厌食合并重度营养不良患者(BMI 8.8~10.9 kg/m2)的预后进行了回顾性分析,与同期443例合并轻度营养不良的患者相比,该41例患者随访6年,死亡2例(12%),29%出现严重并发症,41%痊愈,认为针对BMI<11 kg/m2的神经性厌食患者给予谨慎的管饲补充营养可以减少短期病死率,但是长期预后仍差。Kohn等[18]建议连续通过鼻胃管行再喂养可以减少低血糖(<3.0 mmol/L)的发生。本例患儿入院初期经给予鼻胃管行肠内营养,未出现低血糖,但因上消化道出血和胃排空延迟而影响肠内营养摄入,故后期改用经鼻空肠置管行肠内营养直至恢复自主饮食。目前,鼻肠管的应用非常广泛,置入和定位方法也比较成熟[19,20]。本例应用经鼻空肠管行肠内营养的意义在于避开易出血的上消化道和排空能力明显减弱的胃部。然而,因为重度营养不良的患儿肠道黏膜极为薄弱,鼻肠管置入的时机需要慎重考虑,早期行经鼻空肠置管存在较大概率的肠穿孔风险,故充分评估患儿使用经鼻空肠置管术的适应证和禁忌证极为重要。
在重度营养不良患儿中,由于腺体分泌功能极其低下致体内促生长激素不足,如甲状腺激素、生长激素和促红细胞生成素等,故在本例患者治疗过程中加用了上述激素,以促进体内生长代谢、蛋白质合成和红细胞生成,治疗使用后患者耐受性良好,总蛋白和血红蛋白明显回升,但今后仍需通过大样本病例的前瞻性研究优化上述治疗的最佳剂量和使用时机。
由于抗精神药物存在多系统不良反应,尤其涉及消化系统引起胃肠功能紊乱,故在神经性厌食合并重度营养不良患儿住院治疗的早期不建议使用,但精神康复治疗会有利于营养治疗的疗效。本例患儿在评估脏器功能良好时加用盐酸氟西汀口服,治疗后患儿从无交流逐渐恢复眼神交流、语言交流,精神症状好转为后续治疗和过渡至自主饮食奠定了基础。
神经性厌食是青少年中常见的精神疾病,尤其是女性患者,其发病涉及心理、家庭、社会等多重因素。治疗神经性厌食是一个复杂而长期的过程,对合并营养不良的患者尤其强调多学科联合治疗。尽管住院治疗完成了体重回升的第一步,但出院后家庭的和谐、社会的关爱却是决定这类患者减少复发、最终痊愈的关键。



























