
探讨中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)在小鼠溃疡性结肠炎模型中的表达及与肠道屏障功能损伤程度的相关性。
采用清洁级雄性Balb/c小鼠60只,随机分为正常组(n=30)和模型组(n=30)。通过葡聚糖硫酸钠建立溃疡性结肠炎模型,并于造模后1、3、5 d留取肠组织及血液样本(每个时间点10只)。通过观察小鼠疾病活动指数及常规病理学观察,反映肠组织损伤情况。采用PicoGreen®染料定量检测小鼠血浆游离DNA,免疫组织化学方法观察肠组织中NETs主要组成成分髓过氧化物酶和瓜氨酸化组蛋白的表达及定位,Western blot方法检测紧密连接蛋白(Claudin-1)的表达水平。
与正常组相比,造模后1、3、5 d结肠组织炎症活动指数DAI值均显著上升(P均<0.05)。血浆中游离DNA含量均显著升高(P均<0.05)。免疫组织化学检测可见模型组NETs形成增加,且随病情逐渐恢复,其含量呈逐渐下降的趋势。Western blot检测发现模型组Claudin-1表达下降(P均<0.05),且随病情逐渐恢复,其含量呈逐渐上升的趋势。
在溃疡性结肠炎小鼠模型中,NETs形成增加,且NETs的形成增加与肠屏障功能损伤相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)是一类病因尚不明确的胃肠道慢性非特异性炎症,包括克罗恩病(Crohn′s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)两种类型。临床主要表现为反复发作的腹痛、腹泻和黏液脓血便等,严重影响患者的生存质量[1]。研究表明,IBD的发生与各种原因引起的肠上皮屏障完整性破环导致细菌与环境相关抗原引发的免疫过表达密切相关。紧密连接(tight junctions)是构成肠道黏膜屏障上皮细胞的重要结构,可防止肠道有害物质侵入肠黏膜组织,维持肠上皮通透性和细胞极性。其由多种紧密连接蛋白组成,包括occludin、Claudin以及ZO-1等,在不同组织结构,各种紧密连接蛋白的表达亦存在差异。在IBD发病过程中,炎症细胞因子可通过影响紧密连接蛋白的表达,引起肠上皮通透性增加,使细菌和内毒素穿透黏膜进入循环,导致严重的炎症反应[2]。
在IBD炎性应答的早期阶段,中性粒细胞聚集于炎症黏膜,在其发病机制中具有不可代替的作用。最新研究发现,中性粒细胞受到刺激活化后会释放一种以DNA为骨架,其间装配有组蛋白、髓过氧化物酶(MPO)等的网状结构——中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)。其作为一种免疫监管行为,可通过诱捕作用防御病原体感染,但当机体不能严格地限制NETs的活性时,可引起组织损伤[3,4]。本研究旨在探讨NETs在小鼠急性结肠炎模型中的表达情况及与肠道屏障功能损伤的关系,以期为IBD的治疗提供新的理论和实验依据。
SPF级Balb/c小鼠60只,雄性,鼠龄6~8周,购自辽宁长生生物技术股份有限公司。动物伦理编号(2017PS286K)。
葡聚糖硫酸钠(MP Biomedicals公司);Quant-iTTM PicoGreen® dsDNA Reagent and Kits(Life Technology公司);Anti-Myeloperoxidase抗体(ab9535)、Anti-Histone H3(citrulline R2+R8+R17)抗体(ab5103)、Anti-Claudin 1抗体(ab15098)均购自Abcam公司;GAPDH抗体、HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)均购自Proteintech公司;PVDF膜(Millipore公司)。
60只小鼠随机分为对照组和模型组,模型组30只,对照组30只。将相对分子质量为50 000的葡聚糖硫酸钠溶于饮用水中,配成3%的水溶液,模型组小鼠自由饮用7 d建立UC模型[5],随后改为饮用正常水,分别于造模后1、3、5 d各处死10只,取结肠远端用4%多聚甲醛固定后,根据HE染色检测炎症细胞浸润、隐窝破坏及溃疡形成以证明溃疡性结肠炎模型制作成功,本实验造模全部成功。对照组自由饮用正常水,并分别于上述各时间点处死10只。
摘眼球取血,留取血浆,用于血浆游离DNA检测。实验动物(每组10只)给予5%水合氯醛腹腔麻醉,开腹取结肠组织,取一段结肠组织于4%多聚甲醛中固定,制成3.5 μm石蜡切片用于病理学及免疫组织化学检测;取另一段结肠组织置于Eppendorf管中,-80 ℃冻存,用于Western blot检测。
实验动物采用经典的动物实验中评价结肠炎的疾病活动度评分(disease activity index,DAI)评分方法[5],由体重丢失、大便性状、便血情况三部分构成;根据表1评定结肠炎的疾病活动指数。
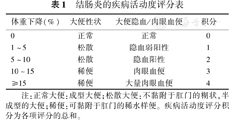
结肠炎的疾病活动度评分表
结肠炎的疾病活动度评分表
| 体重下降(%) | 大便性状 | 大便隐血/肉眼血便 | 积分 |
|---|---|---|---|
| 0 | 正常 | 正常 | 0 |
| 1~5 | 松散 | 隐血弱阳性 | 1 |
| 5~10 | 松散 | 隐血阳性 | 2 |
| 10~15 | 稀便 | 肉眼血便 | 3 |
| ≥15 | 稀便 | 大量肉眼血便 | 4 |
注:正常大便:成型大便;松散大便:不黏附于肛门的糊状,半成型的大便;稀便:可黏附于肛门的稀水样便。疾病活动度评分积分为各项评分的总和。
石蜡切片常规脱蜡,采用HE染色法,高倍光学显微镜下观察结肠远端黏膜损伤情况。
采用Quant-iT™ PicoGreen® dsDNA Reagent and Kits试剂盒检测血浆游离DNA含量。参考试剂盒说明书,血浆按50 μl/孔加入到遮光96孔板中,每孔再加入50 μl稀释的PicoGreen®进行荧光值测定,标准品稀释后终浓度依次为1 000、100、10和0 μg/L。用多功能酶标仪检测荧光强度。
肠组织石蜡切片经脱蜡脱水,热抗原修复,过氧化氢灭活内源性酶,山羊血清封闭,加一抗:Anti-Myeloperoxidase抗体(1∶100稀释)、Anti-Histone H3(citrulline R2+R8+R17)抗体(1∶200稀释),同时以PBS替代一抗作为阴性对照。4 ℃孵育过夜,孵育生物素羊抗兔IgG二抗20 min,滴加新鲜配制的DAB显色液,显微镜下观察,以棕黄色或棕褐色为阳性信号,终止显色,中性树脂封片。
取-80 ℃保存的肠组织,加适量裂解液后匀浆,BCA法测蛋白浓度后,各样品取40 μg总蛋白上样电泳,转入PVDF膜,用5%脱脂牛奶室温摇床封闭2 h,分别加入一抗:Anti-Claudin 1抗体(1∶100稀释)、GAPDH抗体(1∶6 000稀释),4 ℃摇床过夜。TBST洗膜,加入二抗(1∶6 000),室温孵育2 h,洗膜后用ECL化学发光试剂显影。以GAPDH作为内参,采用Image J软件检测各组条带的灰度,以Claudin-1与GAPDH的灰度比值为分析对象。
采用SPSS 18.0统计软件进行重复测量资料的方差分析。计量资料用均数±标准差( ±s)表示。组间比较采用t检验,P<0.05为差异具有统计学意义。
±s)表示。组间比较采用t检验,P<0.05为差异具有统计学意义。
模型组小鼠在造模后第1天,全部出现肉眼血便,1 d组平均DAI评分为11.00±1.22,明显高于其对照组0.38±0.48(P<0.05);造模后第3天,3只出现肉眼血便,4只大便潜血强阳性,3 d组平均DAI评分为8.88±1.76,明显高于其对照组0.13±0.33(P<0.05);造模后第5天,1只肉眼血便,3只大便松散,4只大便隐血弱阳性,5 d组平均DAI评分为6.50±2.40,明显高于其对照组0.13±0.35(P<0.05),见图1。
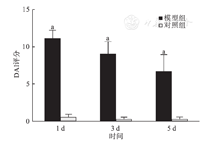

同一时间点模型组与对照组比较,aP<0.05。
在光学显微镜下观察各组小鼠结肠组织结构及细胞形态。1 d组结肠黏膜呈明显炎症反应,主要累及黏膜、黏膜下层,可见以中性粒细胞和淋巴细胞为主的大量炎性细胞浸润,上皮内杯状细胞减少,隐窝严重破坏,四周黏膜腺体排列不齐。3 d组、5 d组炎症细胞浸润逐渐减轻,水肿逐渐减轻,溃疡浅表轻微。对照组肠组织结构基本正常,细胞形态也未见明显异常,见图2。
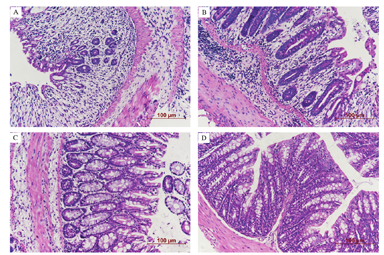

A:模型组第1天;B:模型组第2天;C:模型组第5天;D:对照组。
用PicoGreen®测定标准品和血浆中游离DNA含量,绘制标准曲线。标准曲线呈良好的直线关系,R2值为0.999 9。血浆中游离DNA含量:模型1 d组(716.83±134.29)明显高于其对照组(116.83±9.42)(P<0.05),3 d组(298.65±100.87)明显高于其对照组(94.36±23.88)(P<0.05),5 d组(148.14±15.16)明显高于其对照组(97.56±20.11)(P<0.05),见图3。
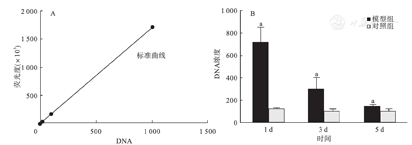

同一时间点模型组与对照组比较,aP<0.05。
免疫组织化学结果显示,小鼠正常结肠组织MPO的表达量很少(平均光密度值92.95±0.24),模型1 d组表达量最高,3 d组、5 d组MPO表达量逐渐下降(平均光密度值124.32±0.39、107.48±4.34、95.99±0.45)。见图4。
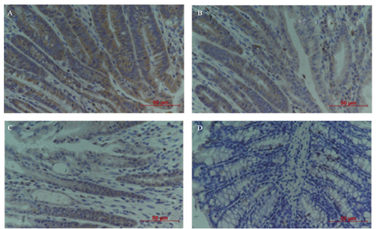

A:模型组第1天;B:模型组第2天;C:模型组第5天;D:对照组。
免疫组织化学结果显示,小鼠正常结肠组织的CitH3表达量很少(平均光密度值95.38±0.04),1 d组表达量最高,3 d组、5 d组CitH3表达量逐渐下降(平均光密度值121.16±0.71、109.92±3.31、99.43±0.95)。见图5。
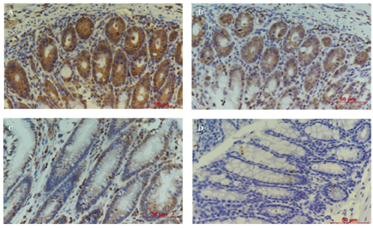

A:模型组第1天;B:模型组第2天;C:模型组第5天;D:对照组。
Western blot检测Claudin-1的表达结果显示,Claudin-1的表达量:1 d组(0.48±0.24)明显低于其对照组(1.42±0.79)(P<0.05);3 d组(0.67±0.18)明显低于其对照组(1.13±0.24)(P<0.05);5 d组(0.89±0.29)明显低于其对照组(1.15±0.29)(P<0.05)。对照组、模型组Claudin-1的Western blot检测结果及其与GAPDH的积分灰度值比值见图6、图7。
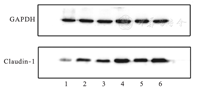

1、2、3、4、5、6分别代表1 d模型组、3 d模型组、5 d模型组、1 d对照组、3 d对照组、5 d对照组。
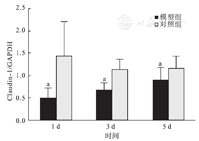

同一时间点模型组与对照组比较,aP<0.05。
IBD是免疫介导的胃肠道慢性炎症性疾病。研究表明,青少年时期发病者约占25%~30%,且儿童IBD的发病率呈逐年升高趋势[6]。上海一项近10年IBD患者的统计发现,IBD的发病率从2001年的0.5/100万上升至2010年的6.0/100万[7],且年龄越小,病情越重。IBD具有慢性迁延、反复发作的临床特点,缺乏早期监控手段和有效的防治措施将严重影响患者的生长发育和生活质量。
目前认为IBD的发病机制是由环境、遗传、免疫介导和肠道微生物因子等多因素交互作用[8]。尽管IBD的发病机制目前仍未明确,但IBD动物模型和IBD患者的相关研究均表明一个共同的病理转归:肠黏膜屏障结构和功能的损伤[9]。肠黏膜屏障对防御外来抗原物质对机体的侵袭和维持机体内环境稳定至关重要。研究发现,肠上皮紧密连接屏障的破坏可触发黏膜免疫系统引发炎症,目前已证实IBD患者肠紧密连接屏障破坏增加,可导致IBD进展[10]。Claudins作为紧密连接最重要的组成部分,其表达发生改变可使肠上皮屏障完整性破坏、肠上皮渗透性增加及极性消失,从而引发多种胃肠疾病[11]。
最新研究发现,中性粒细胞还可通过形成NETs来发挥杀菌作用。NETs是中性粒细胞受到刺激活化后释放到胞外的一种以DNA为骨架,其间装配有组蛋白、MPO、中性粒细胞弹性蛋白酶、组织蛋白酶G、钙网蛋白等的网状结构。经活化刺激后的中性粒细胞可在肽酰基精氨酸脱亚氨酶催化作用下,使组蛋白脱亚胺基转变成瓜氨酸化组蛋白,其中组蛋白H3的高瓜氨酸化在染色质去浓缩过程中发挥重要作用[12,13,14],通过抑制肽酰基精氨酸脱亚氨酶4可防止组蛋白H3的瓜氨酸化及NETs的形成[14]。当染色质解旋后,导致胞核形态改变,引发核膜破裂,随后染色质与胞浆内的颗粒内容物相接触,组成NETs的各组分相混合,最终导致胞膜破裂,排至胞外形成网状结构,此时中性粒细胞死亡。故将这种不同于细胞凋亡和坏死的细胞死亡形式称为NETosis[13]。NETs本身就是一种免疫监管行为,可通过诱捕作用防御病原体感染,是人体重要的先天免疫应答机制。但当机体不能严格地限制NETs的活性时,可引起广泛的血管病变和炎症激活。目前已于肺炎链球菌感染的小鼠肺泡、化脓性链球菌所致坏死性筋膜炎小鼠皮肤等感染病灶处检出NETs[15]。因此,推测NETs在IBD肠组织损伤机制中也起到一定的作用。
本研究采用经典的葡聚糖硫酸钠诱导的UC动物模型[16],6~8周小鼠处于性成熟前期,相当于人类青春期,为儿童IBD高发时期,故本研究选用该年龄组小鼠为实验对象。从小鼠疾病活动指数及病理学变化来看,本研究采用的小鼠UC模型很好地模拟了IBD造成的肠组织损伤。以往研究已经证实,UC患者肠上皮细胞Claudin-1表达较正常者下降,其与肠黏膜损伤程度相关[17]。本研究结果很好地验证了此结论,且表明UC初期,炎症反应较强,随着肠道黏膜的修复及症状好转,Claudin-1表达量逐渐升高。研究发现,在IBD炎性应答的早期阶段,中性粒细胞聚集于炎症黏膜,在其发病机制中具有不可代替的作用,且在UC患者的血液中,活化的中性粒细胞数量约为健康者的3倍[18]。既往研究证实,在急性期可见NETs形成。本研究进一步观察UC急性期后,随症状好转及肠黏膜屏障功能的逐渐恢复,NETs的变化情况,以期寻找其与肠黏膜损伤的相关性。作为NETs的主要成分,本研究采用PicoGreen®染料检测游离DNA的水平以评价NETs的含量。PicoGreen®染料能特异性结合dsDNA,有效避免ssDNA和RNA的干扰,已被证实具有较好的精确性和可靠性[19,20]。实验结果表明,各模型组小鼠与其相应对照组相比,血浆中NETs的含量均显著升高,并且随病情逐渐恢复,其含量呈逐渐下降的趋势。这与反映IBD中肠组织黏膜屏障功能的Claudin-1表达情况及免疫组织化学检测NETs的其他组成成分MPO和CitH3的结果趋势相符。表明血液循环及组织中大量形成却未被及时清除的NETs可能是IBD肠组织屏障功能损伤的病因之一。未来需要更多相关研究以明确NETs形成的分子机制及相关信号通路,并针对NETs形成造成的肠组织损伤进行治疗,为今后的临床治疗提供帮助。



























