
观察替加环素在革兰阴性菌感染的呼吸机相关性肺炎儿童中的疗效和安全性。
将2012年5月1日至2017年4月30日浙江大学医学院附属儿童医院收治的27例呼吸机相关性肺炎患儿作为研究对象。纳入标准:痰培养阳性;接受替加环素治疗2 d及以上。记录患儿的基本病史、用药信息和实验室检查结果。
纳入完整病例27例,总体出院时病死率37.0%(10/27)。痰培养分离得到27株菌株,均为多重耐药革兰阴性菌,以鲍曼不动杆菌为主,占85.2%(23/27)。替加环素疗程中位数10 d(范围3~27 d),治疗临床有效率40.7%(11/27),病原学清除率44.4%(12/27)。大部分病例联合使用其他抗生素,以舒普深为主。替加环素剂量模式以模式1(首剂量2 mg/kg,维持量1 mg/kg,每12小时1次)和模式2(首剂量1.5 mg/kg,维持量1 mg/kg,每12小时1次)为主,各占40.7%(11/27)和51.8%(14/27)。其中剂量模式1的临床有效率和病原学清除率均高于其他两个模式。治疗过程中未发现严重不良反应。
替加环素可用于革兰阴性菌感染的呼吸机相关性肺炎患儿,作为补救治疗,但需病原学支持。替加环素治疗呼吸机相关性肺炎儿童的合适剂量需要更多的临床试验研究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
机械通气48 h之后发生的肺炎称为呼吸机相关性肺炎(ventilator associated pneumonia,VAP),发生率为9.0/1 000个通气日~30.8/1 000个通气日,是非发达地区儿童重症监护室最常见的院内感染之一,可增加死亡风险以及延长机械通气时间[1,2,3]。抗生素是治疗VAP的一个重要部分,但多重耐药菌(multidrug resistant bacteria,MDR bacteria)的出现大大增加了抗生素治疗的难度。以鲍曼不动杆菌为代表的革兰阴性菌是儿童VAP的主要病原菌,且对碳青霉烯类等大部分广谱抗生素耐药[1]。
替加环素是一种四环素类的广谱抗生素,适用于18周岁及以上有复杂皮肤软组织感染、腹腔感染或者多重耐药菌导致的社区获得性细菌性肺炎患者[4]。虽然一个纳入945例成人患者的三期多中心随机双盲对照试验认为替加环素对VAP患者的临床疗效并不优于亚胺培南西司他丁[5],但由于其强大的抗菌谱,在常规抗生素无效的严重感染儿童患者中,替加环素仍是我们的选择之一。
2012年经国家食品药品监督管理总局批准,替加环素在国内上市。本院在临床工作中,针对一些常规抗生素治疗无效的重症感染患儿,经风险/收益评估,会给予替加环素治疗。本研究回顾性统计本院5年内接受替加环素治疗的VAP患儿,并分析药物的有效性和安全性。
将2012年5月1日至2017年4月30日浙江大学医学院附属儿童医院收治的27例VAP患儿作为研究对象。纳入标准:(1)痰培养阳性;(2)接受替加环素治疗。排除标准:替加环素治疗疗程<2 d(4次)。本研究所用药物相关不良反应均已告知患儿家长,并签署知情同意书,经医务科审核备案。
分别在替加环素治疗前后记录相关临床资料、实验室检查及药物不良反应,评估患儿临床疗效和病原学疗效。记录患儿年龄、性别、体重、现病史(基础疾病)、替加环素治疗剂量及疗程、使用替加环素之前的抗生素、与替加环素合用的抗生素、有创操作以及实验室检查。实验室检查主要包括白细胞计数、中性粒细胞绝对值计数、超敏C反应蛋白、病原学培养结果、肝肾功能和淀粉酶。第二代儿童死亡指数(pediatric index of mortality,PIM2)用于评估疾病严重程度,该指数包括收缩压、瞳孔对光反射、吸入氧浓度和动脉血氧分压比值、动脉血气实际碱剩余、是否选择性收入重症监护室、是否机械通气、是否行心肺分流术和基础疾病。
替加环素疗效评价,主要参考临床症状和病原学清除两方面。临床有效,指临床症状好转或治愈,抗生素降级使用或不用;临床失败,指临床症状无好转,加重或死亡。替加环素使用期间隔天查痰培养,如原有病原菌转阴性,则为病原学阳性转阴,如一直未转阴性,则为病原学一直阳性。所有病例均记录替加环素的不良反应,并电话随访牙齿变色情况。
使用SPSS 22.0统计软件。治疗前后的实验室检查数据符合正态分布,用均数±标准差( ±s)表示,采用配对t检验。其他临床数据不符合正态分布,采用中位数(范围)表示,P<0.05为差异有统计学意义。
±s)表示,采用配对t检验。其他临床数据不符合正态分布,采用中位数(范围)表示,P<0.05为差异有统计学意义。
符合本研究纳入及排除标准病例共27例,其中男14例,女13例,中位年龄0.68岁(范围40 d~14.3岁),中位体重7 kg(范围3.2~76 kg)。27例病例的中位住院时间50 d(范围8~96 d),入住ICU的中位时间38 d(范围8~73 d),机械通气中位时间23 d(范围4~52 d)。出院时,死亡10例(37.0%),其中1例直接死于感染,9例(33.3%)治愈,6例(22.2%)好转,出院后需继续治疗,有2例(7.4%)放弃治疗自动出院。所有病例,感染诊断除了VAP,还有脓毒症(3例)和导管相关性感染(2例)。现病史包括先天性心脏病(16例)、溺水(1例)、严重Ⅲ度烧伤(1例)、噬血细胞综合征(1例)、脓毒症(1例)、脑发育不良(1例)、颅内肿瘤(2例)、重症脑炎(2例)、颅骨骨折(1例)、车祸伤(1例)。有创操作包括先天性心脏病心内直视术(14例)、骨折内固定术(1例)、皮肤清创引流术(1例)、去骨瓣减压术(1例)、胸腔闭式引流术(1例)。
替加环素疗程中位数是10 d(范围3~27 d)。1例在诊断VAP后,根据药敏结果直接使用替加环素,其余26例在使用替加环素前,已使用其他抗生素,但未取得满意疗效,故选择替加环素。根据不同的首剂和维持剂量,替加环素的使用剂量有三种模式,分别为模式1(首剂量2 mg/kg,维持量1 mg/kg,每12小时1次),模式2(首剂量1.5 mg/kg,维持量1 mg/kg,每12小时1次)和模式3(无首剂量,维持量1 mg/kg,每12小时1次)。其中以模式1和模式2为主,分别有11例(40.7%)和14例(51.8%)。替加环素前的抗生素治疗疗程中位数是7 d(范围2~27 d)。这些抗生素主要有美罗培南(7例)、舒普深(7例)、哌拉西林/他唑巴坦(3例)、亚胺培南西司他丁(1例)、万古霉素(1例)、左氧氟沙星(1例)、美罗培南联合万古霉素(3例)、美罗培南联合利奈唑胺(1例)、亚胺培南西司他丁联合万古霉素(1例)、哌拉西林/他唑巴坦联合左氧氟沙星(1例)。有7例是替加环素单药使用、其余16例均联合其他抗生素、包括舒普深(13例)、左氧氟沙星(1例)、哌拉西林/他唑巴坦(1例)、红霉素(1例)、妥布霉素(1例)、舒普深联合万古霉素(1例)、舒普深联合阿米卡星(1例)、舒普深联合利奈唑胺(1例)。
经替加环素治疗,11例临床表现好转,12例病原学得到清除。从表1中可以看到,接受剂量模式1治疗的患儿,较剂量模式2有略高的临床好转率和病原学清除率。比较替加环素治疗前和治疗结束后48 h内的白细胞计数、超敏C反应蛋白、PIM2评分,发现均无明显改变,差异无统计学意义,见表2。
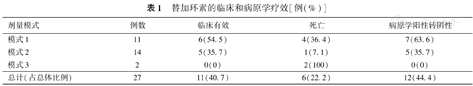
替加环素的临床和病原学疗效[例(%)]
替加环素的临床和病原学疗效[例(%)]
| 剂量模式 | 例数 | 临床有效 | 死亡 | 病原学阳性转阴性 |
|---|---|---|---|---|
| 模式1 | 11 | 6(54.5) | 4(36.4) | 7(63.6) |
| 模式2 | 14 | 5(35.7) | 1(7.1) | 5(35.7) |
| 模式3 | 2 | 0(0) | 2(100) | 0(0) |
| 总计(占总体比例) | 27 | 11(40.7) | 6(22.2) | 12(44.4) |
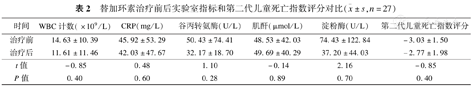
替加环素治疗前后实验室指标和第二代儿童死亡指数评分对比( ±s,n=27)
±s,n=27)
替加环素治疗前后实验室指标和第二代儿童死亡指数评分对比( ±s,n=27)
±s,n=27)
| 时间 | WBC计数(×109/L) | CRP(mg/L) | 谷丙转氨酶(U/L) | 肌酐(μmol/L) | 淀粉酶(U/L) | 第二代儿童死亡指数评分 |
|---|---|---|---|---|---|---|
| 治疗前 | 14.63±10.39 | 45.92±53.29 | 50.43±74.41 | 48.53±42.03 | 74.43±122.84 | -3.03±1.50 |
| 治疗后 | 11.61±11.46 | 42.03±47.67 | 32.17±18.70 | 49.69±40.29 | 37.20±44.03 | -2.77±1.98 |
| t值 | -0.85 | 0.48 | 1.10 | -0.14 | 2.16 | -0.85 |
| P值 | 0.40 | 0.60 | 0.28 | 0.89 | 0.70 | 0.40 |
27例患儿共得到27个痰培养结果,其中以鲍曼不动杆菌为主,有23例,其他病原学包括肺炎克雷伯菌(1例)、嗜麦芽窄食单胞菌(1例)、洋葱伯克霍尔德菌(1例)、脑膜脓毒性黄杆菌(1例)。所有细菌均是对碳青霉烯类耐药的多重耐药革兰阴性菌,其中17个菌株对替加环素敏感,8个菌株对替加环素中度敏感,1个菌株对替加环素耐药,2个菌株替加环素药敏未做。有1例患儿经替加环素治疗1周,复查痰培养,鲍曼不动杆菌对替加环素的药敏由敏感转为耐药。
所有患儿均接受机械通气,因此无法评估恶心、呕吐的情况。在治疗过程中,无一例患儿因腹泻、肝功能损害或黄疸加重中断用药。治疗前后的丙氨酸转氨酶、肌酐和淀粉酶均无明显变化,差异无统计学意义,见表2。电话随访出院患儿,未发现有牙齿变色病例。
尽管替加环素有广谱抗菌活性,但药物说明书中并不推荐应用于VAP[4]。替加环素在VAP患儿中的疗效和剂量现仍存争议[5,6]。本研究的结论并不乐观:总体有效率是40.7%,病死率37.3%,细菌清除率44.4%,PIM2评分无改善。巴基斯坦一项队列研究显示VAP患儿整体病死率是23%[7]。另一项成人研究报道VAP整体病死率是13.1%,替加环素有效率是37.1%[5]。本研究结果提示患儿并未从替加环素的治疗中受益,我们认为存在以下两方面原因。
一方面,替加环素在儿科患者中是超说明书用药,通常只用于严重感染的挽救性治疗,并且用药时机远远迟于其他文献报道中的成人病例。事实上,本研究中仅一小部分的死亡可归因于严重感染,更多的原因是多器官功能衰竭或溺水导致的不可逆脑损伤。一篇包含13例严重感染病例的报道也得出类似的结论[8]。本组中很多病例伴有其他感染,比如脓毒症和导管相关性感染,而有研究显示替加环素在治疗VAP合并脓毒症患者中无确切疗效,甚至增加病死率[9]。在临床实践中,一个有多重严重感染的患者通常意味着更严重的病情、更大可能的器官功能障碍发生率和更高的病死率。
另一方面,大家对于替加环素在VAP儿科患者中的应用以及合适剂量仍未达成一致[10]。2012年一项药代动力学研究认为1.2 mg/kg,每12小时1次的替加环素可用于8~11周岁有复杂腹腔感染、皮肤软组织感染或严重社区获得性肺炎的儿童[11]。几项成人VAP的研究显示,常规剂量的替加环素无法达到满意的临床疗效和病原学清除率,因此需要更高的剂量(150~200 mg/d)[5,12]。本组中部分患儿<8周岁,最小的仅40 d,针对这部分患儿,替加环素说明书中无明确使用剂量。而且,出于对可能的不良反应,如肝肾功能损害的考虑,大部分患儿使用了相对保守的剂量(首剂1.5~2 mg/kg,维持剂量1 mg/kg,每12小时1次)。我们需要更多的研究,确认替加环素在VAP患儿中的合适使用剂量。
本研究分离出的所有病原菌均是革兰阴性菌,其中绝大多数是鲍曼不动杆菌,这一结论与最近的一篇报道相同,认为鲍曼不动杆菌是VAP的主要致病菌之一[1,13]。鲍曼不动杆菌是一种条件致病菌,其感染容易发生在病情严重、合并外科手术、严重免疫抑制或接受侵入性生命支持治疗(如呼吸机辅助通气或外科引流)的患者[14]。由于其特殊的机制,鲍曼不动杆菌很容易发生多重耐药。本研究患儿有以下危险因素:机械通气,外科手术,严重免疫抑制和外科引流。最低抑菌浓度显示所有鲍曼不动杆菌均是多重耐药菌,对碳青霉烯类耐药,并有1例在接受替加环素治疗后,鲍曼不动杆菌发生了对替加环素的耐药。土耳其一项研究显示,VAP患者中,鲍曼不动杆菌对替加环素的耐药率可达25.8%[15]。因此,使用替加环素时要更加谨慎,并需要病原学结果支持。
在绝大部分儿科病例中,替加环素是和其他抗生素联合使用的,其中舒普深最常用。一项涉及了14个国家地区的随机双盲对照三期、四期临床试验认为,针对鲍曼不动杆菌感染,其他常规抗生素无效时,单用替加环素或联合用药均可取得满意的疗效[16]。另外一项体外药敏试验证实,替加环素联合舒普深能有效治疗多重耐药的鲍曼不动杆菌感染[17]。
替加环素已知的不良反应有恶心、呕吐、腹泻[11]、粒细胞移植成活延迟[18]和急性胰腺炎[19]。本组的研究对象均接受呼吸机治疗,因此无法评估恶心、呕吐情况。但所有病例未因发生不良反应而引起用药中断,包括腹泻、丙氨酸转氨酶升高、黄疸加重和纤维蛋白原降低。根据文献报道,VAP成人患者接受更高剂量替加环素(首剂量150 mg或200 mg,维持量75 mg或100 mg)治疗后,不良反应也仅是轻微,在可耐受范围内[12]。
总体来说,替加环素与其他抗生素联合用药,对VAP患儿来说是可行的,并且可耐受,但我们需要更多的随机对照试验来获得更准确的数据。目前,如果VAP患儿病情严重,常规抗生素无效,病原学结果明确,可考虑使用替加环素。
本研究是病例观察研究,可能存在选择偏倚,且疾病临床转归影响因素众多,不仅仅是替加环素的作用。另外,其他药物的合用大大增加了结果分析的难度。但是,本文提供了替加环素在VAP患儿应用中的一些临床经验,对后续更多的研究有一定的参考价值。
所有作者均声明不存在利益冲突



























