
脓毒症是临床常见的危重症,是世界范围内严重的公共卫生问题。脂多糖(lipopolysaccharide,LPS)是革兰阴性细菌细胞壁中的一种组成成分,是脓毒症发生的重要始动因素,可诱导炎症反应、凝血障碍、免疫抑制等病理过程。因此,掌握LPS相关领域的研究进展,对深入理解脓毒症发病机制、探索脓毒症新的诊断和治疗手段具有重要意义。本文对近年来LPS在脓毒症研究领域的相关进展作一综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脓毒症(sepsis)是由于宿主对感染反应失调导致的威胁生命的器官功能障碍[1]。据估计,全球每年发生3 150万例脓毒症和1 940万例严重脓毒症,或可导致530万人死亡[2]。近年来,脓毒症的发病率不断攀升,脓毒性休克的病死率仍高达20%~30%[3]。脂多糖(lipopolysaccharide,LPS)是脓毒症重要的始动因子[4],在脓毒症病理生理过程中扮演着重要角色。因此,全面掌握LPS相关研究进展,对深入理解脓毒症,探索脓毒症的诊断和治疗措施具有重要意义。
Toll样受体4(toll like receptor 4,TLR4)是LPS最重要的胞膜受体,LPS结合蛋白(LPS binding protein,LBP)与LPS结合,促进CD14递送LPS至TLR4/髓样分化蛋白2(myeloid differentiation protein,MD2)复合物并与MD2结合,随后MD2促进LPS/MD2/TLR4复合物的二聚化,进而启动相关信号转导通路[5]。LPS藉由TLR4进行信号转导,主要有两条途径,分别为:转导质膜信号的TLR4/髓样分化因子88(myeloid differentiation factor 88,MyD88)/NF-κB信号通路以及转导CD14依赖的胞吞内体信号TLR4/β干扰素TIR结构域衔接蛋白(TIR-domain-containing adapter-inducing interferon-β,TRIF)/干扰素调节因子3(interferon regulatory factor 3,IRF3)信号通路。前者最终使NF-κB进入核内,诱导IL-1β,TNF-α和IL-6等促炎细胞因子的产生和释放[6],后者则使磷酸化的IRF-3易位至细胞核启动IFN-β基因的转录[7]。除发挥致炎效应外,新近发现LPS诱导的巨噬细胞代谢产物衣康酸(itacolate)可通过核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nfr2)通路发挥强效抗炎作用[8]。此外,LPS及其相关TLR4信号通路被证实在严重脓毒症髓系分化障碍中发挥重要作用[9]。LPS还可与巨噬细胞膜表面的脑特异性血管生成抑制因子1(brain specific angiogenesis inhibitor,BAI1)结合,介导Ras相关的C3肉毒素底物(ras-related C3 botulinum toxin substrate,Rac)活化刺激巨噬细胞内吞病原体,激活吞噬体NADPH氧化酶,产生一系列活性氧簇(reactive oxygen species,ROS)发挥对革兰阴性菌的杀菌作用[10]。
近年来,LPS胞内受体被逐渐发现和认识。Kayagaki等[11]首先提出小鼠含半胱氨酸的天冬氨酸蛋白水解酶11(cysteinyl aspartate specific proteinase 11,Caspase-11)是非经典炎性体(noncanonical inflammasome)的激活剂,可能是独立于TLR4的LPS胞内受体。Shi等[12]鉴定并确认了小鼠Caspase-11和人类Caspase-4/5为胞内LPS的受体,结合LPS后发生寡聚化而被激活,并产生一系列生物学效应:包括细胞焦亡(pyroptosis)[13];加速IL-1β和IL-18的成熟和释放[14];增强单核细胞溶酶体功能从而发挥杀伤病原体的作用(图1)。研究表明,发生脓毒症时,大量由肝细胞释放的高迁移率族蛋白(high mobility group box 1,HMGB1)能与LPS结合,经由巨噬细胞和血管内皮细胞表面晚期糖基化终产物受体(receptor of advanced glycation endproducts,RAGE)将LPS转运至胞浆中,引发Caspase-11介导的细胞焦亡,启动休克、器官功能障碍等病理生理过程[15]。此外,Caspase11基因敲除鼠在脓毒症时展现出较TLR4基因敲除鼠更高的生存率[16],这提示Caspase11或承担着TLR4的部分功能,二者可能在脓毒症发病机制的始动环节中发挥同等重要的作用。针对LPS胞内受体的研究更新了我们对LPS识别和应答体系的认识,同时也为脓毒症的治疗提供了全新的靶点。
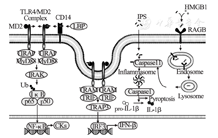

TLR4/MD2 Complex:Toll样受体4/髓样分化蛋白2复合体;LBP:脂多糖结合蛋白;LPS:脂多糖;HMGB1:高迁移率族蛋白1;RAGE:晚期糖基化终产物受体;TRAP:肿瘤坏死因子受体相关蛋白;MyD88:髓样分化因子88;IRAK:白细胞介素-1受体相关激酶;Ub:泛素化;IκB:核因子kappaB抑制蛋白;NF-κB:核因子kappaB;CK:细胞因子;TRAM:含Toll-白细胞介素1受体结构域诱导干扰素β接头蛋白相关接头分子;TRIF:β干扰素TIR结构域衔接蛋白;TRAF3:TNF受体相关因子3;IRF3:干扰素调节因子3;IFN-β:β干扰素;Caspase:含半胱氨酸的天冬氨酸蛋白水解酶;Inflammasome:炎性体;Pyroptosis:细胞焦亡;Pro-IL-1β:白细胞介素1β前体;Endosome:内体;Lysosome:溶酶体。
目前常用的LPS检测方法包括:鲎阿米巴样细胞裂解物法(limulus amebocyte lysate assay,LALassay)、内毒素活性测定(endotoxin activity assay,EAA)以及O抗原及核心寡糖测定,以LAL法最为常用。
Adamik等[17]的研究(EAA法)发现革兰阴性菌感染和菌血症(bacteremia)患者发生内毒素血症(endotoxemia)的风险较高(OR值分别为3.1和3.8)。其中,革兰阴性菌感染患者的内毒素活性单位(endotoxin activity unit,EAU)水平高于革兰阳性菌感染和真菌感染患者(EAU值分别为0.51±0.21和0.37±0.19)。Wang等[18]和Kritselis等[19]回顾性分析了LAL比浊法(turbidimetric LAL assay)检测血浆LPS水平在重症监护病房(ICU)诊断菌血症中的作用,结果表明:ICU患者血浆LPS水平在发生革兰阴性菌感染时显著升高,其中非肠杆菌感染患者的血浆LPS水平显著高于肠杆菌感染患者。与LAL比浊法相比,LAL散射光度法(endotoxin scattering photometry assay,ESP assay)具有更高的敏感性(81.1%比51.4%)和阴性预测值(93.8%比86.5%),能有效鉴别接受急诊胃肠道手术患者术后不同的感染状态(non-SIRS/sepsis/septic shock);此外,当革兰阳性菌感染患者出现脓毒性休克时,LPS水平显著高于未发生感染性休克的患者(27.5 pg/ml比3.87 pg/ml,P<0.05),表明LPS水平升高可能对革兰阳性菌感染性休克的发生具有提示作用[20]。此外,有研究表明:与低剂量LPS诱导的免疫耐受不同,显著的内毒素血症常常伴随着单核细胞免疫麻痹,表现为血浆内毒素水平较高的脓毒症患者的离体单核细胞分泌TNF-α能力下降[19]。这提示机体固有/适应性免疫系统状态可能与不同的感染状态有关,强调了脓毒症个体化诊疗的重要性。
值得注意的是,机体存在多种失活机制可对循环LPS活性造成影响:内源性酰基羧酸水解酶(acyloxyacylhydrolase,AOAH)可使LPS失活,这也是低剂量LPS诱导免疫耐受的原因之一;淋巴结对LPS的"滤过"作用;循环脂蛋白结合造成LPS短时"失能",宿主间不同的遗传背景或免疫状态或可影响LPS的生物学功能。此外,LAL法敏感性欠佳,易于发生交叉反应,EAA法仅能间接反映LPS水平,这些因素可能影响LPS检测结果,造成LPS水平与疾病严重程度或其他相关炎症因子及代谢产物变化不一致,限制LPS检测的应用范围[21]。
作为脓毒症发生发展过程中重要的分子事件,LPS与相关受体结合"理论上"是脓毒症治疗药物的最佳靶点。针对LPS-TLR4信号通路的先导药物众多,它们分属不同类别的化合物分子,包括糖脂、查尔酮衍生物、萜类化合物和多肽等大类。这些先导药物作用模式各不相同,能够在不同层面阻断TLR4信号转导。迄今为止,TLR4拮抗剂中只有瑞沙托维(resatorvid/TAK-242)和伊立托伦(eritoran)进入临床试验阶段[22],尽管其有助于改善亚组中的一些临床指标,但遗憾的是相关药物均未显著降低脓毒症患者的28 d病死率(伊立托伦:21.9%比22.3%,P=0.89;瑞沙托维:17%比24%,P=0.26)[23,24]。
近年来LPS吸附性血液净化产品相关研究发展较快,其中以多黏菌素B吸附柱(Toraymyxin)最具代表性。多黏菌素B可与LPS脂质A的硫酸根结合,发挥杀菌和清除LPS的双重作用。其临床应用受限于静脉用药带来的中枢毒性和肾毒性,而将其共价结合于高分子材料后应用于血液净化可以规避这一缺陷。经过多年的发展,陆续有部分小型试验显示出其能改善脓毒症患者的存活率[25,26]。Ⅱ期临床试验——多黏菌素B血液灌流在腹腔感染性休克中的早期应用表现乐观[27],然而,此后的多项研究均未能发现多黏菌素B血液灌流能够为脓毒症患者带来任何生存获益[28,29]。Ⅲ期临床试验——多黏菌素B血液灌流应用于成人内毒素血症和感染性休克疗效评估的随机对照试验结果亦表明:常规治疗结合多黏菌素B血液灌流未能降低EAA>0.6脓毒症患者28 d病死率(脓毒症组37.7%,对照组34.5%,P=0.49)[30]。值得注意的是,针对该研究的亚组分析显示:EAA水平介于0.6~0.89的患者亚组在接受多黏菌素B血液灌流治疗后,28 d病死率可显著降低10.7%(P=0.047),这提示不同血浆内毒素水平患者对多黏菌素B血液灌流治疗的敏感性存在差异[31]。此外,多黏菌素B血液灌流治疗能够改善脓毒症患者的平均动脉压(MAP)及平均氧合指数,降低EAA水平[32,33],亦有观点认为部分患者可能从多次多黏菌素B血液灌流治疗中受益。值得注意的是,前述研究中部分单位基于临床诊断或微生物学检测结果制定LPS吸附治疗策略而未进行LPS水平的检测。所以,强调脓毒症个体化诊疗,精准"适配"对应的患者亚群,将脓毒症临床诊断与内毒素水平检测相结合,或许是脓毒症血液净化治疗的关键。此外,继续探索治疗时机,针对性开发吸附效率更高的生物材料亦非常重要。相较于多黏菌素B吸附柱和专性细胞因子吸附装置——聚乙烯吡咯烷酮包被的聚苯乙烯多孔微球(CytoSorb),表面覆有聚乙烯亚胺和肝素的AN69膜材料(oXiris)是血液净化产品中的"全能型"选手,oXiris可以同时吸附内毒素和细胞因子,其内毒素吸附能力与Toraymyxin相近,对细胞因子和其他炎症介质的清除效率与CytoSorb接近[34],更多相关试验有待开展以验证其临床效果。
为什么阻断LPS信号转导相关靶点不能关闭通往脓毒症的"大门"?众所周知,脓毒症可以触发一系列复杂而又相互关联的病理生理过程,众多相关分子机制尚待进一步研究,我们对脓毒症的理解可谓之"管中窥豹";其次,基础研究中相关动物模型不能完全复制脓毒症病理生理过程,动物和人类在细胞因子反应模式的相关研究上存在差异;此外,脓毒症是一种异质性疾病,其发病机制与个体遗传背景、原发感染类型等诸多因素有关。诸多涉及脓毒症的临床研究受试者原发病各异,试验设计者没有对患者进行细致的归类和分组,且未考虑不同个体对治疗的敏感性存在差异,导致相关研究不可控"变量"过多,从而影响实验结果。
总之,LPS在脓毒症的发生发展中起到了关键性的作用,不同个体对LPS代谢和应答的表现不一,这可能也是脓毒症临床表现和预后不尽相同的原因所在。针对LPS信号转导通路的多个靶点的联合治疗可能成为脓毒症较为有希望的治疗方法。
所有作者均声明不存在利益冲突



























