
动态观察不同浓度氧气暴露后新生大鼠肺发育的病理改变,初步探讨不同浓度氧气对新生大鼠肺发育的影响,为基础研究制造支气管肺发育不良模型提供理论依据。
采用随机数字表法将128只足月新生SD大鼠随机分为氧气A组(FiO2>0.9)、氧气B组(FiO2=0.6)、氧气C组(FiO2=0.4)和空气组,每组32只。每组分别于实验第3、7、14和21天随机选取8只麻醉后处死收集肺组织。记录吸入高氧后新生大鼠的一般状态、体重变化、肺组织的病理改变、辐射状肺泡计数(radical alveolar count,RAC)、平均肺泡直径(mean alveolar diameter,MAD)及肺泡间隔厚度(alveolar septal thickness,AST)。
与同日龄空气组比较,氧气A组大鼠吸氧3 d后体重明显下降,氧气B组吸氧7 d后体重明显下降,氧气C组各时间点体重较空气组略有下降,但差异无统计学意义(P>0.05)。HE染色可见氧气A组和氧气B组肺泡腔均明显增大,肺泡结构简单化,肺泡间隔不同程度增厚,氧气A组肺泡数目减少更明显,肺泡间隔更厚。氧气C组肺泡改变较氧气B组和氧气A组明显减轻,仍可见少许棘突和次级隔。氧气A组和氧气B组的RAC于生后7 d开始较空气组明显减少(P<0.05),氧气C组的RAC较空气组略有减少,于第14天开始差异有统计学意义(P<0.05)。氧气A组和氧气B组的MAD和AST于生后7 d开始较空气组明显增高(P<0.05),氧气C组随日龄增长MAD和AST略有下降,但下降不明显,于生后21 d与空气组相比,差异有统计学意义(P<0.05)。
不同浓度的氧气均可对肺泡发育产生影响,持续吸入>60%浓度氧气即可出现较严重肺泡发育不良,为研究支气管肺发育不良的发病机制提供模型基础。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿严重的肺部并发症,早产儿吸入高浓度氧气是发生BPD的一个主要因素[1]。动物实验中常用高氧暴露制造BPD动物模型来研究BPD的发病机制,但不同浓度氧气对肺发育的影响也不尽相同。本实验以不同浓度氧气诱导新生大鼠肺组织损伤,初步探讨不同浓度氧气对肺发育和损伤的影响。
足月新生SD大鼠128只,体重5~9 g,雌雄不限,按随机数字表法随机分为氧气A组[吸入氧浓度(FiO2)>0.9]、氧气B组(FiO2=0.6)、氧气C组(FiO2=0.4)和空气组,每组32只。氧气A、B、C组将足月新生SD大鼠生后即置于氧箱中,持续输入氧气,维持FiO2分别为>0.9、0.6和0.4,FiO2由测氧仪连续记录(型号572;仕富梅,诺伍德,英国)。用钠石灰吸收CO2,CO2浓度<0.5%,温度为25~27 ℃,湿度50%~70%。每天定时开箱0.5 h,添加水、饲料及更换垫料,并每天与对照组交换代母鼠,以避免因氧中毒而致喂养能力下降。空气组吸入空气,具体方法及控制因素同实验组。
每组大鼠分别于实验第3、7、14和21天随机选取8只麻醉后处死,快速打开胸腔,分离肺组织。将左肺组织置于4%多聚甲醛中固定24 h,石蜡包埋,常规制备4 μm切片,切片进行HE染色,脱蜡、水化、染色、封片,于光学显微镜下观察新生大鼠肺组织的形态结构变化。
在光镜下从终末细支气管中心至最近结缔组织隔膜引垂直线,该垂直线上的肺泡数就是RAC值,反映终末呼吸单位所含肺泡数目,为肺发育程度的检测指标[2]。在100×光镜下,每组选取8张切片,每张切片3次计数,取平均值。
在100×光镜下,每组选取8张切片,每张切片选取3个视野,每个视野至少测量10个肺泡,取平均值。
在100×光镜下,每组选取8张切片,每张切片随机选取3个视野,测量每个视野中AST,取平均值。
采用SPSS 17.0统计软件进行统计学处理,所有数据均以均值±标准差(Mean±SD)表示,各组间比较采用方差分析,P<0.05为差异有统计学意义。
空气组第3天和第7天,新生鼠反应好,吃奶好,体重增加,皮色红润。空气组第14天,新生鼠体毛光泽,睁眼。空气组第21天,新生鼠开始吃鼠粮,饮食好,体毛浓密,有光泽。
与空气组各时间点相比较,氧气A组第3天,新生鼠离氧后呼吸稍快、无呼吸困难及发绀,第7天新生鼠皮色苍白,口周略发绀,反应尚可,离氧后呼吸稍快、无呼吸困难,第14天新生鼠反应差,不活泼,体毛稀疏,无光泽,时有头颤,离氧后呼吸增快,出现呼吸困难,口周发绀,头颤明显。恢复氧供后可缓解,第21天新生鼠反应极差,身长、体重明显下降,明显呼吸困难和发绀,头颤明显,出现对高氧的依赖,离氧后呼吸困难、发绀加重。氧气B组第3天新生鼠离氧后呼吸无明显增快,无呼吸困难及发绀,第7天新生鼠皮色略苍白,口周无发绀,反应良,离氧后呼吸稍快,无呼吸困难,第14天新生鼠反应一般,不活泼,体毛涩,无光泽,无头颤,离氧后呼吸增快,出现呼吸困难、口周发绀、头颤。第21天新生鼠反应差,身长、体重下降,有头颤,离氧后出现呼吸困难和发绀。氧气C组第3天新生鼠反应良,呼吸平稳,体重有所增长,离氧后呼吸无增快,第7天新生鼠皮色稍红润,口周略发绀,反应尚可,离氧后呼吸稍快,无呼吸困难,第14天新生鼠反应可,体毛光泽差,无头颤,离氧后呼吸稍增快,无呼吸困难和发绀,第21天新生鼠反应稍差,无头颤,离氧后无呼吸困难和发绀,对氧气基本没有依赖。
与同日龄空气组比较,氧气A组3、7、14、21 d体重增加明显减少,差异有统计学意义(P<0.05),氧气B组7、14、21 d体重增加明显减少,差异有统计学意义(P<0.05),氧气C组各时间点体重较空气组略有下降,差异无统计学意义(P>0.05),见表1。

新生大鼠生后不同时间点空气组与氧气组体重比较(Mean±SD,g)
新生大鼠生后不同时间点空气组与氧气组体重比较(Mean±SD,g)
| 组别 | 鼠数(只) | 3 d | 7 d | 14 d | 21 d |
|---|---|---|---|---|---|
| 氧气A组 | 8 | 9.50±1.00a | 13.00±1.38a | 20.50±0.45a | 25.50±0.89a |
| 氧气B组 | 8 | 11.00±0.54 | 17.50±1.79a | 31.00±0.71a | 43.00±1.67a |
| 氧气C组 | 8 | 12.00±1.92 | 20.50±1.00 | 36.50±1.00 | 51.00±0.89 |
| 空气组 | 8 | 12.00±1.45 | 21.50±0.63 | 38.00±1.41 | 52.50±1.00 |
| F值 | 4.72 | 53.77 | 407.57 | 658.52 | |
| P值 | <0.05 | <0.05 | <0.05 | <0.05 |
注:与同时间点空气组比较,aP<0.05。
空气组第3天,肺泡间隔较薄,肺泡数目较少,肺泡大小均匀,与空气组第3天相比,空气组第7天,肺泡间隔变薄,肺泡大小均匀,空气组第14天和21天,肺泡数目增多,肺泡腔均匀,肺间隔棘突出现,肺间隔较薄,次级间隔数量明显增多。
与同日龄空气组相比,氧气A组、氧气B组和氧气C组第3天均可见肺泡间隔变厚。氧气A组、氧气B组和氧气C组第7天均可见肺泡数量变少,体积变大,形态不规则,肺泡间隔略厚,肺泡腔内可见炎性细胞浸润。在第14天,氧气A组肺泡腔明显增大,肺泡数目明显减少,肺间隔厚,肺泡结构简单化。氧气B组肺泡腔明显增大,肺泡数目减少,肺间隔较厚,肺泡结构简单化。氧气C组肺泡腔稍增大,肺泡数目略减少,肺间隔增厚不明显,可见少许棘突和次级隔。在第21天,氧气A组和氧气B组肺泡腔均明显增大,肺泡结构简单化。氧气A组肺泡数目减少更明显,肺间隔更厚。氧气C组肺泡腔增大,肺泡数目减少,肺间隔略增厚,可见少许棘突和次级隔,见图1。


氧气A组和氧气B组随时间延长肺泡腔明显增大,肺泡结构简单化,肺泡间隔不同程度增厚,氧气A组肺泡数目减少更明显,肺泡间隔更厚。氧气C组肺泡改变较轻,第21天仍可见少许棘突和次级隔。
空气组新生大鼠RAC随日龄呈增加趋势。与同日龄空气组比较,氧气A组从第7天开始下降,并持续至21 d(P<0.05)。氧气B组随日龄增长,RAC逐渐升高,但升高不明显,生后第7、14天和21天差别不大,与各时间点空气组相比,差异有统计学意义(P<0.05)。氧气C组随日龄增长,RAC逐渐升高,并且升高明显,生后第3天和第7天与同日龄空气组相比,差异无统计学意义(P>0.05),在生后第14天和第21天与空气组相比,差异有统计学意义(P<0.05),见表2。

不同时间点空气组与氧气组肺组织RAC比较(Mean±SD,个)
不同时间点空气组与氧气组肺组织RAC比较(Mean±SD,个)
| 组别 | 鼠数(只) | 3 d | 7 d | 14 d | 21 d |
|---|---|---|---|---|---|
| 氧气A组 | 8 | 6.25±0.04 | 6.37±0.07a | 5.17±0.14a | 4.57±0.18a |
| 氧气B组 | 8 | 6.26±0.03 | 6.61±0.04a | 6.73±0.14a | 7.11±0.30a |
| 氧气C组 | 8 | 6.37±0.14 | 7.02±0.11 | 9.13±0.08a | 9.47±0.26a |
| 空气组 | 8 | 6.39±0.10 | 7.12±0.06 | 9.64±0.26 | 9.93±0.13 |
| F值 | 4.20 | 134.21 | 961.71 | 682.22 | |
| P值 | >0.05 | <0.05 | <0.05 | <0.05 |
注:与同时间点空气组比较,aP<0.05;RAC:辐射状肺泡计数。
空气组新生大鼠MAD和AST随日龄逐渐下降。与空气组比较,氧气A组从第7天开始逐渐增加,较同时间点空气组明显增加(P<0.01)。氧气B组随日龄增长MAD和AST均逐渐增高,氧气B组MAD从第7天开始增加,较同时间点空气组明显增加(P<0.01);氧气B组AST在生后第7天增高不明显,但与对应空气组相比差异有统计学意义(P<0.05),第14天和21天与对应空气组相比,增高明显,差异有统计学意义(P<0.01)。氧气C组随日龄增长MAD和AST略有下降,但下降不明显,第3天、7天和14天与各时间点空气组相比,差异无统计学意义(P>0.05),第21天与空气组相比,差异有统计学意义(P<0.05),见表3、表4。
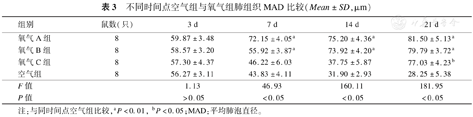
不同时间点空气组与氧气组肺组织MAD比较(Mean±SD,μm)
不同时间点空气组与氧气组肺组织MAD比较(Mean±SD,μm)
| 组别 | 鼠数(只) | 3 d | 7 d | 14 d | 21 d |
|---|---|---|---|---|---|
| 氧气A组 | 8 | 59.87±3.48 | 72.15±4.05a | 75.20±4.36a | 81.50±5.13a |
| 氧气B组 | 8 | 58.57±3.20 | 55.92±3.87a | 73.92±4.20a | 79.79±3.72a |
| 氧气C组 | 8 | 57.30±4.37 | 46.22±6.03 | 37.75±5.87 | 77.03±4.23b |
| 空气组 | 8 | 56.27±3.11 | 43.83±4.11 | 31.90±2.93 | 28.25±5.38 |
| F值 | 1.13 | 46.93 | 160.11 | 181.95 | |
| P值 | >0.05 | <0.05 | <0.05 | <0.05 |
注:与同时间点空气组比较,aP<0.01,bP<0.05;MAD:平均肺泡直径。
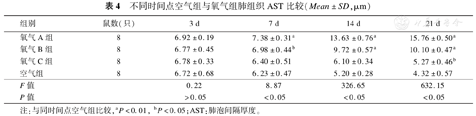
不同时间点空气组与氧气组肺组织AST比较(Mean±SD,μm)
不同时间点空气组与氧气组肺组织AST比较(Mean±SD,μm)
| 组别 | 鼠数(只) | 3 d | 7 d | 14 d | 21 d |
|---|---|---|---|---|---|
| 氧气A组 | 8 | 6.92±0.19 | 7.38±0.31a | 13.63±0.76a | 15.76±0.50a |
| 氧气B组 | 8 | 6.77±0.45 | 6.98±0.44b | 9.72±0.57a | 10.10±0.47a |
| 氧气C组 | 8 | 6.78±0.33 | 6.40±0.51 | 6.10±0.34 | 5.27±0.46b |
| 空气组 | 8 | 6.72±0.68 | 6.23±0.47 | 5.20±0.28 | 4.32±0.57 |
| F值 | 0.22 | 8.87 | 326.65 | 632.15 | |
| P值 | >0.05 | <0.05 | <0.05 | <0.05 |
注:与同时间点空气组比较,aP<0.01,bP<0.05;AST:肺泡间隔厚度。
BPD是早产儿,尤其是小早产儿常见的慢性肺部疾病[3]。Northway等[4]在1967年首次提出BPD的概念。近年来由于围产医学的迅速发展,临床上更为常见的是一种轻型BPD,主要病理表现为肺泡结构简单化和肺微血管发育停止[5,6,7]。导致BPD发生的因素复杂多样,为探索BPD的发病机制及其防治措施,需要应用可靠的动物模型来研究。高氧诱导的BPD模型是众多动物模型中最常见和最主要的模型,并且高氧是导致早产儿急性肺损伤的重要因素[8]。很多学者使用高氧诱导的BPD动物模型进行疾病的研究[9,10,11],目前缺乏关于不同浓度氧气所致肺损伤的系统归纳和总结。本实验将足月新生SD大鼠生后置于3种不同浓度氧下,制造新生大鼠肺组织损伤模型,观察不同浓度氧对新生大鼠肺发育和损伤的影响。
发育生物学已证实人类的肺发育大致分为胚胎期(0~6周),假腺体期(6~15周),微管期(15~23周),囊泡期(23~36周)和肺泡期(36周~2岁)。大鼠生后1 d的肺组织正处于囊泡期,而大多数发生BPD的早产儿出生于肺发育阶段的囊泡期,因此应用生后1 d的足月新生大鼠制造BPD模型,可以模拟人类早产儿肺损伤的病理变化。新近的研究显示,无论吸入哪种浓度的氧气均可以对肺发育产生明显影响,当吸入氧气浓度为85%时,肺组织同时出现肺泡数量减少和肺泡间隔变厚这2个经典BPD的肺组织病理学特征。当氧气浓度下降至60%或40%时,肺组织只出现肺泡数量下降,而AST改变很小[12]。本研究结果显示,氧气浓度为90%时,肺组织逐渐出现肺泡腔扩大,肺泡数量减少,局限性肺气肿,肺间质成纤维细胞增多,肺间隔明显增厚,肺部病理学改变以肺间质纤维化和肺气肿为主。氧气浓度60%时肺组织逐渐出现肺泡腔扩大,肺泡数量减少,正常肺泡结构消失,肺泡结构简单化,而肺间隔增厚不明显,肺部病理改变主要表现为肺泡发育障碍,而肺间质纤维化表现较轻。氧气浓度40%时肺组织肺泡腔扩大不明显,肺泡数量略减少,结构稍简单,但仍可见少量棘突和次级隔。空气组显示肺泡体积变小,大小均匀,数量增多,可见较多棘突和次级隔。Buczynski等[13]在新生小鼠中观察了不同梯度的氧浓度(分别为21%~100%)暴露对肺泡发育的影响;Nardiello等[14]总结了不同浓度氧(40%~100%)暴露下肺组织的病理特点,本研究结果与国外报道基本一致。
肺发育成熟的重要特点是由体积大、数量少的囊泡向体积小、数量多的肺泡转化。RAC是反映肺泡化程度的重要指标,用以代表肺泡的大小[15]。本研究结果显示,空气组新生大鼠RAC值随生后日龄逐渐增加,90%浓度氧组从7 d开始持续下降,60%浓度氧组随时间延长RAC略有升高,与各时间点空气组相比差异有统计学意义,40%浓度氧组随时间延长RAC逐渐升高,组间差异有统计学意义,在生后第14天和第21天与空气组差异有统计学意义。以上结果提示3种浓度的氧均可以影响肺泡形态,随着氧浓度的增高,肺组织肺泡化程度更低,肺间隔更厚,损害更严重。3种浓度氧均可使肺泡化程度降低,肺组织从囊泡期向肺泡期的发育受阻,不同程度导致肺泡结构简单化。
MAD和AST也是反映肺发育程度的重要指标。有学者从实验技术角度分析认为,肺组织经过石蜡包埋、脱蜡和脱水等一系列操作后测得的AST可能并不能真实反映肺泡的发育情况[16]。由于处理的一致性,很多学者还是应用AST来评价肺泡发育的程度[12]。本研究结果显示空气组新生大鼠MAD和AST随日龄逐渐下降。90%浓度氧组和60%浓度氧组MAD和AST从第7天开始逐渐增加,但是90%浓度氧组增加的更明显。40%浓度氧组随时间延长MAD和AST略有下降,但下降不明显。由此可见90%浓度氧对新生大鼠MAD和AST的影响更大,尤其是对AST的影响,这也说明90%浓度氧暴露更易使肺组织出现肺间质纤维化和肺气肿的病理学改变,60%浓度氧暴露更易使肺组织出现肺泡发育障碍的病理学改变。
不同浓度氧暴露下,新生鼠肺组织发育受到不同程度的阻滞,肺泡气体交换面积不同程度减少,影响肺组织的气体交换过程,出现不同程度的生长受限。本研究结果显示,与空气组各个时间点相比,90%浓度氧组从生后3 d开始体重明显下降,出现生长受限,60%浓度氧组从生后7 d开始出现生长受限,40%浓度组较空气组体重略有下降,但差异无统计学意义。由此可见,吸入的氧气浓度越高,时间越长,新生鼠的生长受限越严重,对新生鼠的危害越大。
综上所述,不同浓度的氧气均可对肺泡发育产生影响,吸入氧浓度越高,对肺组织损伤越重,持续吸入>60%浓度氧气可致新生大鼠生长迟缓和肺损伤,为BPD的发病机制研究提供实验基础。
所有作者均声明不存在利益冲突



























