
评价机械通气联合一氧化氮吸入(inhaled nitric oxide,iNO)技术治疗新生儿持续性肺动脉高压(persistent pulmonary hypertension of newborn,PPHN)的疗效。
2016年1月至2018年12月我院收治的重度PPHN且常规治疗方法无效的患儿40例纳入研究,采用机械通气联合iNO技术,观察iNO前以及iNO治疗后的不同时间点肺动脉压力、血气离子分析结果及呼吸功能变化。
40例患儿经过iNO治疗后肺动脉压由(54.95±17.08) mmHg(1 mmHg=0.133 kPa)降至(20.40±14.26) mmHg,在iNO治疗后0.5~1 h,肺部氧合情况即得到迅速改善,平均气道压由(13.98±2.40)cmH2O(1 cmH2O=0.098 kPa)降至(12.44±2.69)cmH2O,氧合指数从26.89±18.62降至13.84±5.52,PaO2/FiO2由(60.34±23.49) mmHg升至(144.46±23.49) mmHg,同时血气中pH值由7.31±0.14升至7.37±0.07;并在治疗后48 h内呈现PaO2/FiO2、pH值逐渐升高趋势,平均动脉压、氧合指数逐渐下降趋势,并具有统计学意义(P<0.01)。
机械通气联合iNO治疗PPHN可以迅速改善患儿的氧合状态,降低肺动脉压力,进而提高患儿的存活率及远期预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
由于多种病因引起新生儿出生后肺循环压力和阻力正常下降障碍,动脉导管和(或)卵圆孔水平的右向左分流持续存在(即胎儿型循环过渡到正常成人型循环发生障碍)所致的一种新生儿持续缺氧和发绀的病理状态,被称为新生儿持续性肺动脉高压(persistent pulmonary hypertension of newborn,PPHN),是新生儿临床常见的危急重症[1]。目前报道的PPHN发生率约为0.4‰~6.8‰,病死率为10%~20%[2,3,4]。如何有效、安全的改善患儿氧合,降低肺动脉压力,减少并发症发生,进而降低患儿病死率成为许多新生儿临床工作者的关注话题。目前国际上治疗PPHN的一线肺血管扩张剂为一氧化氮[5]。本研究旨在观察机械通气联合一氧化氮吸入治疗(inhaled nitric oxide,iNO)在PPHN的应用价值及对患儿血气指标、呼吸功能的影响,现将结果报道如下。
将2016年1月至2018年12月我院收治的重度PPHN患儿40例纳入研究。其中男26例,女14例;早产儿14例,足月儿26例,胎龄最大41周,最小31周,平均胎龄(37.11±2.68)周。出生体重1 340~4 580 g,平均(3.15±0.71)kg。患儿原发病中7例为新生儿窒息,21例为新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS),胎粪吸入综合征(meconium aspiration syndrome,MAS)和新生儿肺炎各6例。其中1例患儿为RDS合并肺出血,1例患儿为MAS合并肺出血,1例患儿为重度新生儿窒息合并肺出血。有创机械辅助通气使用时间40.0~459.5 h,平均使用时间为(139.21±84.47)h,拔出气管插管后无创辅助通气平均时间为(4.62±8.54)h,NO吸入平均时间为(80.19±51.57)h。
心脏超声确诊为PPHN的患儿,或右上肢及左下肢经皮血氧饱和度差值≥20%且机械通气半小时后氧合指数(oxygenation index,OI)>15。
除外复杂性先天性心脏病、中枢性呼吸暂停、出血性疾病或出血倾向、严重贫血、先天性畸形等所致呼吸衰竭。除外治疗过程中使用西地那非或硫酸镁的患儿。本研究拟采用的研究方法及其过程均告知家属,并签署NO使用同意书。
治疗用NO气体,浓度为(1 000±50)×10-6,NO2浓度<10×10-6。分装于铝合金钢瓶内,NO经专用质量流量控制仪接入呼吸机供气管道,在近患儿气道端Y形管接口处取样,经电化学NO/NO2浓度检测仪控制并监测气道中NO和NO2浓度,仪器型号为INOSYS SLE3600(英国产)。使用罗氏cobas b 123全自动血气、电解质和生化分析仪监测血生化指标及高铁血红蛋白浓度。
治疗前(0点)和治疗后0.5 h、0.5~24 h、24~48 h连续监测患儿生命体征及血生化指标,包括血气离子分析、PaO2/FiO2及OI值(OI=MAP×FiO2×100/PaO2)。分别于治疗前(0点)和准备撤离NO前通过心脏超声监测肺动脉压力。记录呼吸机参数、上机时间、NO使用时间。
以开始吸入NO为治疗起点(0点),接受初始剂量为20×10-6的NO/NO2气体,根据患儿对NO治疗的反应逐步调整,NO浓度控制在5×10-6~20×10-6,最高不超过30×10-6。连续吸入6 h后,每30分钟降低5×10-6,直至浓度降至1×10-6~3×10-6,维持时间至少7 d,若期间FiO2<0.6,PaO2可稳定维持在50 mmHg(1 mmHg=0.133 kPa)以上,则可撤离NO。治疗期间定期监测高铁血红蛋白,持续监测NO2的浓度,确保其浓度≤3×10-6。
应用SPSS 19.0统计软件分析数据。计量资料用均数±标准差(Mean±SD)表示,治疗前后指标的比较采用配对t检验,各个时间点间的指标比较采用方差分析,P<0.05为差异有统计学意义。
40例患儿均好转出院,无放弃治疗或死亡病例。19例RDS患儿使用NO前应用肺表面活性物质治疗;2例新生儿肺炎患儿使用NO前气管内补充肺表面活性物质,1例MAS患儿使用NO前应用肺表面活性物质治疗。发生肺出血4例,其中2例为RDS,MAS和新生儿窒息各1例。合并气胸3例,其中1例为肺炎,1例为RDS合并气胸,1例为RDS合并纵隔气肿。14例早产儿中均未出现支气管肺发育不良。
使用iNO治疗前,40例患儿的平均肺动脉压为(54.94±17.08) mmHg,使用iNO后,患儿平均肺动脉压力较使用前明显下降[(20.40±14.26) mmHg,t=4.139,P<0.05]。通过定时监测血气离子分析结果及呼吸机参数可得出,患儿在iNO治疗0.5~1 h时,氧合指标就出现改善,具体表现为MAP及OI值显著下降,PaO2/FiO2值明显上升。治疗24 h左右病情明显改善,24~48 h趋于稳定,血气中pH值较iNO治疗前稳步上升,差异均有统计学意义(P<0.01)(表1)。
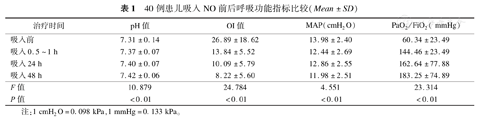
40例患儿吸入NO前后呼吸功能指标比较(Mean±SD)
40例患儿吸入NO前后呼吸功能指标比较(Mean±SD)
| 治疗时间 | pH值 | OI值 | MAP(cmH2O) | PaO2/FiO2( mmHg) |
|---|---|---|---|---|
| 吸入前 | 7.31±0.14 | 26.89±18.62 | 13.98±2.40 | 60.34±23.49 |
| 吸入0.5~1 h | 7.37±0.07 | 13.84±5.52 | 12.44±2.69 | 144.46±23.49 |
| 吸入24 h | 7.40±0.07 | 10.09±5.79 | 12.86±2.55 | 162.64±77.88 |
| 吸入48 h | 7.42±0.06 | 8.22±5.60 | 11.98±2.51 | 183.25±74.89 |
| F值 | 10.879 | 24.784 | 4.551 | 23.314 |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 |
注:1 cmH2O=0.098 kPa,1 mmHg=0.133 kPa。
PPHN是新生儿科临床常见的危急重症,是指新生儿出生后肺循环压力和阻力正常下降障碍,动脉导管和(或)卵圆孔水平的右向左分流持续存在所致的一种新生儿持续缺氧和发绀的病理状态。PPHN的发生与很多新生儿心肺疾病例如围生期窒息、新生儿败血症、MAS等相关,也有可能是特发性的[6]。随着诊疗手段的进步,早期PPHN患儿病死率约为10%,但仍有25%左右的患儿在2周岁时发现存在不同程度的神经系统后遗症[7]。
发生PPHN时,内皮细胞功能受损导致血管舒张因子和血管收缩因子之间的平衡发生改变,NO、前列环素等血管舒张因子的分泌受到抑制的同时,内皮素-1等血管收缩因子水平增加。因此PPHN治疗的主要核心是重建内皮细胞功能、降低肺血管阻力,在改善机体组织氧合的同时保证体循环不受影响[8]。NO是唯一被FDA批准用于治疗足月儿及晚期早产儿PPHN的血管舒张剂,目前在国际上作为一线疗法被广泛应用,其次为口服西地那非[5]。NO是血管内皮衍生的致血管舒张因子,其通过结合并激活鸟苷酸环化酶提高细胞内环磷酸鸟苷(cGMP)水平,进而激活cGMP门控离子通道和cGMP依赖性蛋白激酶从而达到调节血管平滑肌张力的作用[9]。NO可以选择性扩张肺血管,降低肺动脉压,增加肺血流,改善通气/血流比,且不会对体循环血压和血流产生影响。NO可以迅速提高氧合,因此减少了PPHN患儿体外生命支持手段的使用[10,11,12,13,14],减轻了家庭经济负担的同时提高患儿的存活率及远期预后。本研究结果表明,40例患儿经过iNO治疗后肺动脉压力由(54.95±17.08) mmHg降至(20.40±0.40) mmHg,并且在iNO 0.5~1 h后,肺部氧合情况即得到迅速改善,并在治疗后的48 h内呈现PaO2/FiO2、pH值逐渐升高趋势,MAP、OI值逐渐下降趋势,并具有统计学意义(P<0.01)。
目前研究表明,机械通气联合iNO治疗PPHN是安全有效的,且与对照组相比,并未增加远期不良反应的发生率[15,16]。但NO具有自由基特点,可以抑制肺部血小板的凝聚能力,因此应用NO期间必须监测患儿的凝血时间,严密观察是否存在颅内出血症状。过高的NO浓度会导致体内高铁血红蛋白和NO2水平升高,因此吸入NO起始浓度多为10×10-6~20×10-6,之后推荐维持浓度为5×10-6~10×10-6,并根据治疗效果逐渐降低NO浓度至1×10-6~2×10-6。对于34周以下的早产儿,推荐NO起始浓度为10×10-6,当上下肢经皮血氧饱和度差异消失或PaO2>80~100 mmHg,FiO2降至0.4~0.6时,可考虑开始逐渐降低NO浓度至5×10-6,逐渐减量最后停用NO。
自20世纪90年代以来,因iNO技术被用于治疗新生儿低氧性呼吸衰竭和PPHN,减少了体外膜肺氧合的使用需要,但并没有证据支持NO疗法可以改善PPHN患儿的远期神经发育结果,因此目前仍不支持将iNO技术作为常规治疗RDS的技术手段,并且在早产儿PPHN的治疗中,iNO也并非常规治疗方案[17]。在最新2019年欧洲RDS管理指南中,也不推荐常规或抢救性使用iNO技术治疗早产儿呼吸衰竭,而仅限于治疗早产儿胎膜早破和PPHN[18]。但当RDS患儿对肺表面活性物质治疗反应不佳且需要较高呼吸机参数时,有必要完善超声心动图检查以确定是否合并PPHN,并开始iNO治疗。Dani等[19]发现,与RDS组相比,使用iNO的PPHN+RDS组患儿可以更快的改善氧合情况,其原因可能与NO可以迅速扭转卵圆孔/动脉导管水平的右向左分流有关。但NO也可以通过降低肺血管压力、提高肺功能等方面提高RDS患者的氧合情况[20]。
综上所述,本研究证实了机械通气联合iNO治疗PPHN可以迅速改善PPHN患儿的氧合状态,降低肺动脉压力,进而提高患儿的存活率及远期预后,且目前研究表明NO治疗是安全有效的。但关于该技术的远期影响,尤其是对于新生儿神经系统发育的影响仍需大样本研究。
所有作者均声明不存在利益冲突



























