通过检测儿童过敏性紫癜(Henoch-Schonlein purpura,HSP)及紫癜性肾炎(Henoch-Schonlein purpura nephritis,HSPN)患者血清内中期因子(midkine,MK)水平,研究MK在HSP、HSPN发病机制中的作用。
选取2016年12月至2018年1月中国医科大学附属盛京医院小儿肾脏风湿免疫内科收治的35例确诊病例作为病例组,其中HSP组10例,HSPN组25例。又将HSPN组根据24 h尿蛋白定量水平分为非肾病水平蛋白尿组10例,肾病水平蛋白尿组15例。健康对照组为同期于我院发育儿科门诊健康体检的健康儿童12名。患儿确诊后采集血样检测MK。收集肾功能、24 h尿蛋白定量、免疫球蛋白等指标。比较各组间血清MK、肾功能指标等的差异,分析MK与各临床指标之间的相关性,采用受试者工作特征(ROC)曲线分析MK诊断HSP、HSPN的价值。
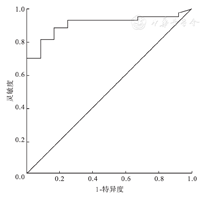
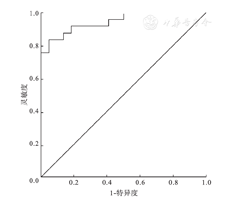
病例组血清MK水平明显高于健康对照组[(289.34±160.70)pg/ml比(100.03±56.75)pg/ml)],差异有统计学意义(P<0.05);且MK浓度在HSPN(肾病水平蛋白尿)组、HSPN(非肾病水平蛋白尿)组、HSP组间比较差异仍具有统计学意义[(449.91±141.91)pg/ml比(244.04±89.15)pg/ml比(175.94±46.30)pg/ml)](P<0.05)。在病例组中,MK与尿微量白蛋白(r=0.54)、IgA(r=0.132)、IgE(r=0.304)、血β2微球蛋白(r=0.483)、24 h尿蛋白定量/体重(r=0.503)、尿转铁蛋白水平(r=0.509)呈正相关(P<0.05)。根据ROC曲线,MK诊断HSP的曲线下面积值为0.908(95%CI 0.828-0.988),诊断HSP的最佳值为182.762 pg/ml,敏感性、特异性分别为81.4%、91.7%;MK诊断HSPN的曲线下面积值为0.947(95%CI 0.888-1.000),预测诊断HSPN的最佳值为218.186 pg/ml,敏感性、特异性分别为84.0%、95.5%。
MK可能参与HSP、HSPN的发病过程,推测可为HSP及HSPN的临床诊断提供依据,并且在评估HSPN肾损害程度方面具有一定意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
过敏性紫癜(Henoch-Schonlein purpura,HSP)是儿童最常见的一种全身性系统性小血管炎,肾脏受累为HSP远期严重并发症之一,并且肾受累程度密切关系到患者预后情况[1]。有研究表明,大约有30% ~ 50%的HSP患儿可出现累及肾脏表现[2],且约有5%~15%患儿可发展至终末期肾病[3,4]。中期因子(midkine,MK)是一种在健康人体内微量表达的小分子蛋白,主要存在于血管内皮细胞,部分器官黏液上皮细胞中。目前研究表明MK在多种疾病中都存在高表达,目前已知其主要具有促进炎症因子表达、抑制调节性T细胞、促进纤维蛋白溶解、促进血管生成、促进炎性细胞趋化、促进肿瘤发展的作用[5]。近年来,MK与自身免疫性疾病、慢性炎症性疾病相关研究增多[6]。HSP可能的发病机制主要有炎症反应、免疫紊乱、基因易感性、凝血异常等[7]。目前临床早期预测HSP发生肾损害指标较少,所以早期预测HSPN的发生发展对患儿预后越发重要。MK在炎症反应中发挥一定的免疫调节作用。本文旨在探讨MK在HSP、HSPN发生发展中的临床意义,为早期诊断、肾脏损伤程度评估提供临床证据。
选择病例组为2016年12月至2018年1月于中国医科大学附属盛京医院小儿肾脏风湿免疫内科病房住院患儿35例。其中男20例,女15例;年龄(8.12±3.10)岁。健康对照组为同期于我院发育儿科门诊健康体检儿童12例。其中男6例,女6例;年龄(6.92±1.165)岁。以上研究通过我院医学伦理委员会批准(伦理编号:2016PS321K)。
(1)根据HSP有无肾脏损伤分为:HSP组(10例),男6例,女4例,年龄(6.58±1.15)岁;HSPN组(25例),男14例,女11例,年龄(7.51±2.16)岁。(2)HSPN组根据24 h尿蛋白定量水平分为:肾病水平蛋白尿组(15例):24 h尿蛋白定量>50 mg/(kg·d),其中男8例,女7例,年龄(6.63±1.14)岁;非肾病水平蛋白尿组(10例):24 h尿蛋白定量<50 mg/(kg·d),其中男6例,女4例,年龄(7.21±1.16)岁;(3)健康对照组:同期健康体检儿童,男6例,女6例;年龄(6.92±1.16)岁。
留取晨起空腹静脉血3 ml(治疗前),1 500 r/min离心10 min后将血清样本储存于-80 ℃冰箱中待检。尿液标本均为诊断明确后首次留取的标本,送检本院检验科检测。收集肾功能(肌酐、尿素氮、胱抑素C)、24 h尿蛋白定量、尿微量白蛋白、尿转铁蛋白、尿α1微球蛋白、免疫球蛋白(IgA、IgE、IgM、IgG)、血β2微球蛋白、尿β2微球蛋白检测结果。
采用酶联免疫吸附法测定血清中MK浓度,具体步骤严格按照美国Abcam公司试剂盒说明书进行。
采用SPSS 24.0软件进行统计处理,正态计量资料以均数±标准差(Mean±SD)表示,采用t检验和方差分析。各指标间的相关性分析采用Pearson分析。MK对于HSP及HSPN的诊断能力评估采用受试者工作特征(receiver operating characteristics,ROC)曲线分析。
病例组MK水平显著高于健康对照组[(289.34±160.70)pg/ml比(100.03±56.75)pg/ml],差异有统计学意义(P<0.05)。病例组间MK浓度比较差异有统计学意义(P<0.05)。见表1。
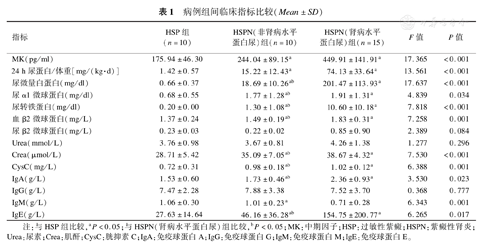
病例组间临床指标比较(Mean±SD)
病例组间临床指标比较(Mean±SD)
| 指标 | HSP组(n=10) | HSPN(非肾病水平蛋白尿)组(n=10) | HSPN(肾病水平蛋白尿)组(n=15) | F值 | P值 |
|---|---|---|---|---|---|
| MK(pg/ml) | 175.94±46.30 | 244.04±89.15a | 449.91±141.91a | 17.365 | <0.001 |
| 24 h尿蛋白/体重[mg/(kg·d)] | 1.42±0.57 | 15.22±12.43a | 74.13±33.64a | 13.561 | <0.001 |
| 尿微量白蛋白(mg/dl) | 0.66±0.37 | 18.69±10.26ab | 201.47±113.93a | 17.637 | <0.001 |
| 尿α1微球蛋白(mg/dl) | 0.68±0.55 | 1.77±1.28ab | 1.91±1.31a | 4.839 | 0.034 |
| 尿转铁蛋白(mg/dl) | 0.20±0.00 | 1.30±1.08ab | 10.60±10.18a | 7.818 | <0.001 |
| 血β2微球蛋白(mg/L) | 1.37±0.24 | 1.49±0.19ab | 1.83±0.31a | 7.258 | 0.001 |
| 尿β2微球蛋白(mg/L) | 0.23±0.03 | 0.22±0.02 | 0.85±0.90 | 2.389 | 0.084 |
| Urea(mmol/L) | 3.76±0.98 | 3.67±0.81 | 4.26±1.38 | 1.277 | 0.296 |
| Crea(μmol/L) | 28.71±5.42 | 35.09±7.05ab | 38.67±4.32a | 7.530 | <0.001 |
| CysC(mg/L) | 0.72±0.31 | 0.98±0.18ab | 1.02±0.12a | 6.388 | 0.001 |
| IgA(g/L) | 1.53±0.60 | 1.73±0.46ab | 2.36±0.93a | 3.530 | 0.023 |
| IgG(g/L) | 7.47±2.28 | 7.88±3.38 | 7.52±3.70 | 0.368 | 0.777 |
| IgM(g/L) | 1.06±0.30 | 1.01±0.23a | 0.71±0.28 | 6.343 | 0.001 |
| IgE(g/L) | 27.63±14.64 | 46.16±36.28ab | 154.75±200.77a | 6.265 | 0.017 |
注:与HSP组比较,aP<0.05;与HSPN(肾病水平蛋白尿)组比较,bP<0.05;MK:中期因子;HSP:过敏性紫癜;HSPN:紫癜性肾炎;Urea:尿素;Crea:肌酐;CysC:胱抑素C;IgA:免疫球蛋白A;IgG:免疫球蛋白G;IgM:免疫球蛋白M;IgE:免疫球蛋白E。
病例组间在尿转铁蛋白、血β2微球蛋白、尿微量白蛋白、尿α1微球蛋白、IgE、CysC、IgA、肌酐水平上存在显著差异(P<0.05)。而尿β2微球蛋白、IgM、Urea、IgG比较差异无统计学意义(P>0.05),见表1。
病例组患儿血清MK浓度与血β2微球蛋白、lgE、lgA、尿微量白蛋白、24 h尿蛋白定量/体重、尿转铁蛋白呈正相关(P<0.05);与lgM之间呈负相关(P<0.05);与肾功能(Urea、Crea、Cysc)、尿α1微球蛋白、尿β2微球蛋白、IgG不存在相关关系(P>0.05),见表2。
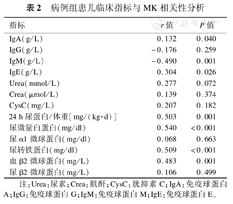
病例组患儿临床指标与MK相关性分析
病例组患儿临床指标与MK相关性分析
| 指标 | r值 | P值 |
|---|---|---|
| IgA(g/L) | 0.132 | 0.040 |
| IgG(g/L) | -0.176 | 0.259 |
| IgM(g/L) | -0.490 | 0.001 |
| IgE(g/L) | 0.304 | 0.026 |
| Urea(mmol/L) | 0.277 | 0.072 |
| Crea(μmol/L) | 0.139 | 0.374 |
| CysC(mg/L) | 0.207 | 0.182 |
| 24 h尿蛋白/体重[mg/(kg·d)] | 0.503 | 0.001 |
| 尿微量白蛋白(mg/dl) | 0.540 | <0.001 |
| 尿α1微球蛋白(mg/dl) | 0.068 | 0.663 |
| 尿转铁蛋白(mg/dl) | 0.509 | <0.001 |
| 血β2微球蛋白(mg/L) | 0.483 | 0.001 |
| 尿β2微球蛋白(mg/L) | 0.106 | 0.499 |
注:Urea:尿素;Crea:肌酐;CysC:胱抑素C;IgA:免疫球蛋白A;IgG:免疫球蛋白G;IgM:免疫球蛋白M;IgE:免疫球蛋白E。
MK是在1988年由Kadomatsu等[10]在视黄酸分化小鼠胚胎肿瘤细胞中发现。作为一种分泌型肝素结合生长因子,人类MK基因定位于11号染色体上,其表达蛋白由121个氨基酸构成,分子质量为13 000[11]。既往有研究结论显示MK在健康人体内存在微量表达[12]。目前健康人体内细胞水平分泌来源尚不明确,可能来源包括血管内皮细胞和某些器官黏液细胞[13,14]。成年人中,肾小管上皮细胞同样也可少量分泌MK[15]。
在生物学功能方面,妊娠中期胚胎发育的某些组织中MK存在高表达,例如上皮组织、神经组织和重塑中的中胚层中[16]。此外其在神经系统、牙齿、肺、肾、骨等组织的发育形成过程中也起到关键作用,同时MK还具有调节间质细胞、肾间充质上皮细胞两者平衡的作用[17,18,19,20]。在抗菌方面MK也具有一定作用,尤其是革兰阳性菌[21]。MK参与许多疾病的发生发展。Matsuda等[22]在小鼠狼疮性肾炎模型中发现,MK具有诱导T细胞扩增及促进Th1细胞分化的作用。在自身免疫性脑脊髓炎小鼠模型中发现,MK可通过抑制耐受性树突状细胞的发育进而抑制Treg细胞的分化,同时还可促进IL-17及IFN- y的分泌从而发挥促炎作用[23]。MK还具有促进血管生成、血管内皮细胞增殖的作用。此外,在急慢性肾脏疾病中,MK在肾小管及内皮细胞表达均上调。且动物模型证实,肾脏切除后小鼠体内MK水平升高,同时伴有血中环氧二十碳三烯酸及血管紧张素Ⅱ的增高,导致肾小管间质损伤及肾小球硬化,进而肾脏功能衰竭,而MK缺如小鼠中肾脏损伤相对较轻[24]。MK在肾脏损伤中的作用机制目前仍需进一步研究。
HSP作为IgA介导的免疫复合物沉积在靶器官、血管内皮及肾小球基底膜造成损伤的血管炎,目前其发病机制尚未完全明确。目前公认的主要发病机制包括免疫系统紊乱、凝血功能异常、炎症因子介导、基因易感性等方面。IgA在HSP和HSPN发生发展中起主导作用,其中IgA1为主要成分。主要机制为IgA1铰链区异常糖基化导致GalNAc残端暴露。当机体受到感染侵袭时,病原体产生的GalNAc表面抗体即与IgA1残端结合,从而形成某种免疫复合物,沉积在肾小球基底膜造成肾脏损害。研究表明,40%的HSP患儿血清内IgA存在高表达情况,但HSP和HSPN水平差异无统计学意义[25]。本研究结果显示随着IgA水平逐渐升高,尿蛋白及MK水平逐渐升高。证实此前研究中HSPN患儿MK水平与IgA水平呈正相关的观点[26],猜测MK可能参与IgA介导的免疫损伤相关途径,可能机制为IgA形成免疫复合物沉积在肾脏,进一步促进MK由肾小管上皮细胞产生增多。而本实验中HSPN组IgA及MK水平均高于HSP组及健康对照组,进一步提示在IgA介导免疫损伤基础上,MK可进一步加重肾脏损伤。免疫失衡及炎症因子介导机制在HSP发病机制中的研究日渐增多。研究表明,HSP患者存在Treg细胞和Th17细胞比例失衡,Th17细胞水平升高,而Treg细胞水平下降,并且比例与疾病和肾脏损害程度存在一定相关性[27]。Treg细胞主要起到抑制炎症反应及免疫应答的作用。相反,Th17细胞主要通过分泌白细胞介素(IL)-17促进炎症因子释放的途径介导炎性反应。目前已知IL-4、IL-6、IL-17、肿瘤坏死因子、干扰素(IFN)-y在HSP发病过程中存在高表达。在实验性自身免疫性脑脊髓炎MK缺失小鼠模型中检测到CD4+T细胞分泌INF-y及IL-17水平降低,说明MK可促进INF-y及IL-17分泌,从而证明可能存在促炎作用。此外,MK还可通过促进蛋白酪氨酸磷酸酶SHP-2表达,抑制Treg细胞增殖的途径而直接导致Treg细胞和Th17细胞之间比例失衡。通过测定肾脏缺血再灌注小鼠模型血中单核细胞趋化蛋白-1、巨噬细胞炎性蛋白-2水平,发现二者存在高表达,而MK缺失小鼠则相反[28]。由此证实,MK既可通过影响免疫细胞增殖影响炎症因子的释放,又可通过促使炎性趋化因子的高水平表达进而诱导炎性细胞浸润在肾脏造成损害。
本研究结果显示在病例组中MK浓度明显高于健康对照组,可见MK在HSP及HSPN发生发展中发挥作用,且MK与尿蛋白水平呈正相关,说明MK可反映HSPN肾脏损伤程度及预后情况。本研究另一结果显示MK浓度与尿微量白蛋白、血β2微球蛋白水平呈正相关,而尿微量白蛋白、血β2微球蛋白为目前临床常用预测早期肾损伤的指标,因此推测MK可能对HSP早期肾损伤具有预测价值。综上讨论MK可能在HSP、HSPN发生发展中发挥作用。结合本研究ROC曲线分析提示MK HSP阈值为182.762 pg/ml,敏感性、特异性分别为81.4%、91.7%;预测HSPN的敏感性、特异性分别为84.0%、95.5%,诊断阈值为218.186 pg/ml;可得出结论:血清中MK作为预测诊断儿童HSP、HSPN,评估肾脏损伤程度的临床指标具有一定参考意义。
既往并无大量研究证实MK在HSP及HSPN发病机制中的具体作用机制,本研究通过尿蛋白定量水平详细分组,一方面证实MK具有预测诊断HSP早期肾损害的作用,另一方面发现MK具有一定评估HSPN肾脏损害程度的作用。
所有作者均声明不存在利益冲突