
探讨经皮二氧化碳分压(transcutaneous carbon dioxide pressure,TcpCO2)监测在极低出生体重儿(very low birth weight infant,VLBW)和超低出生体重儿(extremely low birth weight infant,ELBW)撤机后的应用,进一步指导VLBW和ELBW拔管撤机后的呼吸管理。
收集2016年3月至2018年12月我院住院的胎龄<32周、出生体重<1 500 g、生后24 h内因呼吸窘迫需要机械通气支持并拟行撤机的患儿。观察组55例患儿给予TcpCO2监测并于撤机后1 h、6 h、12 h、24 h、48 h、72 h采集血气,对照组55例患儿为单纯采集动脉血气。当TcpCO2监测及PaCO2提示高碳酸血症时积极给予临床干预,记录两组患儿在撤机后不同时间点(1 h、6 h、12 h、24 h、48 h、72 h)血气PaCO2结果及观察组TcpCO2数值,并同时记录撤机失败情况。
观察组与对照组患儿的一般资料(性别、胎龄、出生体重、孕母产前是否应用糖皮质激素)比较,差异无统计学意义(P>0.05);两组患儿的机械通气时间、无创通气模式及时间等方面比较,差异无统计学意义(P>0.05)。两组患儿在24 h及总72 h内撤机失败率比较观察组低于対照组[3.6%(2/55)比14.0%(8/55),7.3%(4/55)比21.0%(12/55)],差异有统计学意义(P<0.05)。两组患儿在撤机后6 h、12 h、24 h的血气PaCO2比较差异有统计学意义(P<0.05),但在1 h、48 h、72 h两组间比较,差异无统计学意义(P>0.05)。观察组患儿同一时间点TcpCO2与PaCO2间差异无统计学意义(P>0.05),同时TcpCO2与PaCO2两者间具有相关性(r=0.761,P<0.05)。
接受机械通气的VLBW和ELBW撤机后给予持续TcpCO2监测,不仅具有连续、无创监测的特点,同时可以及早发现高碳酸血症并给予对症处理,降低患儿撤机失败发生率,且证实TcpCO2与PaCO2具有较好的相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着新生儿抢救技术的发展,NICU中早产儿尤其是极低出生体重儿(very low birth weight infant,VLBW)和超低出生体重儿(extremely low birth weight infant,ELBW)存活比例越来越高,其生后因呼吸障碍多需机械辅助通气治疗,早产儿尤其是VLBW发生拔管失败的比例为20%~50%[1],其中导致撤离呼吸机失败的重要原因是高碳酸血症,同时持续的高碳酸血症易诱发颅内出血及多脏器功能损害[2]。因此,如何早期发现撤机后患儿高碳酸血症并积极处置,减少撤机失败率对早产儿治疗有重要意义。
目前,NICU主要通过采集动脉血及末梢血监测动脉二氧化碳分压(PaCO2),是评估肺部气体交换功能及酸碱度失衡的重要检测手段,但其最主要的缺点为有创操作,新生儿皮肤屏障薄弱,可能会增加早产儿罹患感染的机会,并带来疼痛及不良刺激,引发呼吸机对抗及颅内出血等,同时反复采血会导致医源性贫血。经皮二氧化碳分压监测(transcutaneous carbon dioxide pressure,TcpCO2)已广泛应用于新生儿临床,研究发现其不仅无创安全,可连续动态监测PaCO2,而且与PaCO2具有良好的相关性。多数文献已经报道,对于低出生体重儿,在新生儿氧疗、机械通气、休克及低灌注监测等方面均发挥了重要作用[3,4,5,6],但用于VLBW、ELBW拔管撤离呼吸机后的报道较少。因此,本文主要通过对比应用TcpCO2监测及血气分析在VLBW、ELBW的撤机失败率,以及TcpCO2监测与PaCO2的相关性,进一步探讨TcpCO2监测在VLBW、ELBW拔管撤机后的临床应用。
选取2016年3月至2018年12月在中国医科大学附属盛京医院第一新生儿病房住院的胎龄<32周、出生体重<1 500 g、生后24 h内因呼吸窘迫需要机械通气支持并拟行撤机的患儿共110例。符合纳入标准的研究对象,当其病情好转,需要拔出气管插管改为无创辅助通气模式时,将患儿分为两组,撤机后给予TcpCO2监测组为观察组,未使用TcpCO2监测组为对照组。
(1)在收集数据前死亡或出院;(2)有重大畸形(复杂先天性心脏病、神经肌肉性疾病、呼吸系统畸形、消化系统畸形);(3)皮肤破损,严重皮疹及局部皮肤水肿。
TCM CombiM监测仪TCM4 series(雷度公司,丹麦);罗氏cobas b 123血气分析仪
患儿涂皮肤保护膜,对监测仪进行调试,电极温度42℃,固定贴环贴于电极上,固定环中央滴1小滴电极凝胶后粘贴于前胸壁或脐旁,并予医用胶布固定,待数据稳定后进行数值记录。
两组患儿撤离呼吸机后过渡为无创辅助通气,观察组给予TcpCO2监测,每2小时更换位置,在撤机后1 h、6 h、12 h、24 h、48 h、72 h记录监测数值并采集血气记录PaCO2。在非数据监测时间段病情平稳可暂停监测3~4 h。对照组患儿常规1 h、6 h、12 h、24 h、48 h、72 h采集动脉血气。
观察组患儿TcpCO2监测提示高碳酸血症时,积极给予临床干预,若处置后高碳酸血症不改善,采集血气,符合上机指征给予上机,记录为撤机失败。两组患儿撤机失败再次上机后,不再记录后续监测指标。
出现高碳酸血症(TcpCO2或PaCO2>60~70 mmHg,1 mmHg=0.133 kPa)时给予调整无创辅助通气参数,追加咖啡因,应用利尿药物,雾化支气管扩张剂措施。
在负荷量[20 mg/(kg·d)]及维持量[5 mg/(kg·d)]基础上,追加10 mg/kg。
依据2004年中华医学会儿科学分会新生儿组制定的标准[7]:(1)吸入氧浓度为0.6时,PaO2低于50 mmHg或经皮血氧饱和度低于85%(紫绀型先天性心脏病除外);(2)PaCO2>60~70 mmHg伴pH<7.25;(3)严重或常规治疗无效的呼吸暂停。
NCPAP通常压力为3~8 cmH2O(1 cmH2O=0.098 kPa),吸入氧浓度(FiO2)则根据TcSO2进行设置和调整。BiPAP参数包括PIP、PEEP、吸气时间和呼吸频率。建议基础压力(PEEP)为4~6 cmH2O,上限压力(PIP)水平不超过10 cmH2O,一般8~10 cmH2O(可高于基础PEEP水平3~4 cmH2O);吸气时间0.5~1.0 s;呼吸频率10~30次/min[8]。
1.4.1 记录两组患儿机械通气时间,无创通气模式及通气时间。
1.4.2 记录两组患儿在撤机后不同时间段(1 h、6 h、12 h、24 h、48 h、72 h)PaCO2结果。
1.4.3 记录观察组患儿在撤机后不同时间段(1 h、6 h、12 h、24 h、48 h、72 h)TcpCO2稳定后数值。
1.4.4 计算两组患儿在24 h内、48 h内及总72 h内撤机失败率。
采用SPSS 20.0软件进行数据分析,计量资料以均值±标准差(Mean±SD)表示,组间比较采用t检验;计数资料组间比较采用卡方检验,两变量间的相关性用Pearson相关系数分析,P<0.05为差异有统计学意义。
两组患儿在性别、胎龄、出生体重、孕母产前是否应用糖皮质激素、Apgar评分等方面比较,差异无统计学意义(P>0.05),具有可比性。在有创机械通气时间、无创通气模式及时间方面比较差异无统计学意义(P>0.05),见表1。
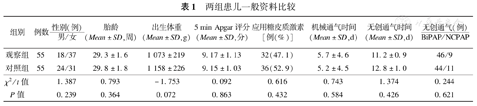
两组患儿一般资料比较
两组患儿一般资料比较
| 组别 | 例数 | 性别(例) | 胎龄(Mean±SD,周) | 出生体重(Mean±SD,g) | 5 min Apgar评分(Mean±SD,分) | 应用糖皮质激素[例(%)] | 机械通气时间(Mean±SD,d) | 无创通气时间(Mean±SD,d) | 无创通气(例) |
|---|---|---|---|---|---|---|---|---|---|
| 男/女 | BiPAP/NCPAP | ||||||||
| 观察组 | 55 | 18/37 | 29.3±1.6 | 1 073±219 | 9.17±1.13 | 32(47.1) | 5.7±4.6 | 11.2±0.9 | 46/9 |
| 对照组 | 55 | 24/31 | 29.8±1.8 | 1 158±226 | 9.15±1.03 | 36(52.9) | 5.2±4.5 | 12.8±1.0 | 44/11 |
| χ2/t值 | 1.387 | 0.793 | -1.753 | 0.092 | 0.616 | 0.743 | 1.374 | 0.244 | |
| P值 | 0.239 | 0.364 | 0.072 | 0.863 | 0.432 | 0.584 | 0.426 | 0.621 |
两组患儿在24 h及总72 h内撤机失败率比较,观察组低于対照组(3.6%比14.0%,7.3%比21.0%),差异有统计学意义(P<0.05),见表2。
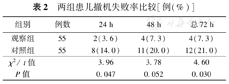
两组患儿撤机失败率比较[例(%)]
两组患儿撤机失败率比较[例(%)]
| 组别 | 例数 | 24 h | 48 h | 总72 h |
|---|---|---|---|---|
| 观察组 | 55 | 2(3.6) | 4(7.3) | 4(7.3) |
| 对照组 | 55 | 8(14.0) | 11(20.0) | 12(21.0) |
| χ2/ t值 | 3.96 | 3.78 | 4.60 | |
| P值 | 0.047 | 0.052 | 0.030 |
两组患儿在撤机后6 h、12 h、24 h的血气PaCO2观察组低于对照组,差异有统计学意义(P<0.05),在1 h、48 h、72 h两组间PaCO2差异无统计学意义(P>0.05),见表3。
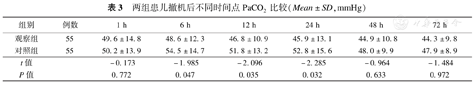
两组患儿撤机后不同时间点PaCO2比较(Mean±SD,mmHg)
两组患儿撤机后不同时间点PaCO2比较(Mean±SD,mmHg)
| 组别 | 例数 | 1 h | 6 h | 12 h | 24 h | 48 h | 72 h |
|---|---|---|---|---|---|---|---|
| 观察组 | 55 | 49.6±14.8 | 48.6±12.3 | 46.8±10.9 | 45.9±13.1 | 44.9±10.8 | 44.3±9.8 |
| 对照组 | 55 | 50.2±13.9 | 54.5±14.7 | 51.8±13.2 | 52.8±15.6 | 48.0±9.9 | 47.9±8.9 |
| t值 | -0.173 | -1.985 | -2.096 | -2.285 | -0.964 | -1.484 | |
| P值 | 0.772 | 0.047 | 0.035 | 0.032 | 0.633 | 0.972 |
观察组患儿在撤机后在不同时间点,TcpCO2与PaCO2比较差异均无统计学意义(P均>0.05),见表4。
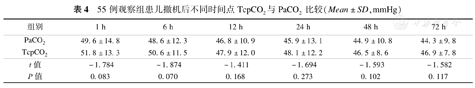
55例观察组患儿撤机后不同时间点TcpCO2与PaCO2比较(Mean±SD,mmHg)
55例观察组患儿撤机后不同时间点TcpCO2与PaCO2比较(Mean±SD,mmHg)
| 组别 | 1 h | 6 h | 12 h | 24 h | 48 h | 72 h |
|---|---|---|---|---|---|---|
| PaCO2 | 49.6±14.8 | 48.6±12.3 | 46.8±10.9 | 45.9±13.1 | 44.9±10.8 | 44.3±9.8 |
| TcpCO2 | 51.8±13.3 | 50.6±11.5 | 47.9±12.0 | 48.1±12.2 | 46.5±8.6 | 46.9±7.8 |
| t值 | -1.784 | -1.874 | -1.411 | -1.694 | -1.593 | -1.582 |
| P值 | 0.083 | 0.070 | 0.168 | 0.273 | 0.102 | 0.117 |
记录观察组患儿在撤机后不同时间段同一时间点的TcpCO2与PaCO2数值,进行Pearson相关性分析发现两者具有相关性(r=0.761),差异有统计学意义(P<0.05)。
近年来随着新生儿抢救技术的提高,NICU中早产儿尤其是VLBW和ELBW比例逐渐增加,机械通气可以明显改善早产儿呼吸窘迫症状,但长时间机械通气会对早产儿造成多种并发症,因此主张尽早拔管。拔管撤机后早产儿由于呼吸肌疲劳、肺泡萎陷、胎龄等因素,极易出现高碳酸血症而导致拔管失败[9]。正常新生儿PaCO2波动在35~45 mmHg,近年来大量研究虽然表明允许性高碳酸血症可以减少新生儿呼吸系统疾病的肺损伤,并可以保护脑细胞[10],但由于新生儿脑血管对PaCO2具有较强的敏感性,持续PaCO2升高会导致血脑屏障通透性增加,脑血流增加及自我调节功能丧失,严重可诱发颅内出血。同时严重的高碳酸血症会导致交感神经兴奋、心律失常、心肌收缩力受抑制,肺血管收缩、肺循环阻力增加等不良影响。因此,保持撤机后早产儿相对稳定的PaCO2水平十分重要[11,12]。目前,NICU中主要应用动脉血气分析监测PaCO2,由于其为有创性操作,早产儿皮肤薄嫩,尤其VLBW和ELBW反复采集血气可增加感染风险,同时带来不良刺激,而且动脉血气仅能进行时间点监测,不能连续动态监测以及时发现病情变化。
TcpCO2监测技术作为一种新的无创监测PaCO2的方法近年来逐渐应用于临床,早在1980年,有学者开始尝试TcpCO2及TcpCO2监测[13],并不断发展和完善该技术。其主要原理是通过加热安置在皮肤表面的电极,使局部毛细血管扩张,皮肤通透性增加,血流增加,毛细血管动脉化,血管中气体经血管壁、组织间隙,通过皮肤逐层弥散进入电极,最终测得皮下组织的氧和二氧化碳分压[14]。
近年来一些研究证实,TcpCO2、TcpO2与PaCO2、PaO2之间有较好的相关性和一致性,同时体重、胎龄、氧浓度等对经皮监测与动脉血气间的影响在可接受范围内,被广泛应用于NICU[3,4,5,6]。TcpCO2监测可以动态连续地对PaCO2水平进行监测,早期发现高碳酸血症。一项前瞻性随机对照研究显示,在转运途中使用TcpCO2监测的新生儿,具有较低的呼吸机参数(-1.5 cmH2O比+ 0.6 cmH2O,P=0.04),到达目的地时血气分析结果更加理想,可以认为经皮无创监测对改善呼吸障碍新生儿的近期结局有积极意义[15]。
本研究患儿均为生后因呼吸窘迫进行机械通气后撤机,在撤机后均积极给予无创辅助通气,保证充分氧合,而且血流动力学稳定。本研究患儿在24 h及总72 h内撤机失败率观察组低于对照组,差异有统计学意义,24 h内是撤机后患儿最易发生高碳酸血症导致撤机失败的时间,在这段时间内对患儿进行连续TcpCO2监测,及时发现高碳酸血症并给予处置,避免患儿持续高碳酸血症导致的呼吸衰竭,可以明显减少患儿撤机失败率。同时,对于撤机后不同时间段进行两组血气PaCO2对比分析,在1 h时观察组与对照组的PaCO2差异无统计学意义,可能因为在撤机后1 h观察组进行经皮监测数值趋于稳定时间较短,并无过多处置,因此两组间无明显区别。但在6 h、12 h、24 h时观察组的血气PaCO2数值低于对照组,差异有统计学意义,因为早期的高碳酸血症可无明显临床表现,间断的血气分析会错过患儿病情变化,导致出现高碳酸血症临床表现时才得到重视。观察组通过持续监测TcpCO2及时发现高碳酸血症,并积极处置,使患儿的呼吸情况得以改善。在撤机后48 h及72 h时两组患儿的PaCO2差异无统计学意义,考虑可能由于病情相对较轻的患儿进行无创辅助通气支持后撤机成功,短时间内不会再发生高碳酸血症,病情较重者已经给予及时地机械通气治疗,后续不再纳入研究,因此,总体两组间PaCO2差异不大。但是,在撤机失败率中对照组在48~72 h内仍然高于观察组,本研究样本量偏少,差异不具有统计学意义,日后可以扩大样本量进一步分析研究。最新的研究也指出,在急性呼吸衰竭患者中TcpCO2不仅可以提供连续的变化趋势,同时可以允许一定pH预测,但在pH计算公式Henderson-Hasselbalch中,结果受碳酸氢根因素影响,因此,该pH预估仅限于内环境相对稳定情况,在混合性和代谢性酸中毒中并不适用[16]。本研究观察组中撤机失败患儿均为TcpCO2监测提示高碳酸血症经积极处置后仍无效复采血气符合上机标准(PaCO2>60~70 mmHg伴有pH<7.25)的患儿,因此,可以认为撤机后经皮监测下持续的不可改善的高碳酸血症对于提示pH值有一定意义。
TcpCO2监测与血气分析具有良好的相关性,加之早产儿皮肤薄嫩,皮下脂肪较少,气体弥散功能更强,监测数值更为准确。Sandberg等[3]对46例VLBW进行TcpO2、PaO2及TcpCO2、PaCO2同步监测,证实TcpO2与PaO2和TcpCO2与PaCO2在VLBW监测中具有良好的相关性(TcpO2-PaO2=0.3 kPa;TcpCO2-PaCO2=0.4 kPa,P<0.05)。本研究中TcpCO2与PaCO2之间具有良好的相关性(r=0.765),而且TcpCO2与PaCO2间差异无统计学意义。本研究中多数TcpCO2数值高于PaCO2数值,与理论情况一致,主要是由于组织中的二氧化碳分压高于血液,局部电极加热后组织代谢率增高,使CO2释放增多[17]。同时,CO2在不同温度下溶解度有差异,温度每升高1 ℃,TcpCO2约升高4.5%。另外,健康的皮肤组织自身新陈代谢会产生一定的CO2(约4 mmHg),从而使TcpCO2升高[18]。
虽然TcpCO2与血气分析具有良好的相关性,但监测结果受患儿呼吸系统功能,循环系统障碍,组织氧含量,监测部位及局部皮肤情况等多种因素影响。当患儿存在严重低血压、低体温,使用血管活性药物以及存在严重水肿时,均可能出现TcpCO2、TcpO2监测结果与PaCO2、PaO2相差较大[19]。另一个影响经皮监测数值的重要因素为局部皮肤温度[20],本研究中所选早产儿为VLBW或ELBW,温度设定在42℃,并每隔1~2小时更换1次电极,所有患儿未出现局部烫伤及压力性坏死等不良反应。
综上,在撤机后给予患儿持续动态的TcpCO2监测,不仅具有无创连续的特点,也能及早发现高碳酸血症并给予对症处理,减少患儿撤机失败率,同时证实TcpCO2与PaCO2具有较好的相关性。但TcpCO2监测对复杂病情变化下经皮的监测准确性仍需进一步研究。
所有作者均声明不存在利益冲突



























