
探讨儿童呼吸道腺病毒感染的临床特征及流行病学情况,为本地区腺病毒感染的诊断、监测及防治提供依据。
选取2016年11月至2017年11月在上海儿童医学中心住院的呼吸道感染病例样本775例,通过FilmArray检测84例为腺病毒感染。
775例病例中检出84例腺病毒感染,阳性率10.8%。腺病毒感染全年散发,流行高峰为冬春夏季,尤其是冬季检出率20.8%,1月份检出率最高32.2%。发病年龄以6个月~2岁为主(占47.7%)。常见临床表现为发热(91.7%)、咳嗽(96.4%)、喘息(48.8%)、气促(14.2%)。15例(17.9%)伴有基础疾病,其中伴先天性心脏病最多(9例,10.7%)。混合感染53例(63.1%),合并人鼻病毒/肠病毒比例最高(21例,25.0%)。诊断上呼吸道感染5例,支气管炎3例,肺炎76例,其中轻症肺炎55例,重症肺炎21例。平均住院时间为8.3 d。混合感染组住院天数、喘息例数、重症病例数明显高于单一感染组(P<0.05)。重症组住院天数、喘息症状、肺外症状、存在基础疾病、混合感染明显高于轻症组,差异有统计学意义(P<0.05)。
腺病毒感染好发于6个月~2岁儿童,冬春夏季高发,1月份为感染高峰。临床表现以高热、咳嗽、喘息为主。有基础疾病、喘息症状、肺外症状、混合感染的患儿更易进展为重症。FilmArray检测系统可以快速、准确检测病原,为临床医师早期诊断、监测及防治提供依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
腺病毒(adenovirus,ADV)是一种双链无包膜的DNA病毒,在自然界普遍存在,多引起呼吸道感染,但在婴幼儿可引起严重的腺病毒肺炎[1],重症肺炎占19.3%[2]。不同国家、地区、季节感染情况存在差异,主要以常年散发为主,也有局部地区爆发流行[3]。近几年临床上ADV引起的肺炎患儿明显增多,聚集性发病也层出不穷,加强对ADV的监测,了解其流行及感染特征十分必要。本研究采用FilmArray方法对儿童急性呼吸道感染样本进行了ADV的检测分析,对比分析了ADV感染的流行病学、合并感染和轻重症感染的临床特征,为本地区ADV感染的防控提供资料。
收集2016年11月至2017年11月上海交通大学医学院附属上海儿童医学中心急诊病区、呼吸科及PICU住院的急性呼吸道感染患儿的鼻咽拭子或痰标本775份,其中FilmArray检测ADV阳性标本84份。社区获得性肺炎和重症肺炎的诊断参照中华医学会儿科学分会呼吸学组2013年修订的诊断标准[4]。
入院后监测患儿的发病季节、年龄、临床表现、实验室检查结果、治疗情况等。
采集所有病例的鼻咽拭子或痰标本于30 min内送至检验室,将试剂缓冲液和标本混合液注入测试条插入FilmArray检测系统(生物梅里埃公司生产)中鉴定,65 min可得到检测结果。FilmArray检测系统可全面检测20种病原体:ADV、冠状病毒(229E型、HKU1型、OC43型、NL63型)、甲型流感病毒(H1亚型、H1-2009亚型、H3亚型)、乙型流感病毒、人偏肺病毒、副流感病毒(1型、2型、3型、4型)、呼吸道合胞病毒、人鼻病毒/肠病毒、百日咳鲍特菌、肺炎衣原体和肺炎支原体。
采用SPSS 21.0统计软件分析,计量资料以均数±标准差(Mean±SD)表示,组间比较采用t检验,计数资料以例(%)表示,两样本间率的比较采用χ2检验,P<0.05为差异有统计学意义。
2016年11月至2017年11月期间本院确诊呼吸道感染病例数775例,均进行FilmArray检测,ADV阳性84例,阳性率10.8%。其中男49例(58.3%),女35例(41.7%),男女比1.4∶1。男性患儿检出率为11.4%(49/430),女性患儿检出率为10.1%(35/345),不同性别患儿ADV的检出情况差异均无统计学意义(χ2=0.310, P=0.578)。
年龄2个月~12岁,中位年龄1.8岁。年龄分组:<6个月8例(9.5%),6个月~2岁40例(47.7%),2~5岁25例(29.8%),>5岁11例(13.1%)。<6个月ADV检出率3.4%(8/238),6个月~2岁检出率最高17.5%(40/229),2~5岁检出率11.1%(25/226),>5岁检出率6.6%(11/166)。不同年龄组ADV检出率存在显著差异(χ2=28.745,P<0.001)。
在2016年11月至2017年11月的整个研究期间,除10月外,每月均检测到ADV,冬季达峰值。春、夏、秋、冬各个月ADV检出率分别为8.8%(19/217)、11.0%(18/163)、3.4%(7/203)和20.8%(40/192),四个季节检出率差异有统计学意义(χ2=25.337,P<0.001),2017年1月ADV检出率最高为32.2%(19/59)。见图1。


84例ADV感染患儿中,发热症状突出,本组患儿中77例(91.7%)有不同程度发热,其中>39 ℃者68例(88.3%),热程1~38 d,平均为7.9 d,热程>1周36例(46.7%)。除有咳嗽81例(96.4%)、喘息41例(48.8%)的肺部症状外,尚有部分患儿出现肺外症状,出现腹泻、呕吐等消化道症状13例(15.5%),肝功能损害9例(10.7%),心肌损害2例(2.4%),2例(2.4%)出现多器官功能衰竭。15例(17.9%)有基础疾病,其中先天性心脏病所占比例(9例,10.7%)最高。外周血白细胞计数范围(2.37~45.92)×109/L,其中25例(29.8%)白细胞计数升高,4例(4.8%)白细胞计数下降。53例(63.1%)CRP升高>8 mg/L,20例(23.8%)PCT升高>0.5 ng/ml, 50例(59.5%)血沉增快>20 mm/h。14例(16.7%)胸部CT以肺实变为主,5例(6.0%)以间质性改变为主,伴肺不张者3例,伴胸腔积液者4例。住院时间2~37 d,平均为8.3 d。经治疗后,81例(96.4%)患儿好转出院,1例患儿查出结核转院治疗,2例患儿死亡。
84例均行FilmArray检测,31例(36.9%)单一ADV感染,53例(63.1%)与其他病原混合感染,包括38例(45.2%)ADV合并一种病原体,12例(14.3%)ADV合并两种病原体,3例(3.6%)ADV合并3种病原体感染。混合感染中合并人鼻病毒/肠病毒比例最高21例(25.0%),其次为副流感病毒(1型、2型、3型、4型)17例(20.2%),肺炎支原体9例(10.7%),呼吸道合胞病毒8例(9.5%),甲型流感病毒7例(8.3%),人偏肺病毒4例(4.8%),乙型流感病毒2例(2.4%),百日咳鲍特菌2例(2.4%)。痰培养提示细菌感染10例,占11.9% 。
腺病毒单一感染和混合感染的临床症状进行比较,发现住院天数和喘息例数,重症病例数混合感染组明显高于单一感染组,差异有统计学意义(P<0.05),2例死亡均为混合感染组。见表1。
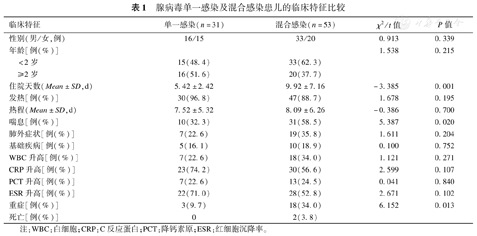
腺病毒单一感染及混合感染患儿的临床特征比较
腺病毒单一感染及混合感染患儿的临床特征比较
| 临床特征 | 单一感染(n=31) | 混合感染(n=53) | χ2/t值 | P值 | |
|---|---|---|---|---|---|
| 性别(男/女,例) | 16/15 | 33/20 | 0.913 | 0.339 | |
| 年龄[例(%)] | 1.538 | 0.215 | |||
| <2岁 | 15(48.4) | 33(62.3) | |||
| ≥2岁 | 16(51.6) | 20(37.7) | |||
| 住院天数(Mean±SD,d) | 5.42±2.42 | 9.92±7.16 | -3.385 | 0.001 | |
| 发热[例(%)] | 30(96.8) | 47(88.7) | 1.678 | 0.195 | |
| 热程(Mean±SD,d) | 7.52±5.32 | 8.09±6.26 | -0.386 | 0.700 | |
| 喘息[例(%)] | 10(32.3) | 31(58.5) | 5.387 | 0.020 | |
| 肺外症状[例(%)] | 7(22.6) | 19(35.8) | 1.611 | 0.204 | |
| 基础疾病[例(%)] | 5(16.1) | 10(18.9) | 0.100 | 0.752 | |
| WBC升高[例(%)] | 7(22.6) | 18(34.0) | 1.121 | 0.271 | |
| CRP升高[例(%)] | 23(74.2) | 30(56.6) | 2.599 | 0.107 | |
| PCT升高[例(%)] | 7(22.6) | 13(24.5) | 0.041 | 0.840 | |
| ESR升高[例(%)] | 22(71.0) | 28(52.8) | 2.671 | 0.102 | |
| 重症[例(%)] | 3(9.7) | 18(34.0) | 6.152 | 0.013 | |
| 死亡[例(%)] | 0 | 2(3.8) | |||
注:WBC:白细胞;CRP:C反应蛋白;PCT:降钙素原;ESR:红细胞沉降率。
84例ADV感染患儿诊断上呼吸道感染5例,支气管炎3例,肺炎76例,其中轻症肺炎55例,重症肺炎21例。轻重症两组患儿临床症状比较,发现重症ADV肺炎患儿住院天数、喘息例数、肺外症状、存在基础疾病、混合感染,明显高于轻症组,差异均有统计学差异(P<0.05),见表2。
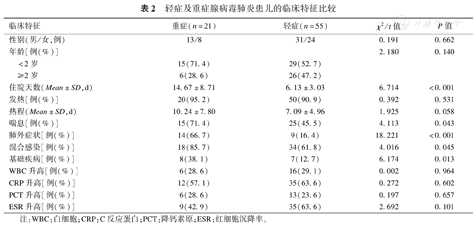
轻症及重症腺病毒肺炎患儿的临床特征比较
轻症及重症腺病毒肺炎患儿的临床特征比较
| 临床特征 | 重症(n=21) | 轻症(n=55) | χ2/t值 | P值 | |
|---|---|---|---|---|---|
| 性别(男/女,例) | 13/8 | 31/24 | 0.191 | 0.662 | |
| 年龄[例(%)] | 2.180 | 0.140 | |||
| <2岁 | 15(71.4) | 29(52.7) | |||
| ≥2岁 | 6(28.6) | 26(47.2) | |||
| 住院天数(Mean±SD,d) | 14.67±8.71 | 6.13±3.03 | 6.714 | <0.001 | |
| 发热[例(%)] | 20(95.2) | 50(90.9) | 0.392 | 0.531 | |
| 热程(Mean±SD,d) | 10.24±7.80 | 7.09±4.96 | 1.925 | 0.058 | |
| 喘息[例(%)] | 15(71.4) | 25(45.5) | 4.113 | 0.043 | |
| 肺外症状[例(%)] | 14(66.7) | 9(16.4) | 18.221 | <0.001 | |
| 混合感染[例(%)] | 18(85.7) | 34(61.8) | 4.016 | 0.045 | |
| 基础疾病[例(%)] | 8(38.1) | 7(12.7) | 6.174 | 0.013 | |
| WBC升高[例(%)] | 6(28.6) | 16(29.1) | 0.002 | 0.964 | |
| CRP升高[例(%)] | 12(57.1) | 35(63.6) | 0.272 | 0.602 | |
| PCT升高[例(%)] | 6(28.6) | 13(23.6) | 0.197 | 0.657 | |
| ESR升高[例(%)] | 9(42.9) | 35(63.6) | 2.692 | 0.101 | |
注:WBC:白细胞;CRP:C反应蛋白;PCT:降钙素原;ESR:红细胞沉降率。
ADV是引起儿童急性呼吸道感染的常见病原体之一。本研究报道了2016年11月至2017年11月我院呼吸道感染患儿中ADV检出率为10.8%,高于北京地区检出率5.64%[5]、深圳地区检出率2.24%[6],但远远低于南京地区报道的26.55%[7]。各地的检出率差异可能与选取研究对象的年龄、时间和地理环境差异有关,也与检测方法有关,本研究采用的是FilmArray检测技术,其灵敏度、特异度高,因此ADV阳性检出率较高。
ADV感染由于地域不同,在世界不同地区可能存在流行季节的差异,南半球的高发季节为1~11月,而北半球的高发季节为12月至次年3月[8]。在国内,南北方感染也存在地区性和季节性的差异,北方地区如北京2017至2018年调查发现,ADV感染全年散发,流行季节为夏季(9.52%,6~8月),8月检出率最高(10.91%)[5];与天津地区,ADV感染集中在夏季报道一致[9]。南方地区如苏州地区2006至2015年ADV感染以春、夏季为主[10];广州地区报道显示,ADV感染四季均可发生,其发病高峰主要在夏季[11]。本研究儿童ADV感染全年散发,以冬、春、夏季为主,并以冬季(1月份)检出率相对较高。不同地区气候的不同,ADV呼吸道感染的季节也不同,提示ADV的活性与气候因素关系密切。
本组资料显示以6个月~2岁婴幼儿患病为主,好发年龄与国外报道[12]相似;但6个月以内婴儿较少见,这可能与母体胎传的ADV特异性抗体有关,而6个月以后缺乏保护性抗体。本组患儿临床表现主要为高热、咳喘,且急性期多表现为稽留热或不规则高热,88.3%患儿最高体温超过39 ℃以上,与我国台湾省的报道相符[13]。29.8%患儿WBC升高,53.6%中性粒细胞升高,63.1%CRP升高,原因与ADV感染后,其免疫反应强烈和细胞因子活性更强有关[14],且ADV感染与细菌感染的临床表现相似,难以鉴别[15]。因此,强调对ADV肺炎的早期识别及病毒检测,避免盲目使用或升级高级广谱抗生素。
有研究表明,年龄<7岁、慢性基础疾病、移植后或免疫功能低下等,可加重重症ADV肺炎的发生风险[16]。本组对ADV感染的重症肺炎患儿及轻症肺炎患儿临床资料进行比较,发现住院天数、喘息例数、肺外症状、存在基础疾病、混合感染方面有显著差异。提示存在基础疾病、喘息、有肺外症状、混合感染的患儿更易发展为重症。本组有2例死亡,其中1例存在严重基础疾病(血液病及免疫缺陷),另1例合并支原体感染。本组肺外症状主要为消化道症状,其次为心肌损害。肺外并发症的发生与婴幼儿各器官和免疫系统发育不成熟有关,尤其是细胞免疫功能不完善,ADV易入血形成病毒血症,损伤多系统功能,其中循环系统和消化系统最易受侵袭,多项研究也表明ADV是病毒性心肌炎、病毒性腹泻的重要病原,ADV引起的病毒性心肌炎及腹泻越来越被重视[17,18]。本研究ADV肺炎患儿中混合感染率达63.1%,我国台湾地区2002至2011年对ADV感染患儿的研究发现其混合感染率为19%[19],而2012年广东省疾控中心的研究结果却高达64%[20]。结果的不同提示呼吸道ADV感染在儿童中可能存在地域性差异,及检测方法的差异。本研究单一感染组与混合感染组比较发现,混合感染的比例重症组明显高于轻症组,混合感染的住院时间、喘息比例明显高于单一感染。因此,临床医师应警惕在ADV肺炎的病程中同时合并其他病原体感染,导致病情加重,病程延长,治疗更加困难。
目前临床呼吸道病原的检测方法主要为免疫学、常规PCR测定、病毒分离培养等方法。但因各自的不足使其难以满足临床病原学检验要求。本研究采用FilmArray系统进行检测,该系统是早在2011年就获得美国FDA认证的自动巢氏多重PCR系统,集核酸提取、制备、扩增、检测和分析功能于一体,约1h就可检测20种呼吸道病原体。国外有研究发现FilmArray呼吸道病毒检测比免疫荧光法有更高的灵敏度[21];同时另一项大型研究也发现FilmArray在呼吸道病毒检测方面的总体表现优于传统的直接荧光抗体法[22];也有研究发现与传统多重PCR相比,FilmArray检测混合病毒感染的灵敏度更高,操作更简单,检测时间更短[23,24]。因此,FilmArray在呼吸道病原诊断方面具有快速、灵敏度高、特异度强的特点,为呼吸道病原的快速诊断提供实验室依据。
综上所述,6个月~2岁婴幼儿是ADV感染的好发人群,ADV全年散发,冬、春、夏季高发。临床表现以高热、咳嗽、喘息为主。有基础疾病、喘息症状、肺外症状、混合感染的患儿更易进展为重症,有助于临床医师识别重症病例。FilmArray检测系统可以快速、准确检测病原,为临床医师早期诊断,监测及防治提供依据。
所有作者均声明不存在利益冲突



























