急性感染早期准确鉴别细菌和病毒感染一直是临床面临的挑战,随着临床各种检验、检测技术的快速发展、长足进步,越来越多的病原学、人体基因学、分子生物学指标用于鉴别细菌与病毒感染。未来将有更多的检测指标采用床旁即时检测方式便于临床应用;将有更精准、丰富的生物医学信息平台和更高效的医院信息系统,进行多指标综合分析,提供更精准的病原诊断,有助于最佳临床实践的实施。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性感染是儿科临床最常见问题,导致感染的最常见病原是细菌(真菌)和病毒。感染早期临床表现缺乏病原特异性,但细菌与病毒感染的临床经过、治疗措施差异明显,早期鉴别有利于尽早实施适宜治疗,避免抗菌药物滥用,减少临床误判风险。仔细分析评估临床表现及基本辅助检查信息,进行有鉴别意义的检测是目前可行方法。鉴别细菌及病毒感染的检测方法和技术近年来快速发展,是本领域具有临床实用价值的重大进展。
急性感染早期临床表现,病原特异性不强。但病史、体格检查、基本辅助检查信息的仔细采集和分析,对判断感染病原有重要意义,并为进一步评估及处置提供方向。
某些病毒感染具有季节流行和集中流行特征,如呼吸道合胞病毒、流感病毒流行多发生在冬春季;肠道病毒、虫媒病毒主要流行于夏秋季;诺如病毒、轮状病毒主要流行于秋冬季;麻疹病毒感染主要见于春季[1]。流行病学背景加上特征性临床表现,可初步进行病原分析。大多数细菌感染季节流行性远不如上述病毒感染明显。具有季节流行性是病毒感染突出特征之一,流行病学资料是判断感染病原的重要信息。
某些病毒感染具有特征突出的临床经过,如发热与出疹间隔、出疹顺序、皮疹特点、退热时间、特异性体征等。具有上述特征的病毒感染性疾病有麻疹、风疹、水痘、幼儿急疹、手足口病、流行性腮腺炎等。某些细菌感染也具有特征性临床改变,如链球菌感染出现粟粒性充血性皮疹,铜绿假单胞菌血流感染出现深脓疱疮,金黄色葡萄球菌感染与皮肤脓疱及组织坏死,肺炎克雷伯菌感染与眼内炎均有密切相关性[2,3]。但许多阳性球菌均可产生红疹毒素,导致猩红热样皮疹;脓疱疮样皮疹,除铜绿假单胞菌感染外,其他感染,如恙虫感染等,也会出现类似皮疹。细菌感染病原相关特征性临床表现,不如病毒感染更具病原特异性,很难仅凭临床表现做出病原诊断,但却可以为进一步评估与初步抗菌药物选择提供方向与依据。有荟萃分析探讨呼吸道感染临床表现与微生物病原的关系,纳入符合要求的临床研究47项,时间跨度逾20年(1996至2017年),纳入病例49 858例,其中6 073例儿童,尽管典型临床特征与特定感染病原之间关系密切,如发热、头痛与流感病毒感染,咳嗽、喘息、呼吸困难与呼吸道合胞病毒感染有显著相关性,但仅凭临床特征不能明确病原诊断,实验室检测仍然是明确感染原的关键[4]。应鼓励临床进行适宜的病原学检测,以免出现不必要或缺乏针对性的抗感染治疗。未来,基于信息系统的症状组合决策模型,"智能"决策软件及针对性地病原诊断检测,可能更有助于提供最佳临床实践。
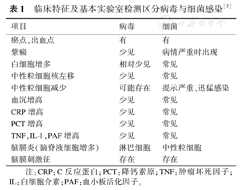
急性感染性疾病门急诊就诊,最基本的辅助检查不外乎血常规、C-反应蛋白(C-reaction protein,CRP)、血清降钙素原(procalcitonin,PCT)、血沉、尿常规、胸片、症状体征阳性部位的超声检查、头颅CT、脑脊液检查等。临床医生熟悉利用上述基本辅助检查信息,结合病史和体格检查,初步判断急性感染性质,大致区分细菌或病毒感染。如头颅CT影像显示脑膜影像对比度增强,往往提示感染,而非感染炎症性疾病较少累及脑膜;头颅MRI弥散加权成像有助于诊断颅内化脓性感染位置和特征,在区分细菌感染和其他病因方面有重要价值[5]。表1列举一些临床特征及基本辅助检查对鉴别细菌、病毒感染的意义。无论是实验室检测结果还是影像学资料,都缺乏病原特异性,各项指标单独进行细菌或病毒感染鉴别诊断,特异性不够,最终的病原学诊断还要依靠病原特异性更强的实验室检测。
PCT等较为常用的炎症标记物因临床医生比较熟悉,不在此说明。本节内容主要阐述近年已在临床应用或短期内可能临床应用,在明确病原诊断方面价值较高或前景良好的实验检测项目。应指出的是细菌培养及其药敏分析,仍然是确认细菌感染的金标准。
主要存在于人外周血中性粒细胞二级颗粒中,在肾、胃肠道、支气管、胸腺、胰腺等组织有少量表达,正常情况下体液HNL水平稳定,某些病理生理情况下,如细菌感染、宿主对移植物排异、急性肾损伤时,HNL由活化中性粒细胞或损伤上皮细胞释放至细胞外,致血或尿液等体液中HNL含量短时间内迅速升高。血中HNL主要来源于循环中性粒细胞,为双聚体;尿液HNL主要来源于肾小管上皮细胞,为单聚体,系急性肾损伤标记物。研究显示细菌感染早期血清HNL水平迅速升高,而病毒感染时无升高,其对诊断细菌感染的敏感性和特异性高于目前常用的中性粒细胞计数和CRP、PCT等非特异性感染炎症标记物,可作为鉴别急性细菌和病毒感染的一种新的有效标记物[6,7,8,9]。对细菌感染的良好鉴别能力限于血清HNL,EDTA-血浆无此特征,试管内中性粒细胞在血液标本采集后几小时内继续释放HNL,这种释放活性反映了细菌刺激而非病毒诱导的中性粒细胞激活状态。为能快速早期应用,全血标本是更好的选择。采用全血标本,分析时间在10~20 min内,这是开发即时检验(point-of-care testing,POCT)的基本理念。有研究探讨HNL的POCT技术,采用甲酰蛋氨酸-亮氨酸-苯丙氨作为中性粒细胞激活剂,预激活全血中性粒细胞,使中性粒细胞释放已被细菌感染活化的颗粒。该方法与血清HNL变化高度一致,优于CRP、PCT、CD64。检测时间<15 min,具有高度实用价值[10]。
PCR的发展给病原微生物检测带来了革命性变化,通过PCR体外扩增病原微生物核酸,使高灵敏、高特异检测单个病原微生物成为现实。具有快速、简便、重复性好、易自动化等突出优点。PCR技术能在一个试管内将所要研究的目的基因或某一DNA片段于数小时内扩增至十万乃至百万倍,是分子生物学领域的里程碑,在明确病毒或细菌病原诊断方面发挥极其重要作用。PCR技术经过30余年的发展,从最初的手动/机械手式水浴基因扩增,到目前广泛应用的实时定量PCR为代表的定量、自动、快速检测,乃至数字PCR、多重PCR,有近20种PCR技术面世。在感染病原诊断领域,PCR技术从静态到动态、从定性到定量,其检测越来越精准,所需时间越来越短,相关临床研究不胜枚举[11,12]。未来将朝着高通量、多通道、多功能、短时间、床边化发展。应注意的是,细菌、病毒死亡后,其核酸成分可能存留数日甚至更久,检测结果判读应注意结合临床变化。
NGS具有高通量、多病原特点。包括全基因组测序(whole-genome sequencing,WGS)、全外显子组测序(whole-exome sequencing,WES)、目标区域测序(targeted regions sequencing,TRS)和宏基因组测序(metagenomics Sequencing,MS)。可在1次测试中运行多个病原体,也可分析一个患者的多菌种临床样本。随技术进步,其测试成本明显降低。可用于医院感染性疾病暴发调查、未知病原体的鉴定、监测病原体特性变化及传播途径;针对临床个体患者,可发现常规极少检测的特殊病原体。在检测技术灵敏性良好的前提下,其阴性可助于除外相关感染,其阳性结果特异性及与临床现存感染的关系需仔细分析、判读[13,14]。
宿主对细菌和病毒感染的免疫炎症过程有很多共同之处,但在病原识别、炎症信号传导通路上也存在病原特异性差异,这种宿主对细菌、病毒免疫应答差异产生的病原特异性生物标记物对二者的鉴别诊断有重要意义。随着对感染免疫炎症过程研究的深入,对不同病原免疫应答路径的解析,相应的标记物也不断出现。有研究根据病毒和细菌病原分子模式识别受体不同,触发免疫应答通路差异,采用新型基因芯片技术,通过检测血液白细胞转录组在病毒和细菌感染时表达差异进行鉴别诊断。上述技术应用,是基于基因检测数据管理和分析能力巨大提高,数据分析复杂性的解决和技术成本降低。研究证实急性病毒和细菌感染儿童血液白细胞的RNA携带有病原特异性的转录特征。多种病原的感染转录特征被发现,并在疟疾、登革热、沙门氏菌感染、呼吸道合胞病毒感染、流感、结核和艾滋病患者得到验证。转录组分析也是探讨特定感染发病机制和临床病情严重程度分层的宝贵工具。明确特定病原白细胞转录组表达特征基础上,设定病毒或细菌特异性探针,可确定特定病毒和细菌病原[15,16,17]。不仅仅限于病毒、细菌感染转录组基因特性分析,采用最新基因芯片技术分析病毒、细菌感染宿主外周血基因表达差异,筛选出特异性表达成分,称为基于基因表达分类成分(gene expression-based classifiers),进行鉴别诊断,取得良好效果。一种病毒或细菌感染,这种基因表达分类成分的特异性改变可达30至70余种,多种基因表达成分差异,如何选取、分析成为技术关键。可用于鉴别细菌和病毒感染,也可用于明确具体病毒、细菌感染。随分析技术不断发展进步,未来也许会产生床旁检测应用[18,19]。黏液病毒抗性蛋白A(myxovirus resistance protein A,MxA)是由Ⅰ型干扰素(IFNα/β)诱导产生的分布于细胞质中的蛋白质,具广谱抗病毒作用,对多种RNA病毒和部分DNA病毒有抑制作用。Ⅰ型干扰素仅在病毒感染时表达增加,因此,病毒感染时血清MxA水平明显升高。法国一项前瞻性多中心儿科临床观察研究,利用血清MxA水平在16岁以下儿童鉴别病毒与细菌感染。结果显示,MxA诊断阈值为200 μg/L时,区分未感染和病毒感染者的ROC曲线下面积为0.98,敏感性和特异性分别为96.4%和85.4%;区分细菌和病毒感染者ROC曲线下面积为0.89,敏感性和特异性分别为96.4%和66.7%[20,21]。
组学技术为在不同分子水平寻找病毒或细菌特异性标记物提供可能。分别以DNA、RNA、蛋白质和代谢物为研究对象衍生出基因组学、转录组学、蛋白质组学和代谢组学。基因组和转录组相对稳定,主要反映生物学活动可能性,前述的NGS、血液白细胞转录组分析均属于此。蛋白质组和代谢组在感染发生、发展过程中动态、实时变化,体现正在和已经发生的生物学活动。蛋白质组学、代谢组学成为感染病原鉴别的研究热点之一,为病原诊断提供了新路径和方法。蛋白质组(proteome)指一种基因组表达的全套蛋白质。蛋白质组学(proteomics)是采用高通量蛋白质分离和鉴定技术,研究细胞内全部蛋白质的组成及其活动规律。蛋白质组学主要技术包括蛋白质分离技术、蛋白质鉴定技术和生物信息学分析。蛋白质分离:包括双向凝胶电泳、高效液相色谱、毛细管电泳和毛细管色谱等。生物质谱是蛋白质鉴定的核心技术。其在研究病原体蛋白质组信息、宿主对病原免疫反应过程及病原和宿主间蛋白相互作用方面出现越来越多的成果。在SARS冠状病毒、流感病毒、人类免疫缺陷病毒、布氏杆菌、结核杆菌等病原诊断上发挥重要作用。随研究深入,可能发现更多病原特异性早期诊断分子标识[17,22,23,24]。代谢物是在机体代谢全过程中产生的小分子物质(分子质量<1 000),与细胞生化过程密切相关,是特定条件下基因与环境间复杂相互作用的产物。感染过程涉及一系列代谢变化。代谢组学是对机体的动态代谢状态进行定量测定的技术,其涉及基因调控、酶活性改变和代谢反应变化。作为一种相对快速、准确的方法,代谢组学在发现感染病原早期诊断标记物等方面具有重要潜力。其优势在于感染导致的基因和蛋白质变化可通过下游诸多代谢产物得以放大,从而易于检测;小分子代谢产物是机体特定病原感染后产生一系列变化的终产物,直接反映机体病理生理状态。样本检测简便,易定量。其在结核菌感染、真菌感染、耐药菌感染等病原诊断中发挥重要作用[22,25,26]。随着生物信息数据分析平台技术进步,组学技术在感染病原诊断的准确、快速、高通量方面会有快速发展。
有研究采用红外光谱显微技术,观察18岁以下发热相关疾病患者全血标本处理后的血浆、WBC、红细胞红外光谱吸收差异。共364例,分对照、细菌感染、病毒感染三组,采用特定红外光谱范围和分辨率,以透射模式测量,高频次扫描。发现WBC平均红外吸收光谱在病毒与细菌感染组间有差异,其鉴别诊断的敏感性82%、特异性80%[27,28]。红外光谱技术是一种简单、快速的生化、物理工具,依生物样品特定吸收光谱,揭示其分子组成信息。WBC由病毒或细菌感染引起的免疫应答过程差异导致其生化成分差异,可用红外光谱来检测、监测。该方法采用末梢血成分,分析时间短,可能成为鉴别病毒与细菌感染的有效工具。新一代血球计数技术可对WBC体积、核浆比例、胞浆颗粒密度进行检测。有研究对比病毒和细菌感染患者上述三项指标,发现病毒与细菌感染时,末梢血WBC类型及上述参数有差异,对鉴别诊断有一定意义[29]。以色列的一项研究采用表面等离子体共振生物传感器技术检测大肠埃希菌O157∶H7和耐甲氧西林金黄色葡萄球菌,在不需要标记或者富集的情况下,20 min内可检测低至1 000 CFU/ml浓度的细菌[30]。
鉴别细菌和病毒感染,从临床表现区别到最新检测技术的应用,未来的发展方向首先是快速、便捷、床旁化,以便医生随时使用,早期判断,指导治疗。其次为系列指标的综合、组合判断,具有优异的特异性和敏感性,以提高病原诊断的准确性。
对病毒和细菌的鉴别诊断,需要快速、准确,早于经验性治疗。随着检测技术的快速发展、进步,越来越多的检测技术简化、快速,向床旁化发展,由医生或护士在床旁操作,15 min左右即可获得结果,便于早期判断病原。目前POCT技术包括侧流免疫层析法、实时聚合酶链式反应等,今后会有越来越多的分子生物学方法向床旁即时化发展[31,32]。随着POCT质量管理体系的不断完善,数据化、标准化不断发展,POCT技术将成为门急诊、基层早期感染鉴别诊断的主要方法之一。
迄今为止,尚无任何单一指标能早期、可靠地鉴别病毒与细菌感染,敏感性、特异性俱佳。解决办法是临床表现、多层面及多种检测技术结合的组合式方案,以提高鉴别诊断的准确性[8,23,33,34]。芬兰图尔库大学一研究团队,历时10年,基于血液多形核白细胞和其他吞噬细胞会依病毒或细菌感染发生不同的功能变化及表面受体表达差异,采用定量流式细胞仪先后分析10余项指标,发现结合CD10、CD35和CD282的组合指标其敏感性、特异性、假阳性率和真阳性率最佳。据此建立的细菌感染指数,其鉴别细菌和病毒感染的敏感性90%、特异性96%,检测时间40 min~1 h[35,36,37,38]。未来病原检测报告可能不是单项的病原学检测报告、生物标记物检测报告、临床表现分析,而是基于信息系统各方面数据的病原综合分析报告,甚至包含病原诊断的准确概率分析。
所有作者均声明不存在利益冲突