
感染是儿童最常见的疾病,也是困扰临床医生的主要问题。影像学检查是感染性疾病诊断和评估的重要手段,为疾病的早期诊断提供了客观的依据。影像学检查虽不能明确病原,但能为病原的判定提供重要线索,缩小可疑病原范围,为临床医生的经验性治疗提供依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
感染是儿童最常见的疾病,也是儿童致残致死的主要原因。由于抗生素和抗病毒药物的快速发展,绝大部分感染性疾病都有可能治愈,早期识别和诊断是治疗成功的前提和关键。诊断的困难之处在于很多时候临床症状和体征不足以明确儿童具体的感染部位和病原,微生物的检测又具有一定的滞后性。因此影像学检查仍然是感染性疾病早期诊断和病情评估的重要手段,能显著减少抗生素的使用、患者的住院时间和并发症[1],具有不可替代的重要地位。影像学检查虽不能明确病原,但能为感染性疾病的病原判定提供重要线索,缩小可疑病原范围,为临床医生的经验性用药提供依据,尤其是在困扰着临床医生的肺部感染和颅内感染方面作用显著。
影像学检查包括X线、CT、MRI、造影、超声、PET等多种方法。其中X线、CT、MRI是临床最常用的影像学检查方法,对感染性疾病的诊断和鉴别具有重要价值。
X线检查简便快捷、费用低廉,对肺部感染具有一定的特异性和敏感性,是肺部疾病筛查的首选工具。X线还能够评估病变范围,检测有无并发症。国内外所有的指南对需要住院的肺部感染患者均建议行胸部X线检查[2,3,4]。而对于轻症仅需门诊治疗的疑似肺炎患者,由于缺乏X线对预后产生重大影响的证据及考虑到儿童辐射暴露的问题,不建议常规行胸片检查[2,3,4,5]。美国儿童感染病协会和美国感染病协会在《3个月以上婴幼儿社区获得性肺炎管理指南》[3]中,推荐对疑似有低氧血症或呼吸窘迫或初始抗生素治疗失败的患儿行胸部前后位和外侧位检查。但英国胸科协会的指南指出尽管心脏、膈肌等掩盖了40%的肺野,也不建议行胸部侧位片检查[4]。
我国目前医疗环境下,日益增长的医患之间的不信任性,少部分患儿家属向医生提供的病史不可靠性和部分临床医生体格检查的不可靠性,导致X线使用更为普遍。但X线也有一定的局限性,通常在症状出现数小时内X线检查可能没有阳性表现[6,7]。
CT克服了X线2D的缺陷,对细微病灶更敏感,能够发现X线阴性的肺部感染[6]。Gerritsen等[7]研究发现,中性粒细胞减少的发热患者病程第1天胸部X线无异常者CT却有阳性发现。Heussel等[8]对感染部位不明的粒细胞减少伴发热的住院患者的研究发现,与胸片相比,胸部CT能帮助临床医生提前5 d做出肺炎的诊断。Upchurch等[6]研究发现胸片阴性而CT阳性的肺炎患者在疾病的病原体、严重程度和结局方面与胸片上有阳性表现的肺炎没有任何的差异。考虑到CT的辐射性,肺部感染CT检查的主要适应证为临床疑似肺炎而胸片表现正常或无特异性者,以及确定肺炎的并发症或潜在病变。
脑部感染方面,CT被用于评估腰椎穿刺前脑积水、颅内压升高的情况,发现与脑移位相关的疾病,如脑脓肿、硬膜下积液和大面积脑梗死,降低腰椎穿刺引起脑疝的风险。考虑到CT的辐射性,2016年欧洲的急性细菌性脑膜炎诊治指南推荐,有局灶性神经功能缺损(不包括颅神经麻痹)、新发癫痫发作、精神意识状态严重改变(GCS评分<10分)和严重免疫功能低下状态(如器官移植者和感染艾滋病者)的情况,建议腰椎穿刺前行头颅CT检查[9]。CT在评估颅内感染性疾病的进展、并发症、钙化、骨质侵蚀和破坏方面表现出众,有利于相关疾病的诊断。
MRI较CT具有无辐射的优点,但需较长时间镇静,费用昂贵。在肺部感染中,MRI使用不多,但需要反复多次断层影像学检查时,MRI是CT潜在的替代方式。
MRI对于中枢性感染性疾病的诊断和评估具有重要价值。能有效地区分脓肿、肉芽肿和肿瘤。对起源于颅底或鼻窦的感染,MRI可明确其来源。磁共振液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列对诊断脑膜炎有最高的敏感度。当颅内感染患者临床病情恶化或尽管采用了适当的治疗仍疗效欠佳时,MRI检查可以评估有无脑脓肿、积脓、硬膜下积液、血管炎、局灶缺血等感染相关并发症,为颅内感染治疗方案的调整提供影像学依据[10]。
影像学检查在确定感染原方面的价值有限,不能提供具体的病原学诊断。但某些特征性的影像学征象有助于缩小诊断和鉴别诊断的范围,利于锁定可疑病原,为临床医生在病原学诊断明确以前的经验性治疗提供线索。病原学判定的重点和难点主要集中在肺部和中枢感染,因此本文从肺部和中枢神经系统两方面探讨影像学对感染性疾病病原判断的价值。
肺部感染的病原主要为病毒、细菌、真菌、寄生虫等。病毒、支原体、衣原体主要累及肺间质,典型影像多为间质性肺炎,但也可累及肺实质。细菌性感染主要引起大叶性肺炎和支气管肺炎。由于相同的影像可见于不同的疾病,相同的疾病可有不同的影像。因此,我们从肺部典型的征象与常见的病原两个角度探讨影像学在肺部感染病原学判定方面的价值。
实变和支气管充气征(consolidation and brochogram sign)(图1A):实变是肺泡被填充,形成均匀的密度增高影。可形成大叶性肺炎,常见支气管充气征(不透明的肺部区域内管状气道影),常见于细菌性感染[11]。最常见的病原体为肺炎链球菌、肺炎克雷伯菌,也可见于真菌、结核感染,严重的病毒性感染导致肺实变的非常少见(如SARS、腺病毒感染、甲型流感)。
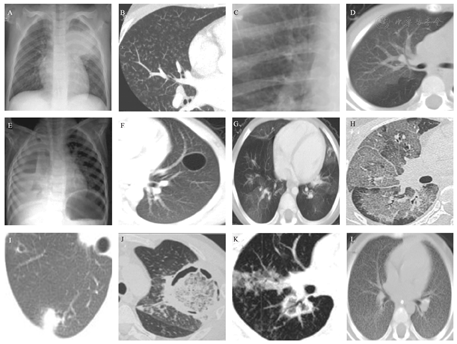

A.肺实变和支气管充气征;B.小叶中心性结节和树芽征;C.袖口征;D.磨玻璃影;E.气液平征;F.肺大泡;G.马赛克征;H.铺路石征;I.晕轮征;J.空气新月征;K.反晕轮征;L.粟粒样结节。
小叶中心性结节和树芽征(tree-in-bud sign)(图1B):病变累及细支气管及以下的气道,CT上因阻塞而扩张的细支气管形成V型或Y型树枝状,呼吸性细支气管和肺泡管内的黏液实变形成芽,整体类似树芽,是小气道病变非特异性征象。最常见的病原体是金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、厌氧菌、流感嗜血杆菌、病毒、支原体,也可见于寄生虫感染[12]。
袖口征和轨道征(cuff sign and peribronchial cuffing sign)(图1C):支气管周围病变,导致小叶间隔增厚,支气管壁和支气管周围结缔组织的水肿增厚,影像学横截面见支气管周围环形模糊影,为"袖口征",增厚的支气管壁纵向剖面影像学表现为两条平行线,看起来像火车轨道,称为"轨道征",通常见于肺间质水肿。也可见于引起肺间质病变的病毒(如巨细胞病毒、呼吸道合胞病毒等)和支原体感染。
磨玻璃样不透光影(ground glassopacity)(图1D):为CT上半透明状密度增高影;主要见于病毒、支原体、真菌等感染,细菌性感染少见。
气液平征(air-fluid level sign)(图1E):气液平表明存在肺脓肿或带有支气管胸膜瘘的脓胸。肺脓肿为炎性肿块,中央伴有化脓性坏死,常见内壁光滑或粗糙的空洞,多可见气液平。最常见的病原为金黄色葡萄球菌、肺炎克雷伯杆菌,亦可见于铜绿假单胞菌、厌氧菌[11]。
肺大泡(图1F):为单发或多发薄壁的含气影。常位于肺实变或磨玻璃影中,可引起气胸。肺大泡常见于金黄色葡萄球菌和肺孢子菌感染,也可见于肺炎链球菌等感染。
马赛克征(图1G):也称为马赛克灌注或镶嵌性灌注,为肺密度增高区与密度减低区夹杂相间,呈不规则的补丁状或地图状表现。主要见于闭塞性细支气管炎、哮喘、肺气肿等小气道疾病及卡氏肺孢子虫感染。
铺路石征(crazy-paving sign)(图1H):为CT上磨玻璃样不透明影上重叠有小叶间隔增厚形成的网格影。形似用砖头或石头铺成的道路。磨玻璃影反映了空腔或间质异常,网格影表示小叶间隔或间质增厚、不规则纤维化,伴随肺泡填充的过程。主要见于肺泡蛋白沉积症、肺水肿、腺癌等,也可见于卡氏肺孢子虫感染和新型冠状病毒感染。
晕轮征(halo sign)(图1I):CT上实变的肺结节外缘环绕着磨玻璃样不透明影。主要见于侵袭性肺曲霉菌感染和毛霉菌感染,也可见于新型冠状病毒感染。晕轮征多出现在侵袭性曲霉菌感染的早期[13]。
空气新月征和Monod征(air crescent sign and monod sign)(图1J):为圆形或椭圆形实变肿块影周围新月形气体影。Monod征为空气围绕着真菌球,腔内真菌球具有活动性,落在重力依赖的位置。空气新月征和Monod征常见于侵袭性曲霉菌感染。通常在影像学异常后的2周内出现,并与中性粒细胞功能恢复相一致,出现空气新月征标志着疾病的恢复阶段,预示患儿预后良好[14]。Gefter等[15]研究发现,曲霉菌感染中有空气新月征者较无该征象者存活率更高。Tabone等[13]观察到在发生侵袭性肺部曲霉菌感染的免疫缺陷儿童早期CT出现晕轮征,随后出现空气新月征。但Burgos等[16]研究却发现,与成人不同,儿童曲霉菌感染常不表现出空气新月征或晕轮征。
反晕轮征(reverse halo)(图1K):表现为中央磨玻璃样不透明影周缘被实变影包绕。可见于侵袭性曲霉菌、毛霉菌感染[11],也可见于新型冠状病毒感染。
粟粒样结节(图1L):弥漫性分布的圆形或椭圆形粟粒状密度增高影。以大小均匀、密度均匀、分布均匀的三均匀为特征。多见于血型播散型肺结核。也可见于曲霉、白色念珠菌感染及粟粒样转移瘤。
肺炎链球菌(图2A)典型表现为大叶性肺炎。少数患者可表现为支气管肺炎、球形肺炎。
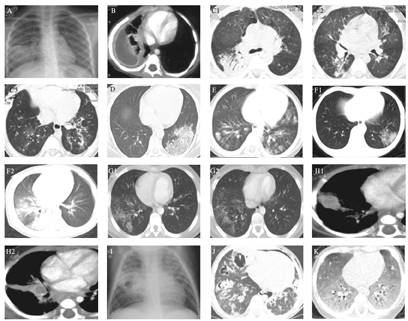

A.链球菌感染大叶性肺炎;B.金黄色葡萄球菌感染右下肺脓肿形成;C1、C2、C3.腺病毒肺炎;D.流感病毒肺炎;E.呼吸道合胞病毒肺炎;F1、F2.新型冠状病毒肺炎;G1、G2.支原体肺炎;H1、H2.结核杆菌感染原发综合征;I.结核性空洞;J.曲霉菌肺炎;K.卡氏肺孢子虫肺炎。
金黄色葡萄球菌(图2B)毒力强且容易液化坏死,其感染具有一定的特征性。进展迅速,一日内甚至几小时内由肺小叶进展至肺段或肺叶,由单侧进展至双侧。并以伴发肺大泡和胸膜炎为特征。由于支气管内有炎性渗出物堵塞,所以实变区无支气管充气征,CT上可见小叶中心结节和树芽征,表现为支气管肺炎,融合时形成弥漫性实变。多有含气液平的空洞性结节(直径4~10 mm)。病变数小时到两天内出现肺大泡,内无气液平,血源性感染者好发于两肺胸膜下及基底部,肺大泡出现少量液体时提示继发新感染。肺大泡多发者类似蜂窝肺[17]。该菌易累及胸膜,引起胸膜炎、胸腔积液或脓胸,且易分房或包裹。因此肺炎早期即出现肺大泡、胸腔积液或积脓、脓气胸时多提示金黄色葡萄球菌感染。
细菌性肺炎具有典型影像学特征的主要是链球菌肺炎和金黄色葡萄球菌肺炎。流感嗜血杆菌、卡他莫拉菌、大肠杆菌、肺炎克雷伯杆菌、铜绿假单胞菌等都可表现为肺实变影、可有胸腔积液,无特异性的影像学表现。
肺部病毒性感染主要累及肺间质,形成间质性肺炎,也可累及肺实质。影像学可表现为肺气肿、磨玻璃样不透明影、网格状影,但这些并非病毒性感染所特有。不同的病毒损伤的主要部位有所差异,如呼吸道合胞病毒、腺病毒、麻疹病毒、人类偏肺病毒、副流感病毒等常主要损伤支气管、细支气管,形成以肺门为中心的向心性分布的肺炎,而流感病毒、巨细胞病毒、SARS、新型冠状病毒等以肺的损伤为主,常快速进展为累及肺外带为主的肺炎[18]。
腺病毒感染(图2 C1、C2、C3)常见于婴幼儿或免疫功能低下者,儿童腺病毒感染以肺气肿和双肺多发磨玻璃影、实变影为主要特征[19],且实变多呈向心性分布。早期支气管黏膜水肿增厚、坏死,导致换气功能障碍,影像学表现为间质病变,肺气肿。病情进展,3~7 d出现两肺多发片状实变影,CT影像学表现为小叶中心性结节和树芽征为特点的支气管肺炎,病灶迅速融合,形成大片实变、弥漫性肺部浸润影,实变周围肺组织呈现肺气肿,支气管及其周围形成间质性肺炎表现。腺病毒肺炎后遗症期主要以闭塞性毛细支气管炎、间质纤维化、支气管扩张、单侧透明肺为特征的Swyer-James-McLeod综合征。闭塞性毛细支气管炎X线上最主要特征为肺气肿,CT上的特征性表现为马赛克灌注[19]。
流感病毒感染(图2D)常见影像学表现为磨玻璃影,网格状结节影[20],常位于肺下叶,部分合并实变,容易出现继发性感染。病灶迅速融合时,可形成大叶性实变[21],除病变导致严重的肺泡损伤外,常为合并肺炎链球菌、金黄色葡萄球菌等细菌性感染。
呼吸道合胞病毒感染(图2E)常表现为肺气肿和肺不张、间质性肺炎[22],可有两肺斑片状渗出影(支气管肺炎),CT上表现为小叶中心性结节和树芽征。
巨细胞病毒肺炎X线表现为双侧不对称且界限不清磨玻璃影和小的边界不清楚的中央小叶结节。
博卡病毒肺炎X线主要表现为双肺下叶网状结节浸润影,X线表现为弥漫性双侧斑片状实变影和磨玻璃影,CT表现为沿支气管血管束分布的斑片状实变影伴小叶间隔增厚[18]。
新型冠状病毒肺炎X线胸片表现为两肺中外带和胸膜下的局限性斑片状或多发节段性片状渗出影,重型为多发实变,危重型呈"白肺"表现。CT表现为两肺多发斑片状磨玻璃影、实变影,以沿支气管血管束和胸膜下分布为主,可见细网格状影,呈铺路石征。病变进展期表现为磨玻璃影、实变、结节等多种性质病变共存,以肺中外带和胸膜下、肺底分布为主,可有纤维化表现[23]。马慧静等[24]报道儿童病例CT影像学表现(图2 F1、F2)与成人患者典型表现相同。
X线表现早于重于肺部体征。早期表现为间质性肺炎,最常见影像学表现为一侧或双侧下肺野的斑片状影或模糊的网状结节影,多呈支气管肺炎表现,少数患儿可伴有胸腔积液。CT见小叶性分布的磨玻璃影和实变影,可有中央小叶结节影和树芽征[25]。
儿童最常见的异常是淋巴结肿大,可见于90%~95%的患儿,最常累及右支气管旁和肺门淋巴结。原发性肺结核典型表现为原发病灶、淋巴管炎、肺门淋巴结肿大形成哑铃形的原发综合征。绝大部分儿童患者有淋巴结肿大和肺实变。少数患儿有胸腔积液[26]。继发性血源性肺结核多形成粟粒性结节影。典型X线表现为从肺尖到肺底弥漫性大小均匀、密度均匀、分布均匀的圆形或椭圆形直径1~2 mm边界清楚的粟粒状结节影。CT除粟粒样表现,还可有磨玻璃影、淋巴结肿大等表现。干酪性肺炎可有多个不规则的虫蚀样空洞[27]。结核患者中,CT上树芽征被认为是活动性肺结核的可靠标志[28]。
颅内感染病原主要为病毒、细菌、结核杆菌、真菌、寄生虫,MRI在病原判定方面优于CT。
化脓性脑膜炎(图3A)增强CT时软脑膜强化,但无特异性,头颅MRI FLAIR成像对脑膜炎最敏感。脑实质化脓性感染性脑炎,CT低密度影,MRI T1WI低信号,T2WI和FLAIR高信号。脑脓肿(图3B、C1)形成时MRI具有典型性特征,脓肿多位于灰白质交界处,早期脓肿形成特征是化脓性脓肿周围形成良好的胶原蛋白壁。晚期脓肿为纤维囊的成熟和增厚以及坏死中心的减小。CT显示病灶周围水肿和低密度的坏死中心,T1WI上坏死中心显示低信号,囊壁显示高信号,周围低信号为水肿影像;T2和FLAIR上为中央高信号,囊壁为低信号[33]。化脓性脓肿需与肿瘤鉴别。薄而规则强化的囊多为脓肿,厚或结节状的囊多为肿瘤。磁共振波谱成像(MRS)(图3 C1、C2)可以区分脓肿和肿瘤,中央坏死区内乳酸、琥珀酸、乙酸、丙氨酸和氨基酸峰是脓肿的标记物,反映了微生物的糖酵解增加,而缺乏胆碱峰[34]。硬膜下积脓(图3D)也是细菌性感染的重要表现之一。
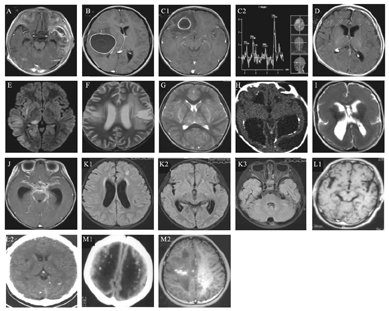

A.左侧颞叶脑膜脑炎;B.脑脓肿;C1、C2.右额叶脓肿及其MRS;D.左侧额顶部硬膜下积脓;E.病毒性脑炎;F.疱疹病毒脑炎;G.甲型流感相关性脑病;H.巨细胞病毒感染及其钙化;I.巨细胞病毒感染神经元移行异常;J.结核感染;K1、K2、K3.隐球菌感染;L1、L2.脑囊虫感染;M1、M2.弓形虫感染。
急性病毒性脑炎CT表现为散在斑片状低密度或大片状低密度影。MRI比CT更敏感,更具有特征性。急性病毒性脑炎由于炎症、水肿及脱髓鞘病变T1WI上呈低信号,在T2WI上表现为散在片状长T2高信号,白质内有指套状大片高信号,多发生于灰、白质交界处。病情进一步进展,灰质出现水肿,在T2WI上呈脑回状高信号。弥散加权像(DWI)(图3E)能比常规序列更早地显示高信号表现的病变区。
单纯疱疹病毒Ⅰ型感染(图3F)是儿童常见的病毒性脑炎。CT典型表现为单侧或双侧的颞叶内模糊低密度,常累及岛叶皮层,严重者同时累及壳核,豆状核不受累[35]。MRI敏感度近90%,表现为因水肿出现T1WI肿胀伴灰白质差异消失,伴有T2/FLAIR皮质和皮质下的高信号。MRI影像更具特征性的表现为颞叶内侧、额叶眶面、脑岛皮层可见长T1、长T2信号。因病变不累及豆状核,豆状核与病变常有刀切样清楚的界线,是其特征性表现之一。病变区早期有出血性表现时,CT上为高密度影,T1WI、T2WI/FLAIR上表现为高信号[36]。
甲型流感相关性脑病(图3G)MRI表现为颅内多发低密度灶或弥漫性异常信号,特征性改变是双侧丘脑对称性异常信号伴肿胀,可累及基底节、脑干、脑室周围白质、壳核和小脑,也可以表现为胼胝体压部的可逆性病变[37]。
巨细胞病毒感染(图3H、I)可引起脉络膜、视网膜炎及脑膜炎,CT上局限于脑室旁,基底节区的颅内钙化为特征性表现[38]。可引起脑梗死、脑萎缩、小脑畸形、积水型无脑畸形等,也可引起神经细胞移行异常、脱髓鞘伴有胶质增生。
颅内结核感染时结核杆菌多积聚于基底池,呈结节状增生,并能延伸到半球裂隙,可沿皮质表面和脑神经延伸。CT与MRI上脑池内有类似软组织的密度影。MRI上在T1WI上信号比脑脊液稍高,T2WI上因和脑脊液信号形似而不能显示。增强扫描时受累的脑池明显强化,在灰白质交界处可见多发具有强化效应的病灶。肉芽肿形成后会合并形成更大的中央坏死性病变。非干酪性结核在CT上表现为低密度影,在T1WI和T2WI/FLAIR上表现为低信号,病灶周围水肿区可有强化影。MRS上脂质和乳酸峰和缺乏氨基酸峰可区别于化脓性脓肿[39]。干酪性结核,脑实质内常有结核瘤,增强扫描表现为环形强化灶。幕上者常为多发,幕下则往往单发。粟粒性脑结核在增强扫描时脑内弥漫性点状和小环状强化灶十分典型。
新型隐球菌脑膜炎(图3 K1、K2、K3)多累及蛛网膜下腔,沿血管周围播散,累及基底神经节、丘脑和皮质下白质。胶状假性囊肿和隐球菌球形成时MRI表现为基底节区多发的囊性病灶,呈脑脊液样信号,无强化表现;也可在MRI表现为环形强化的结节状真菌球[40]。室管膜受累导致一半的病例出现交通性脑积水。
脑囊虫病MRI(图3 L1)敏感性显著高于CT(图3 L2)且能显示分期,小囊性病灶多位于大脑皮质,基底神经节或蛛网膜下腔[41]。脑实质型脑囊虫病最常见,CT上表现为小圆形低密度内有一点状稍高密度的头节。MRI T1WI上表现为小圆形低信号,有偏心的点状中等信号的头节,囊壁很薄,T2WI上则可见囊呈小圆形高信号,其内头节呈稍低信号,周围无反应性脑水肿。随着时间延长,CT可见低密度的小囊性病变,周围有低密度水肿区。T1WI上灰白质交界区大小不一的片状低信号,其边缘部分可见低信号小囊状病变,T2WI上为片状高信号,呈指套状向灰质衍生,小囊状病变中央为高信号,周围为低信号环。增强扫描可见环形强化,脑水肿区无强化。肉芽肿期,T1WI上为小圆形低信号,T2WI上囊虫呈稍高信号,伴或不伴脑水肿。最后囊虫肉芽肿完全钙化,CT上呈点状高密度[42]。
弓形虫感染:神经影像学检查显示多发病变,累及基底神经节、丘脑和皮质髓质交界处。中央坏死部位CT上为低密度影,MRI(图3 M1、M2)在T1WI上高信号,T2WI上低信号。30%的病灶表现为偏心结节增强,称为"偏心靶征"[43],是弓形虫病非常特殊的标志。
影像学检查对感染性疾病的早期诊断和病原判定具有重要意义。但同时影像学检查的报道具有主观性,对临床医生和放射科医生均具有挑战性。由于经验不同,观察者之间可存在巨大差异[44]。因此,临床工作中以影像学区分病原学时,必须同时结合患儿年龄、临床表现、病程、季节、免疫状态等因素综合进行评判。
所有作者均声明不存在利益冲突



























