
针对急性呼吸窘迫综合征患者采用肺保护性通气策略是目前公认的方案,其中呼气末正压(positive end expiratory pressure,PEEP)的设定是肺保护性通气中的重要一环,PEEP滴定技术多样,但最佳PEEP的选择仍是临床工作中的难点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
对于严重急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患儿,应根据其氧合及血流动力学状况采用滴定呼气末正压(positive end expiratory pressure,PEEP)的方式设置较高的PEEP(10~15 cmH2O,甚至更高,1 cmH2O=0.098 kPa),以改善氧合,维持肺泡开放及防止肺泡过度膨胀。本文就目前PEEP滴定方法做一介绍。
PEEP是指呼气末期将气道压力维持在高于大气压的水平。1967年Ashbaugh等[1]首次提出ARDS的概念,同时提出PEEP可改善ARDS患者氧合。PEEP使ARDS患者呼吸末肺容积增加并产生肺复张,防止肺泡萎陷;减少肺泡反复开闭引起的剪切伤;减少肺泡表面活性物质消耗;增加肺功能残气量,改善肺通气/血流比值;改善氧合及肺顺应性,提高ARDS存活率[2]。同时有研究表明,ARDS机械通气时随PEEP的升高,心脏前负荷是降低的[3]。但过高的PEEP会产生肺过度扩张,导致气压伤和血流动力学改变,使右心房减少静脉回流的压力梯度,膨胀的肺泡压迫肺血管床,增加肺血管阻力,减少右心室输出量[4];升高的胸内压还会阻碍大脑静脉回流,升高颅内压;同时也有研究发现,过高的PEEP与急性肾损伤、胃肠道出血、糜烂性食管炎、腹泻、非结石性胆囊炎的产生密切相关。
应用肺部CT可以直观反映肺部病变的形态学,被认为是评估PEEP应用效果的金标准。由于CT值可以反映肺不同部位含气量,可以将肺区分为无通气区、含气不良区、正常通气区、过度通气区。监测PEEP滴定过程中肺CT的变化,可以直接测量肺复张容积并监测过度通气,从而指导PEEP的设定[5]。具体操作为肺复张后将PEEP从较高水平逐渐降低,每3~5分钟降低2 cmH2O,当CT显示含气肺组织较前次下降5%以上时,提示肺泡开始塌陷,则前1次PEEP值即为维持肺泡开放的最佳PEEP。通过分析多中心CT数据研究发现,对于肺可复张性好的ARDS患者,应用高水平PEEP(15~20 cmH2O)可以减少肺泡开放闭合剪切伤,使这部分患者获益[6]。如果患者肺部无通气区面积较大,高水平PEEP会带来更高的平台压,反而不利于肺保护性通气,甚至在这部分患者中,潮气量为6 ml/kg,CT仍可发现肺泡存在过度通气,对于这部分患者可能需要进一步降低潮气量和平台压,并结合体外二氧化碳清除装置或应用高频通气解决。虽然肺部CT是滴定PEEP的金标准,但是由于CT无法床旁实施,且辐射量大,限制了其在儿童ARDS患者中的使用。
EIT是一种较新的无创、实时、床旁肺成像监测技术,可动态观察区域性肺通气[7],并计算局部机械能,由此推算出作为机械能重要组成部分的PEEP的最佳数值,并能反映局部的肺损伤变化[8,9]。进一步研究发现,对肺复张有反应的ARDS患者进行EIT指导下的PEEP滴定对寻找最佳PEEP有所帮助[10]。该方法可以展示重力依赖区和非重力依赖区域的潮气量变化,相对于压力-容积曲线法(pressure-volume curve,P-V曲线)更精确。我国台湾学者研究报道,对24例PaO2/FiO2<100 mmHg(1 mmHg=0.133 kPa)的重度ADRS患者,应用EIT监测滴定PEEP与传统应用P-V曲线吸气支低位拐点(lower inflexion point,LIP)方式设定PEEP进行比较,EIT监测方式设定的PEEP较对照组高1.5 cmH2O,患者的病死率及脱机成功率虽有所改善,但差异无统计学意义[11]。具体操作方法为:在基础PEEP 5~8 cmH2O水平上逐步增加PEEP,直至平台压达到35 cmH2O或出现血流动力学不稳定。此时逐渐下调PEEP每次2 cmH2O并维持2 min,每个PEEP水平均以肺部所有区域像素计算肺顺应性。通过PEEP下降过程中肺顺应性下降曲线预计肺塌陷与过度通气百分比,最佳PEEP选择为肺塌陷与过度通气百分比曲线的截点,为两者比例的最佳折中。
床旁经胸壁肺部超声目前被广泛应用于重症患者肺部病变的评估。在ARDS患者肺复张过程中,基于不同呼吸条件下肺部超声征象的动态变化而建立的再充气评分能够有效监测PEEP对塌陷肺泡的开放作用[12]。ARDS患者肺复张后进行PEEP递减方法,每5分钟降低2 cmH2O,随着PEEP水平的降低再充气评分逐渐下降,直至出现一个突然大幅下降的过程(下降≥30%),表明在此PEEP水平时,复张的大量肺泡重新出现塌陷,提示此PEEP水平+2 cmH2O或为最佳PEEP。有研究报道,利用床旁超声来观察ARDS患者的膈肌运动,发现随着PEEP滴定过程中PEEP的递增使呼气末跨肺压趋于>0的过程中,膈肌运动随之变化[13]。因此,作者提出通过超声监测膈肌运动的变化滴定PEEP是ARDS患者PEEP选择的新方法。
超声虽然是临床常用的无创监测方法,但应用肺部超声评估时仍有一些局限,如不能定量监测肺部含气量,脂肪组织过厚或皮下气肿气体会阻挡超声声束的前进,会使影像不清楚;严重肺部水肿的患者,超声不易识别等,更多超声监测方法有待进一步开拓。
P-V曲线是反映肺部在呼吸周期中压力与容积关系的曲线,由吸气支及呼气支组成,曲线上各点的斜率变化可以反映肺的顺应性变化。目前主流的呼吸机都带有P-V曲线测定工具。早在1998年,Amato等[14]通过分析P-V曲线吸气支,认为LIP代表大部分肺泡复张的开始,而吸气支高位拐点(upper inflection point)代表肺泡过度扩张或肺复张结束,并提出了最佳PEEP应设置为LIP以上2 cmH2O以维持肺泡开放,这也是临床应用最为广泛的PEEP滴定方法之一。然而,从PEEP的生理学意义来看,PEEP是为了避免呼气相肺泡塌陷,因此应用呼气支寻找最佳PEEP设定更为合理。呼气支拐点法也称为呼气支最大曲率点(point of maximum curvature,PMC)法[15]。呼气开始时呼气支曲线较平滑,随着呼气进行,气道压力降低到某一临界值后肺泡容积变化突然加快,该点被定义为PMC,即呼气相肺泡塌陷的开始,当呼气时气道压力低于PMC时,开始出现肺泡塌陷及氧合水平下降,因此理论上设定PEEP大于PMC是合理的。有研究发现呼气支高拐点对应的PEEP数值氧合和呼吸系统的顺应性改善更加明显,且对血流状况无不良影响[16]。值得注意的是,P-V曲线反映的是整体肺部的顺应性,而非单一肺泡,不能反映ARDS肺部病变不均一的特点,低拐点存在是由于ARDS渗出期存在大量可复张的萎陷肺泡,随纤维化的出现,拐点不明显甚至不出现。而且上述理论均源于肺静态P-V曲线,在临床实际工作中真正的肺静态P-V曲线很难获得,而呼吸机上显示的动态P-V曲线,与静态P-V曲线存在一定差异,可用于推测患者肺静态P-V曲线大概位置并实时监测肺顺应性的变化。通过P-V曲线吸气支进行目测,虽易行,但缺乏精准度。
在PEEP滴定过程中,依据最佳氧合或最佳肺顺应性设置PEEP也是临床常用的PEEP设定方法。具体方法为:在肺复张操作后,从高水平PEEP(20 cmH2O)开始递减,一般为每5分钟降低PEEP水平2 cmH2O,维持5~15 min后测定动脉血氧分压或肺顺应性,直至PEEP为0 cmH2O,测定静态顺应性。在PEEP滴定过程中,当氧合或肺顺应性出现下降时确定所对应的PEEP,最佳PEEP设置为此时的PEEP+2 cmH2O水平。然后再次肺复张后将PEEP设置为最佳PEEP水平。有研究显示,肺顺应性的变化比动脉血氧分压能更好地反映肺复张后通气区与非通气区的变化,以肺顺应性为依据设定的PEEP值与依据肺部CT设定的PEEP值具有很好的相关性,且操作更为简便[17]。此方法符合ARDS的病理生理改变,是当今较为公认的方法之一。
亦称为快速法(express method)。在容量控制模式下设置6 ml/kg理想体重的潮气量,以2 cmH2O为步长不断增加PEEP,每次增加后利用吸气屏气法测量平台压,直到测得的平台压达到28~30 cmH2O,此时的PEEP即为最佳PEEP。若患者顺应性较好,PEEP增加到20 cmH2O时,平台压还没有达到以上目标,将不再继续增加PEEP。该方法快速,且限制平台压力在30 cmH2O以下,相对比较安全,但可能会导致轻度ARDS患者使用过高PEEP的风险。
跨肺压是肺泡压与胸腔内压之差,呼气末跨肺压>0 cmH2O有利于肺泡的扩张,反之塌陷。当呼吸末,肺泡压可通过测定气道压获取,食道压对应胸腔内压,两者之差即为呼气跨肺压。通过设置呼气末跨肺压>0 cmH2O,维持肺泡在呼气末的开放状态;同时通过调节平台压,限制吸气末跨肺压<25 cmH2O,实施肺保护性通气[18]。但最新研究结果显示,该方法并未降低中重度ARDS患者的病死率和机械通气时间[19]。应用此方法需要特殊配置的呼吸机及置入食道监测压管,目前在儿科尚未普及。
SI又称牵张指数,是在患者没有自主呼吸时(镇静肌松),恒流送气的容量控制通气模式下,保持潮气量在6 ml/kg的理想公斤体重,逐步增加PEEP直到压力-时间曲线成线性,并以此滴定ARDS患者的PEEP水平。描记容量控制恒流状态下气道压力-时间曲线吸气支,进行曲线回归,得到方程P=a×timeb+c,其中b即为牵张指数SI。SI>1时提示吸气过程存在肺泡过度膨胀,PEEP设置过高,压力-时间曲线上呈下凹型;SI<1时提示吸气过程中仍有塌陷的肺泡,PEEP设置过低,压力-时间曲线上呈上凸型;SI=1时提示在吸气过程无肺泡塌陷与过度膨胀,PEEP设置最为合理,压力-时间曲线上呈直线型[20],见图1。
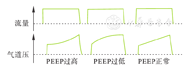

但气道压力-时间曲线反映的是整个呼吸系统(肺和胸壁)的力学特征,当存在胸腔积液、气胸或腹高压时,患者的胸壁顺应性发生改变,此时通过气道压力-时间曲线得到的SI可能就难以单纯反映肺组织的力学变化。因此,当胸壁顺应性发生改变的情况下,有学者提出通过跨肺压-时间曲线得到的SI指导ARDS患者的PEEP选择可能更加合理。Grasso等[21]研究,应用SI法对比PEEP-FiO2表法可使肺部获得更好的肺顺应性。国内学者发现SI法与最佳氧合法设定的PEEP均可获得最佳氧合效果,优于最佳顺应性法和P-V曲线法。
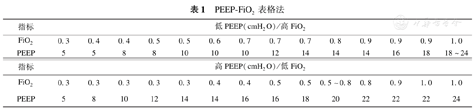
国际ARDS协作组织自2004年提出PEEP-FiO2表格法[22]设定PEEP,即采用表格PEEP和FiO2的对应关系进行调节以达到氧合目标(PaO2 55~88mmHg和SpO2 88%~95%),此表分高/低水平PEEP-FiO2两个对应关系,见表1。轻度ARDS患者应用低PEEP/高FiO2,中、重度ARDS患者应用高PEEP/低FiO2。
PEEP-FiO2表格法
PEEP-FiO2表格法
| 指标 | 低PEEP(cmH2O)/高FiO2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| FiO2 | 0.3 | 0.4 | 0.4 | 0.5 | 0.5 | 0.6 | 0.7 | 0.7 | 0.7 | 0.8 | 0.9 | 0.9 | 0.9 | 1.0 |
| PEEP | 5 | 5 | 8 | 8 | 10 | 10 | 10 | 12 | 14 | 14 | 14 | 16 | 18 | 18~24 |
| 指标 | 高PEEP(cmH2O)/低FiO2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| FiO2 | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | 0.4 | 0.4 | 0.5 | 0.5 | 0.5~0.8 | 0.8 | 0.9 | 1.0 | 1.0 |
| PEEP | 5 | 8 | 10 | 12 | 14 | 14 | 16 | 16 | 18 | 20 | 22 | 22 | 22 | 24 |
该法使用简单,易于临床推广,但也存在PEEP设定不个体化的缺点,且临床评价不一。Chiumello等[23]发现该方法在PEEP与肺复张程度的相关度上优于最佳肺顺应性法、SI法和跨肺压法,但也有研究发现其设定的PEEP数值低于最佳顺应法,且氧合程度并未优于后者[24,25]。2019年发表于JAMA的多中心随机对照临床研究显示:对200例PaO2/FiO2<200 mmHg的中重度ARDS患者应用食道压监测方法滴定PEEP与应用经验性高水平PEEP-FiO2表格设定PEEP,患者的28 d病死率及28 d无机械通气时间差异均无统计学意义[26]。
死腔分数是反映肺通气效率及肺通气/血流比例失调的重要指标,肺死腔分数在ARDS早期显著增加,被认为是ARDS患者死亡的独立危险因素。肺内死腔包括解剖死腔及肺泡死腔,由于解剖死腔在呼吸周期中变化不大,死腔分数主要反映肺泡死腔。肺复张后最佳PEEP不仅要维持肺泡不塌陷,而且需要维持最佳的通气/血流比及最小的死腔通气。具体方法为:肺复张后PEEP从较高水平(如20 cmH2O)以2 cmH2O逐步递减至0 cmH2O,计算每个PEEP水平的功能残气量、肺动态顺应性,可采用NICO单次呼吸CO2曲线法:死腔分数=(PaCO2-PeCO2)/PaCO2(PeCO2:为呼出气体中CO2分压)。取最小死腔分数时的PEEP为最佳PEEP。该方法可显著减少死腔通气、显著改善肺顺应性[27]。
虽然PEEP滴定技术很多,但在临床实践中ARDS患者的最佳PEEP仍受很多因素影响,不同病因、同一疾病的不同时期、不同的危重程度、不同病原的病理生理改变等都会导致PEEP目标不尽相同。人体作为一个整体,除了考虑呼吸系统的情况外,还要关注心肺、肺脑、肺腹的相互作用。儿童ARDS通气支持的共识推荐:严重ARDS,需逐步提高PEEP至10~15 cmH2O,当PEEP高于15 cmH2O时,应限制平台压,同时密切监测氧输送、呼吸系统顺应性及血流动力学变化[28]。Narendra等[29]提出肺保护通气下PEEP设置遵循以下原则:(1)不推荐因PEEP的增高,导致平台压>30 cmH2O或驱动压>15 cmH2O;(2)使驱动压降低的PEEP增加提示更多肺泡打开,可以增加PEEP;(3)使驱动压增高的PEEP增加提示出现肺泡过度扩张,建议降低PEEP至原来水平;(4)胸壁顺应性对呼吸影响较大的情况下,如肥胖、腹高压等,PEEP的设置建议参考跨肺压滴定法。
肺保护性通气是ARDS呼吸支持的基础,适宜PEEP的选择是肺保护性通气中的重要一环,也是临床难点之一。PEEP滴定技术为我们提供了可行的方法,因关注的角度不同,PEEP滴定技术很多,各具优缺点。临床上建议根据不同的病因、不同的临床特点,采用简单易行、熟悉的方法做初步滴定,在肺保护性通气策略下进行个体化设置,关注获益与弊端,同时保证机体的整体平衡。
所有作者均声明不存在利益冲突



























