
膈肌在人类自主呼吸中扮演重要角色。膈肌功能障碍会导致患者呼吸功能减退,延迟机械通气的撤离,从而增加患者病死率、延长住院时间。因此,膈肌功能的评估对重症患者至关重要。近年来,超声检查作为一种操作方便、快速、无创、无辐射及可重复的床旁检查手段,可以量化各种正常和病理情况下的膈肌特征,已用于膈肌功能的评估。本文旨在阐述超声检查应用于膈肌功能评估的研究进展及存在的问题,并介绍通过超声检查实施膈肌保护性机械通气的潜在途径和挑战,为临床应用该技术提供指导和帮助。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
膈肌是人体重要的呼吸肌。重症患者常因脑、脊髓或膈神经损伤,神经肌肉疾病,上腹部或心脏手术,肺部感染,机械通气等原因导致膈肌结构或功能紊乱[1,2,3,4,5],进而导致患者呼吸衰竭甚至死亡。研究报道,重症病房中非膈肌功能障碍的患者病死率仅16%,而膈肌功能障碍患者病死率高达50%[6,7]。因此,膈肌功能的评估至关重要。既往的评估手段,如X线、MRI、肌电图、颤搐性跨膈压等,常因操作复杂、有创或不便携,在ICU中的应用受限。超声检查是一种非侵入性技术,已被证明是一种快速、准确、无创、无辐射,易于使用的床旁检查手段。在危重患者的日常管理中,超声检查的使用已变得越来越重要,心脏和肺的超声检查尤其普遍[8,9],膈肌的超声检查起步相对较晚。超声检查可以量化呼气和吸气过程中膈肌的厚度及其变化,可以监测膈肌萎缩程度、鉴定膈肌做功能力及人-呼吸机同步性、预测呼吸机脱机结果,并为实施膈肌保护性机械通气提供依据。由于在许多临床情况下评估膈肌功能的特殊需求,膈肌的超声检查已开始在ICU中获得认可。
膈肌是一向上隆凸的穹隆形扁肌,位于胸、腹腔之间,其中央部为腱膜,称中心腱,周围部为肌纤维。根据肌纤维起始部位不同可分为三部分:胸骨部起于剑突后面;肋部起自7~12肋内面;腰部起自1~3腰椎椎体,第2腰椎横突及第12肋[10]。包括位于中顶部的中心肌腱(不具有自主收缩功能)、自中心肌腱放射状发散的肌纤维、膈肌胸腔附着区域。膈肌受膈神经支配。膈肌收缩时,肌纤维变短,膈肌胸腔附着区域变厚,中心肌腱向前向下移动,使胸廓增大,协助吸气作用[11];膈肌舒张时,横膈上升,胸廓变小,协助呼气作用。膈肌由慢型、抗疲劳型和快型三种肌纤维组成,分别在膈肌低强度、永久性呼吸循环、快速剧烈活动中发挥作用[12]。膈神经是支配膈肌的唯一运动神经,由颈3~5前支发出的神经纤维汇集,经胸锁乳突肌后缘、肺根前方、纵隔胸膜与心包之间下行至膈[13]。
常用的超声检查使膈肌显像的入路包括:在并置区的腋中/腋前肋间入路,以及使用肝脏或脾脏作为声学窗口的肋下入路。超声检查包括两种模式:B型和M型。B型超声多用于确定超声测量时声束的方向和深度,M型超声则多用于测量膈肌的活动度(包括移动度和厚度变化)。它可以描述一段时间内膈肌的运动曲线,可以从横断面监测膈肌运动的方向、幅度、速率及膈肌厚度的变化率。膈肌参数的测量建议在无辅助呼吸或最小可容忍的水平CPAP下进行,否则难以区别膈肌的主动收缩和辅助呼吸下的被动运动[14,15]。
膈肌厚度的测量通常选择肋间入路。检查时,受检者取半卧位,上身倾斜30°,检查者将B型线性高频探头(10~15 MHz)置于受检者右腋前线/腋中线第8~11肋间[14,16],垂直于皮肤,图像可见三层平行的高低相间的回声层,其中上下两层高回声区为胸膜层、腹膜层,中间混杂回声区为膈肌层,两条高回声区之间的距离(不包含两条高回声本身的厚度)即为膈肌厚度。膈肌厚度的超声图像见图1。膈肌厚度变化率=(最大吸气末膈肌厚度-平静呼气末膈肌厚度)/平静呼气末膈肌厚度。据报道,健康一般人群膈肌厚度为(1.7±0.2) mm[17],肺容量从残气量增至肺总量时,膈肌厚度平均可增加54%[14]。
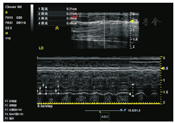

图中白色标注1:呼气末膈肌厚度,2:平静吸气末膈肌厚度;3:用力吸气末膈肌厚度;4:电刺激吸气末膈肌厚度。
膈肌活动度是指膈肌在呼吸过程中呼气末到吸气末之间的位移。膈肌活动度的测量通常选用肋下入路。受检者取半卧位,上身倾斜30°,将低频探头(2~5 MHz)[18]置于锁骨中线与肋弓下缘交点处,以肝脏或脾脏作为声窗,超声探头应尽量垂直于膈肌穹隆。膈肌在图像上被识别为一条覆盖肝脏或脾脏的亮线,在吸气期间,亮线应朝探头移动。定位好膈肌后,再切换至M型模式对膈肌活动度进行量化(建议将扫描速度调整为10 mm/s左右,以期在一幅图像中至少获得三个呼吸循环),分别测量左右两侧平静呼吸及用力呼吸时膈肌活动度,左侧需要使用解剖M型模式,见图2、图3。超声检查测量评估膈肌功能已被证明与大多数膈肌影像检查评估方法在准确度上具有很好相关性[19]。Boussuges等[20]测量了210例(男∶女=150∶60)正常人膈肌活动度,发现平静呼吸时膈肌左侧平均活动度为(1.8±0.4)cm,膈肌右侧平均活动度为(1.8±0.3)cm,双侧无显著差异;用力呼吸时膈肌左侧平均活动度为(7.3±1)cm,膈肌右侧平均活动度为(6.6±1.3)cm,且男性膈肌活动度大于女性。通过比较左右两侧膈肌移动度的差别,可以鉴别单侧膈肌无力或麻痹。
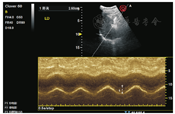

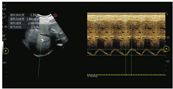

由于脾脏的声学窗口较差,有时很难获得清晰的左半膈肌图像。在平静呼吸时,容易测量膈肌移动度,其成功率>95%;而在用力呼吸时,成功测量膈肌移动度的难度较大,尤其是在左侧[21]。如果在从肋下窗观察膈肌时遇到困难,可以将平静呼吸中肝脏或脾脏随呼吸运动的距离作为膈肌移动度的间接测量方法。由于膈肌移动和伴随的肝脾移动之间存在很多不确定因素[22],因此建议使用这种间接法对横膈膜运动进行定性评估,而不是定量评估。
超声检查作为一种非侵入性技术,已被证明是一种简单、快速、准确、无创、无辐射的床旁检查手段,成为评估膈肌功能的有力工具。Goligher等[22]在机械通气患者(n=66)中进行了有关超声测量膈肌厚度和膈肌厚度变化率的可靠性研究,测量者内和测量者间再现性系数分别为0.2 mm和0.4 mm,这意味着在95%的情况下,由同一观察者进行的两次测量之间的绝对值相差不超过0.2 mm(对于两名不同观察者,则相差0.4 mm)。但是应牢记,0.2 mm表示大约隔膜总厚度的10%左右。此外,超声探头的空间轴向分辨率(深度分辨率,即1/2空间脉冲长度)在测量准确性方面起着至关重要的作用。膈肌厚度一般只有(1.7±0.2)mm,而大多数超声检查机器分辨率只能达到0.1 mm,约占所测数值的6%,因此在实际操作过程中,微小的操作差异都会使测得的膈肌参数变异较大。此外,某些特殊患者如肥胖者因体重指数明显增加,其膈肌活动度也相应增加。因此,尽管超声检查似乎是评估膈肌厚度随时间变化的可靠技术,但应谨慎对待个体患者的检查结果,并且测量者只有经过足够的培训后才能进行准确测量,因为与测量者相关的微小变化(如测量者习惯,测量位置,探头角度)会影响结果。
超声检查能实时监测评估膈肌功能,对于临床使用呼吸机治疗的患者脱机具有重要的预测意义,是评估能否成功脱机的辅助手段。
Kim等[23]在自主呼吸试验(spontaneous breathing trial,SBT)之前,评估了89例患者在T型管吸氧下的膈肌活动度,认为膈肌活动度<10 mm与脱机失败有关,但其预测性能较差(ROC曲线下面积0.61)。Mariani等[24]使用相同的截止值分组,认为膈肌活动度<10 mm和脱机失败之间未发现关联。但是,Farghaly和Hasan[25]监测机械通气患者通过SBT试验后的膈肌活动度发现,膈肌活动度>10.5 mm对脱机成功的预测性能似乎要高得多(ROC曲线下面积0.88)。在一个对10项评估膈肌移动度预测脱机失败研究的荟萃分析中,报告了75%(95%CI 65%~85%)的敏感性和75%(95%CI 60%~85%)的特异性,具有相当大的异质性[26]。
也有学者通过测定膈肌厚度变化率来预测呼吸机使用患者的脱机结果,发现膈肌厚度变化率>36%能预测脱机成功,其敏感性为0.82,特异性为0.88,阳性预测值为0.92,阴性预测值为0.75[27]。
基于以上研究,目前普遍认为膈肌活动度预测脱机成功比预测脱机失败更有价值,但其具体临界值还未达成统一。膈肌活动度预测脱机失败的价值欠高可能与其他呼吸机代偿有关,仍需综合评定。
超声检查在评估重症患者膈肌功能方面很有前途,可提供有关膈肌功能的定性和定量信息,作为重症患者总体呼吸评估的一部分。除了明确发现膈肌功能障碍外,对膈肌功能进行超声检查可能有助于识别重症患者的亚群,早期识别有呼吸并发症的高风险患者,提前引起临床医生重视并予以对症处理。随着超声技术的日新月异,相信将有更多有效的超声检查手段应用于临床。
所有作者均声明不存在利益冲突



























