
总结川崎病(KD)伴休克及心肾综合征5型(CRS-5)患儿的临床特点。
回顾性分析首都医科大学附属北京儿童医院2016年6月至2020年2月收治的4例KD伴休克及CRS-5患儿的临床表现、实验室检查、影像学特点、治疗及预后情况。
4例患儿中男3例,女1例,发病年龄2~12岁。3例患儿在KD经典症状的基础上于发病第5天出现休克表现,1例患儿以休克起病。所有患儿均同时伴有精神萎靡、呼吸心率增快、心音低钝、奔马律及尿少。4例患儿外周血白细胞计数、中性粒细胞比例、C反应蛋白、降钙素原、肾功能及N末端脑利钠肽前体均显著升高,并伴有低白蛋白血症及蛋白尿,3例患儿肌钙蛋白I升高。超声心动图提示4例患儿左心室射血分数值降低,波动在41%~55%,仅1例出现冠状动脉扩张。2例患儿泌尿系超声提示双肾增大,回声增强。4例患儿予液体复苏、应用血管活性药物、静脉用丙种球蛋白冲击、糖皮质激素抗炎、强心及营养脏器等支持治疗后,均好转出院。随访期间,所有患儿均未遗留脏器功能损害。
儿童KD急性期可出现休克及CRS-5表现,常伴强烈的炎症反应,心肾损伤标记物异常升高,及时正确治疗,预后良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
川崎病(Kawasaki disease,KD)是一种好发于儿童的非特异性血管炎,多侵犯冠状动脉,已成为儿童获得性心脏病的主要病因[1]。已有研究报道,在KD急性期可出现与休克相关的严重临床表现,并可累及多个系统[2,3,4],其中由KD等全身性疾病导致心脏、肾脏同时损伤称为心肾综合征5型(cardiorenal syndrome type 5,CRS-5)[5]。近年来,随着KD发病率的逐渐升高,其并发症的临床表现多样[6,7,8],但同时出现休克及CRS-5较少见且对这部分患儿的临床特征关注尚不足。现回顾性分析2016年6月至2020年2月在首都医科大学附属北京儿童医院心脏内科接受治疗的4例KD伴休克及CRS-5患儿的资料,总结KD伴休克及CRS-5的临床特点,提高临床医师的认识。
选择2016年6月至2020年2月在首都医科大学附属北京儿童医院心脏内科因KD伴休克及CRS-5住院接受治疗的4例患儿为研究对象,诊断标准需符合美国心脏病学会发布的《川崎病诊断治疗和长期随访》声明[1]及《心肾综合征的分型、病理生理学、诊断和治疗策略》科学声明[5]。本研究通过首都医科大学附属北京儿童医院伦理委员会批准(批号:2020-Z-064),并豁免知情同意。
采集4例KD伴休克及CRS-5患儿的临床数据,包括基本信息、临床表现、实验室检查、影像学特点、治疗情况及预后等。对患儿进行门诊及电话随访至2020年3月。
描述性分析。计数资料以例表示,计量资料用范围表示。
KD伴休克及CRS-5患儿共4例,其中男3例,女1例;发病年龄2岁1例,4岁1例,5岁1例,12岁1例。所有患儿既往身体健康,无明确基础疾病。4例患儿均有持续高热,最高体温39.1~41.2 ℃,总热程5~8 d,住院时间13~16 d。3例(例1、2、4)患儿符合KD临床诊断标准收入院,1例(例3)患儿最初诊断为脓毒性休克,最后确诊为KD伴休克。4例患儿分别于病程第2~5天出现血压降低(65~80/33~41 mmHg,1 mmHg=0.133 kPa)、四肢末梢凉、毛细血管再充盈时间延长等休克表现,需要扩容后依靠血管活性药物方能维持血压在正常范围。同时伴有精神萎靡、呼吸心率增快、心音低钝、奔马律、尿量进行性减少等CRS-5表现,具体见表1。除此之外,4例患儿都出现一过性胃肠道受累症状,包括纳差、呕吐、腹痛及腹泻等,1例(例3)患儿合并消化道出血。
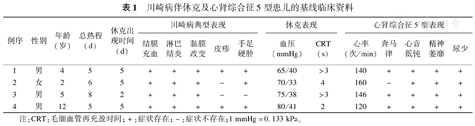
川崎病伴休克及心肾综合征5型患儿的基线临床资料
川崎病伴休克及心肾综合征5型患儿的基线临床资料
| 例序 | 性别 | 年龄(岁) | 总热程(d) | 休克出现时间(d) | 川崎病典型表现 | 休克表现 | 心肾综合征5型表现 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 结膜充血 | 淋巴结炎 | 黏膜改变 | 皮疹 | 手足硬肿 | 血压(mmHg) | CRT(s) | 心率(次/min) | 奔马律 | 心音低钝 | 精神萎靡 | 尿少 | |||||
| 1 | 男 | 4 | 5 | 5 | + | + | + | + | + | 65/40 | >3 | 140 | + | + | + | + |
| 2 | 女 | 2 | 6 | 5 | + | + | + | - | + | 70/33 | 4 | 160 | - | + | + | + |
| 3 | 男 | 5 | 8 | 2 | + | + | + | - | - | 75/38 | >3 | 146 | + | + | + | + |
| 4 | 男 | 12 | 5 | 5 | + | + | + | + | + | 80/41 | 2 | 120 | + | + | + | + |
注:CRT:毛细血管再充盈时间;+:症状存在;-:症状不存在;1 mmHg=0.133 kPa。
4例患儿的血培养结果均阴性,血常规提示白细胞及中性粒细胞计数显著升高,3例(例1、2、3)患儿急性期存在轻度贫血(96~103 g/L),恢复期血小板计数明显高于正常(631~1 083×109/L);尿常规提示轻度蛋白尿;C反应蛋白及降钙素原升高显著;动态红细胞沉降率正常或轻度增快;2例患儿出现低钠血症,3例患儿出现血钾及白蛋白均明显低于正常;4例患儿全部肾功能异常,尿素氮波动于13.75~20.48 mmol/L,血肌酐波动于85.2~228.1 μmol/L;3例患儿肌钙蛋白I升高,4例患儿的N末端脑利钠肽前体(参考范围0~450 pg/mL)较正常值升高20倍以上,具体见表2。肝功方面,2例(例2、4)患儿正常,1例(例1)轻度升高,1例(例3)合并急性肝衰竭,表现为丙氨酸氨基转移酶高于正常,总胆红素升高,直接胆红素升高为主,凝血功能提示凝血酶原时间延长、国际标准化比值大于1.5;4例患儿均合并一过性甲状腺功能异常,表现为血清总三碘甲状原氨酸明显低于正常;免疫方面,4例患儿均出现不同程度的细胞因子水平的升高,自身抗体、ENA谱及抗中性粒细胞胞浆抗体等均阴性。
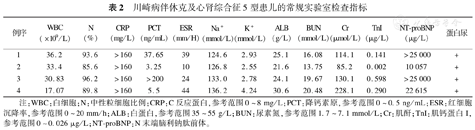
川崎病伴休克及心肾综合征5型患儿的常规实验室检查指标
川崎病伴休克及心肾综合征5型患儿的常规实验室检查指标
| 例序 | WBC(×109/L) | N(%) | CRP(mg/L) | PCT(ng/mL) | ESR(mm/H) | Na+(mmol/L) | K+(mmol/L) | ALB(g/L) | BUN(mmol/L) | Cr(μmol/L) | TnI(μg/L) | NT-proBNP(μg/L) | 蛋白尿 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 36.2 | 93.6 | >160 | 37.65 | 39 | 124.6 | 2.93 | 25.1 | 16.08 | 114.1 | 0.141 | >25 000 | + |
| 2 | 33.4 | 85.6 | >160 | 3.25 | 10 | 126.8 | 2.55 | 21.6 | 13.75 | 85.2 | 0.002 | 10 057 | + |
| 3 | 30.83 | 96.2 | >160 | >200 | 24 | 133.0 | 2.78 | 24.1 | 19.67 | 130.1 | 0.598 | >25 000 | + |
| 4 | 17.07 | 89.8 | >160 | 5.5 | 44 | 136.2 | 4.24 | 30.6 | 20.48 | 228.1 | 0.290 | 22 615 | + |
注:WBC:白细胞;N:中性粒细胞比例;CRP:C反应蛋白,参考范围0~8 mg/L;PCT:降钙素原,参考范围0~0.5 ng/mL;ESR:红细胞沉降率,参考范围0~20 mm/h;ALB:白蛋白,参考范围35~55 g/L;BUN:尿素氮,参考范围1.7~7.1 mmol/L;Cr:肌酐;TnI:肌钙蛋白I,参考范围0~0.026 μg/L;NT-proBNP:N末端脑利钠肽前体。
4例患儿均入院后完善胸片检查:2例(例1、4)可见肺纹理增多,2例(例2、3)提示肺部可见散在片影;2例(例1、3)出现不同程度心胸比增大0.55~0.60,2例(例2、4)心脏外形未见异常。4例患儿均出现轻度心电图异常,包括窦性心动过速,ST段异常改变,电轴轻度左偏等,未见心律失常。4例患儿入院时超声心动图均提示左心室射血分数值降低,波动在41%~55%(正常参考值为>60%);部分患儿合并心脏扩大、瓣膜反流及心包积液;仅1例(例3)出现冠状动脉轻度扩张,未见冠状动脉瘤。4例患儿均行泌尿系超声检查,其中2例(例2、3)提示双肾增大,回声增强,2例肾脏超声未见异常。
4例患儿入院后均给予吸氧、心电监护,同时予液体复苏、积极抗感染及营养脏器等支持治疗。予静脉泵入多巴胺及多巴酚丁胺5~10 μg/(kg·min)改善循环维持血压,血流动力学稳定后逐渐停用。KD诊断明确后均给予静脉用丙种球蛋白(intravenous immunoglobulin,IVIG)及阿司匹林,早期联合甲泼尼龙2 mg/(kg·d),并根据病情规律激素减量至停用,疗程14 d。1例(例3)患儿表现为IVIG无反应,给予第2次IVIG(1 g/kg)冲击治疗有效。4例患儿常规予磷酸肌酸钠静脉滴注,果糖二磷酸钠口服液、芪冬颐心口服液、左卡尼汀口服液、辅酶Q10片口服营养心肌治疗。心脏扩大者,血压平稳后加用卡托普利0.3~0.5 mg/(kg·d),分2~3次口服,至心脏大小恢复正常后停用。心功能下降者,肾功能恢复后可短期予地高辛5 μg/(kg·d),分2次口服增加心肌收缩力。1例(例3)患儿及时给予无创呼吸支持,无一例患儿使用肾脏替代治疗。
全部4例患儿在住院期间病情均达到临床缓解,休克救治成功,心肾功能纠正;出院时除血小板计数高于正常,1例患儿合并冠状动脉轻度扩张外,其他各项指标均恢复正常。截至2020年3月,随访时间为1~45个月,例3患儿在病程第2个月冠状动脉恢复正常,所有患儿预后良好,定期心内科门诊随诊,均未遗留脏器功能损害。
休克是机体遭受强烈的致病因素侵袭后,由于有效循环血量锐减,组织血流灌注广泛、持续、显著减少,致全身微循环功能不良,以致各重要生命器官的功能、代谢障碍和结构损害的急性全身性危重病理过程[9]。致病因素包括大出血、创伤、中毒、烧伤、窒息、感染、过敏、心脏泵功能衰竭等。CRS的概念最早出现于1951年,当时仅指继发于心力衰竭的初发或加重的肾脏功能不全。随着人们对心肾交互作用认识的加深,2008年世界肾脏学会议提出CRS新定义,即心脏和肾脏任意一个器官急性或慢性功能不全导致的另一器官急性或慢性损伤而引起的临床综合征[10]。根据疾病发生的机制和时间顺序,CRS可分为5种亚型:CRS-1为急性心肾综合征,即急性心功能障碍(如急性失代偿性心力衰竭、急性冠状动脉综合征)导致的急性肾损伤;CRS-2为慢性心肾综合征即慢性心功能障碍(如慢性心力衰竭、先天性心脏病)导致的慢性肾损伤;CRS-3为急性肾心综合征,即急性肾损伤(如急性肾小管坏死、急性肾小球疾病)导致的急性心功能障碍;CRS-4为慢性肾心综合征,即慢性肾脏病(如慢性肾小球或间质病变)导致的心功能障碍;CRS-5为继发性心肾综合征,即全身性疾病(如脓毒症、糖尿病等)导致的急性心、肾功能同时发生障碍。
KD是儿童时期常见的血管炎,病因尚不明确,但可引起一系列并发症,其中冠状动脉炎性损伤所引起的扩张和动脉瘤形成是临床治疗的热点[11,12],但KD引起的非冠状动脉并发症也可威胁患儿生命[13]。近年来,关于KD患儿在急性期休克的报道逐渐增多,但同时出现CRS-5者少见,应引起重视。本研究中以男童居多,年龄多在5岁及以下,和我国报道KD的流行病学特征相符[14]。KD急性期伴休克及CRS-5起病可以为典型KD,也可以表现为不典型KD,表现不典型者容易被误诊为脓毒性休克伴多脏器功能衰竭,而延误KD的诊断,应引起临床医师的关注。因此,对于发热、休克的患儿,伴随相关特异性症状需及时诊断以及鉴别诊断。不同人群发生CRS-5的临床特点相差迥异,且儿童CRS-5报道较少[15],本研究中4例儿童CRS-5均表现为急性心力衰竭和急性肾损伤,包括精神萎靡、呼吸心率增快、心音低钝、奔马律和尿少。KD引起休克及CRS-5的机制复杂,急性期KD血管通透性增加导致严重的毛细血管渗漏、血流动力学改变、心肌功能障碍、肾小管损伤、大量的炎症因子释放导致的全身性系统性效应、心肾交互作用等多种影响因素共同作用的结果[16,17,18]。
KD伴休克及CRS-5患儿的实验室化验结果虽然不具特异性,但提供了重要的参考价值,也进一步反映了患儿的炎症反应程度。本研究结果提示:(1)发病时患儿的白细胞计数、中性粒细胞比例、C反应蛋白及降钙素原、细胞因子等炎症指标均显著升高;(2)强烈的炎症刺激加剧毛细血管渗漏,血浆小分子蛋白及液体向血管外渗出,引起低白蛋白血症、低钠血症及低钾血症;(3)肾脏血流灌注异常,从而出现尿素及肌酐水平升高、蛋白尿;(4)TnI及NT-proBNP是重要的心肌损伤标志物,NT-proBNP更是作为诊断心力衰竭的指标[19],本研究中3例患儿出现TnI的轻度升高,但NT-proBNP均明显高于正常,这也说明本组患儿心力衰竭是急性的、短暂的,随原发病治疗好转能迅速改善。
此外,超声检查在KD伴休克及CRS-5的诊断中亦有重要价值。超声心动图依然是评估心血管异常的主要手段,可发现心腔结构的改变、瓣膜反流及关闭不全、射血分数降低、是否合并心包积液及有无冠状动脉病变等[20]。急性肾脏病变的超声表现常为肾脏体积正常或增大,肾实质回声正常或增强。本研究中4例患儿均出现超声心动图异常,其中以射血分数降低及心腔扩大多见,冠状动脉扩张仅出现在1例患儿。2例患儿出现肾脏超声异常。
治疗和预后方面,本研究中4例患儿均给予扩容、血管活性药物抗休克,以及及时对症支持治疗。因炎症反应明显,初始治疗选用IVIG联合糖皮质激素,同时保证血流动力学稳定和组织器官灌注。经上述综合方案治疗,4例患儿生命体征均逐渐平稳,异常的实验室指标均恢复正常,心肾功能完全纠正,及时正确的治疗,降低了冠状动脉病变的发生率。随访过程中,4例患儿预后良好,未遗留器官功能异常的后遗症。
综上,KD的并发症除了冠状动脉病变外还有许多,如休克、心肾综合征等,应在临床实践中予以重视,及时诊断并正确治疗,可提高患儿的生活质量,具有重要的临床意义。
所有作者均声明不存在利益冲突



























