
回顾性分析儿童激素敏感型肾病综合征合并高磷血症的情况,探讨高磷血症在儿童肾病综合征发病中的临床意义。
选择山东第一医科大学附属省立医院小儿肾脏风湿免疫科在2017年1月至2018年12月期间收治的61例儿童激素敏感型肾病综合征初治患儿,观察在病情活动期和缓解期血磷水平的变化,并分析其与血清白蛋白、血脂、肾功能、血钙、血磷、尿蛋白等指标之间的相关关系。
61例激素敏感型肾病综合征患儿在病情活动期的血磷水平为1.79(1.65,1.91)mmol/L,其中血磷升高者33例(54.1%);而在病情完全缓解后血磷水平为1.64(1.46,1.79)mmol/L,血磷升高者15例(24.6%)。相关性分析显示,激素敏感型肾病综合征患儿血磷水平与尿蛋白/肌酐比值、血清脂蛋白a、钙磷乘积呈正相关(r值分别为0.239、0.188、0.623,P均<0.05),与血白蛋白水平、血钙水平呈负相关(r值分别为-0.201、-0.195,P均<0.05)。
激素敏感型肾病综合征患儿在疾病活动期高磷血症的发生率较高,随病情缓解血磷紊乱情况明显改善,具体机制有待进一步研究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性肾病综合征是一组由多种原因引起的肾小球滤过膜通透性增加,导致体内大量血浆蛋白自尿中流失,从而导致一系列病理生理改变的临床综合征。由于肾病综合征患儿体内大量蛋白丢失,相关载体蛋白亦随之丢失,加之长期应用激素治疗,易发生钙磷代谢紊乱[1,2]。近年来研究认为,高磷血症是慢性肾脏病的特征之一,不仅与慢性肾脏病患者心血管疾病发病率密切相关,还是患者肾功能进一步下降的独立危险因素[3]。然而有关高磷血症与儿童肾病综合征关系的认识及关注较少。为此,本研究回顾性分析我院2017年1月至2018年12月收治的61例儿童激素敏感型肾病综合征合并高磷血症的情况,探讨高磷血症在儿童肾病综合征发病中的临床意义。
61例激素敏感型肾病综合征患儿中,男43例(70.5%),女18例(29.5%);年龄1.00~14.00岁(中位数3.83岁);单纯型53例(86.9%),肾炎型8例(13.1%)。其诊断和治疗均参考中华医学会儿科学分会肾脏病学组《儿童激素敏感复发/依赖肾病综合征诊治循证指南(2016)》[4]。纳入标准:激素敏感型肾病综合征;均为初治病例;既往未合并心脏、肺部、肝脏等器官功能障碍,肾功能正常。排除标准:激素耐药型原发性肾病综合征;复发或频复发肾病综合征;肾功能异常者;接受治疗前曾应用含磷药物者。治疗期间均予以优质蛋白饮食,应用糖皮质激素治疗的同时常规口服活性维生素D和钙剂治疗。
儿童高磷血症的诊断标准为血磷高于特定年龄的正常高值。儿童血磷的正常水平参考《诸福棠实用儿科学》第8版[5],即新生儿为1.4~2.8 mmol/L(4.3~8.7 mg/dL),婴儿为2~2.75 mmol/L(3.7~8.5 mg/dL),儿童为1.5~1.78 mmol/L(4.5~5.5 mg/dL)。
回顾性收集研究对象在病情活动期和完全缓解期的临床资料,包括性别、年龄、血清白蛋白、血胆固醇、甘油三酯、高密度脂蛋白胆固醇、小而密低密度脂蛋白胆固醇、低密度脂蛋白胆固醇、载脂蛋白A、载脂蛋白B、脂蛋白a、尿素氮、肌酐、血钙、血磷、尿常规、24 h尿蛋白定量、尿蛋白/肌酐比值等。观察激素敏感型肾病综合征患儿病情活动期和缓解期血磷水平的变化,并分析其与血尿指标之间的相关关系。
采用SPSS 21.0软件进行统计处理。计量资料以中位数(四分位数间距)[M(P25,P75)]表示,疾病活动期和缓解期配对样本比较采用Wilcoxon符号秩和检验。计数资料以百分比表示,组间比较采用χ2检验。相关性分析采用Spearman相关分析。P<0.05为差异有统计学意义。
61例激素敏感型肾病综合征患儿在病情活动期的血磷水平为1.79(1.65,1.91)mmol/L,其中血磷升高者33例(54.1%),血磷正常者22例(36.1%),血磷降低者6例(9.8%);而在病情完全缓解后血磷水平为1.64(1.46,1.79)mmol/L,血磷升高者15例(24.6%),血磷正常者31例(50.8%),血磷降低者15例(24.6%)。活动期和缓解期血磷水平差异有统计学意义(Z=-3.667,P<0.001);然而不同血磷水平患儿的占比差异无统计学意义(χ2=5.581,P>0.05)。
与病情缓解期相比,61例激素敏感型肾病综合征患儿在病情活动期尿蛋白/肌酐比值显著升高,血清白蛋白水平显著下降,差异有统计学意义(P均<0.01);血脂指标包括胆固醇、甘油三酯、小而密低密度脂蛋白胆固醇、低密度脂蛋白胆固醇、载脂蛋白A、载脂蛋白B、脂蛋白a,均明显升高,差异有统计学意义(P均<0.01);而血清高密度脂蛋白胆固醇、尿素氮、肌酐变化,差异无统计学意义(P均>0.05);血磷显著升高,血钙水平、钙磷乘积明显下降(P均<0.01)(表1)。
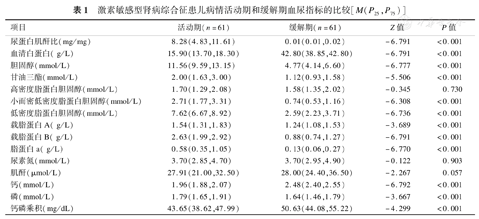
激素敏感型肾病综合征患儿病情活动期和缓解期血尿指标的比较[M(P25,P75)]
激素敏感型肾病综合征患儿病情活动期和缓解期血尿指标的比较[M(P25,P75)]
| 项目 | 活动期(n=61) | 缓解期(n=61) | Z值 | P值 |
|---|---|---|---|---|
| 尿蛋白肌酐比(mg/mg) | 8.28(4.83,11.61) | 0.01(0.01,0.02) | -6.791 | <0.001 |
| 血清白蛋白( g/L) | 15.90(13.70,18.30) | 42.80(38.85,42.80) | -6.791 | <0.001 |
| 胆固醇(mmol/L) | 11.56(9.59,13.15) | 4.77(4.14,6.60) | -6.777 | <0.001 |
| 甘油三酯(mmol/L) | 2.00(1.63,3.00) | 1.12(0.93,1.58) | -5.506 | <0.001 |
| 高密度脂蛋白胆固醇(mmol/L) | 1.70(1.29,2.08) | 1.58(1.35,2.02) | -0.345 | 0.730 |
| 小而密低密度脂蛋白胆固醇(mmol/L) | 2.71(1.77,3.31) | 0.74(0.53,1.16) | -6.308 | <0.001 |
| 低密度脂蛋白胆固醇(mmol/L) | 7.62(6.67,8.92) | 2.59(2.23,3.71) | -6.736 | <0.001 |
| 载脂蛋白A( g/L) | 1.54(1.31,1.83) | 1.24(1.08,1.53) | -3.689 | <0.001 |
| 载脂蛋白B( g/L) | 2.63(1.99,2.92) | 0.88(0.74,1.27) | -6.791 | <0.001 |
| 脂蛋白a( g/L) | 0.58(0.35,1.05) | 0.13(0.06,0.27) | -6.770 | <0.001 |
| 尿素氮(mmol/L) | 3.70(2.85,4.70) | 3.70(2.95,4.90) | -0.122 | 0.903 |
| 肌酐(μmol/L) | 27.91(21.00,32.50) | 28.00(24.40,36.50) | -2.267 | 0.057 |
| 钙(mmol/L) | 1.96(1.88,2.07) | 2.48(2.40,2.55) | -6.792 | <0.001 |
| 磷(mmol/L) | 1.79(1.65,1.91) | 1.64(1.46,1.79) | -3.667 | <0.001 |
| 钙磷乘积(mg/dL) | 43.65(38.62,47.99) | 50.63(44.08,55.22) | -4.299 | <0.001 |
相关性分析显示,激素敏感型肾病综合征患儿血磷水平与血清胆固醇、甘油三酯、高密度脂蛋白胆固醇、小而密低密度脂蛋白胆固醇、低密度脂蛋白胆固醇、载脂蛋白A、载脂蛋白B、尿素氮、肌酐均无相关关系(P>0.05),但与尿蛋白/肌酐比值、血清脂蛋白a、钙磷乘积呈正相关(r值分别为0.239、0.188、0.623,P均<0.05),与血白蛋白水平、血钙水平呈负相关(r值分别为-0.201、-0.195,P均<0.05)。
磷是人体必不可少的元素之一,它参与了人体中多种细胞活动,诸如新陈代谢、骨骼发育、能量传递、信号传导以及蛋白质功能调节等。慢性肾脏病患者磷排泄功能异常,导致磷代谢明显紊乱。处于终末期的肾脏病患者,高磷血症发生率高达70%~80%[6]。钙磷代谢紊乱亦是儿童肾病综合征的常见并发症之一,高磷血症亦存在于肾病综合征患儿。尽管肾功能正常,但大多数肾病综合征患儿,尤其是长期蛋白尿不缓解或病情严重者,高磷血症持续存在[7]。本研究结果显示,在61例肾功能正常的激素敏感型肾病综合征患儿中,病情活动期高磷血症者比例高达54.1%,而随着病情缓解,患儿血磷水平显著下降,高磷血症者减少,占比降至24.6%。相关分析显示,患儿的血磷水平与血白蛋白呈负相关,与尿蛋白/肌酐比值呈正相关。提示激素敏感型肾病综合征患儿在疾病活动期易并发高磷血症,在临床工作中应密切监测此类患儿的血磷水平。
机体内血磷水平主要受到肠道磷吸收、骨代谢以及肾脏磷排泄等因素的影响。既往研究表明,肾病综合征患儿肾小球毛细血管壁电荷屏障、机械屏障作用减弱,大量的蛋白自尿中丢失,相关载体蛋白亦随之流失,从而引起血钙水平降低、血磷升高、维生素D水平降低,钙磷代谢紊乱[1]。本研究发现,与病情缓解期相比,原发性肾病综合征患儿在病情活动期血磷升高,血钙、钙磷乘积降低;相关分析显示血磷与血钙水平呈负相关,与钙磷乘积呈正相关关系,提示肾病综合征患儿高磷血症与骨代谢异常有关。张国珍等[8]报道,肾病综合征患儿在治疗前即存在明显钙磷代谢紊乱,表现为血磷、骨碱性磷酸酶增高,血钙、25-羟维生素D3水平明显下降;应用激素治疗同时服用活性维生素D和(或)钙剂治疗后上述指标均明显改善。本组患儿在应用激素治疗的同时亦口服活性维生素D和钙剂,因此缓解期血磷水平的降低不除外活性维生素D和钙剂等药物的影响。
肾脏是重要的血磷调节器官之一。钠磷协同转运子NaPi-Ⅱa、NaPi-Ⅱc表达于近端肾小管刷状缘,具有重吸收磷的作用,肾小球滤过的磷80%~90%将被重吸收。成纤维细胞生长因子23(FGF-23)和膜结合型Klotho轴可调节NaPi-Ⅱa、NaPi-Ⅱc的表达[9]。本研究中,所有入选患儿肾功能均正常,相关分析显示血磷水平与血尿素氮、肌酐无关,而与尿蛋白/肌酐比值呈正相关。既往研究发现,蛋白尿可独立于估算的肾小球滤过率和其他混杂因素,与血磷水平相关。动物实验亦证实,当出现蛋白尿时,肾脏中FGF-23活性和Klotho蛋白表达降低,近端肾小管NaPi-Ⅱa表达增加,可导致肾脏对磷的重吸收增加,引起磷在体内潴留,血磷水平升高[10]。因此,FGF-23/Klotho表达异常是肾病综合征患者血磷升高的可能原因之一,但具体作用机制需要进一步研究证实。
近年来研究表明,血磷具有与胆固醇相似的致动脉粥样硬化作用[11,12]。本研究发现,激素敏感型肾病综合征患儿的血磷水平与血清脂蛋白a呈正相关关系。Ellam等[13]报道,大量摄入磷可加速载脂蛋白E基因敲除小鼠的动脉粥样硬化形成。在尿毒症载脂蛋白E基因敲除小鼠中,应用磷结合剂司维拉姆干预可以减缓动脉粥样硬化的发展[14]。国内刘巧等[15]通过在高磷环境下体外培养人单核细胞株源性巨噬细胞发现,钠磷转运体可介导磷离子进入巨噬细胞内,通过基因转录后机制增加固醇调节元件结合蛋白裂解激活蛋白的水平,诱导其功能失调并促进羟甲基戊二酰辅酶A还原酶和低密度脂蛋白受体的表达,促使细胞内源性胆固醇合成和外源性低密度脂蛋白胆固醇经低密度脂蛋白受体摄入的增加,最终导致细胞内胆固醇异常蓄积。这可能是高磷血症促进动脉粥样硬化发生发展的发病机制之一。既往研究证实,高脂血症可导致脂质在肾脏沉积、炎性细胞浸润、肾脏固有细胞增生和损伤、细胞外基质积聚及泡沫细胞形成,最终导致肾小球的硬化。然而,高磷血症是否参与肾脏脂质沉积的过程及具体作用机制尚不明确,需要进一步的深入研究。
综上所述,在激素敏感型肾病综合征患儿疾病活动期,高磷血症的发生率较高,随病情缓解,血磷水平明显降低。后续研究需继续深入阐明其潜在的发生机制,从而有助于制定相关防治措施以减少高磷血症带来的不良后果。
所有作者均声明不存在利益冲突



























