
比较由大豆油、中链甘油三酯、橄榄油、鱼油组成的多种油脂肪乳(商品名:合文,SMOF lipid)与中长链混合型脂肪乳(商品名:力保肪宁,Lipofundin)对早产儿肠外营养相关性胆汁淤积(PNAC)发生率的影响。
采用回顾性病例对照研究,收集2018年1月至2019年12月上海市儿童医院新生儿重症监护室出生胎龄≤34周,出生体重≤2 000 g,肠外营养使用时间≥14 d的早产儿临床资料,分为SMOF lipid组与Lipofundin组,比较两组患儿PNAC、新生儿坏死性小肠结肠炎(NEC)、支气管肺发育不良(BPD)、早产儿视网膜病(ROP)、脑室周围-脑室内出血(PVH-IVH)、晚发型败血症的发生率及肝功能变化。
SMOF lipid组患儿的PNAC发生率显著低于Lipofundin组(P=0.042);SMOF lipid组患儿的ALT、AST平均水平较Lipofundin组低(P均<0.05);SMOF lipid组患儿达到全肠道喂养时间小于Lipofundin组(P=0.005);差异均有统计学意义。两组患儿的NEC、BPD、ROP、PVH-IVH、晚发型败血症的发生率差异均无统计学意义(P均>0.05)。
与Lipofundin相比,SMOF lipid可降低早产儿PNAC的发生率,对NEC、BPD、ROP、PVH-IVH、晚发型败血症的发生率无明显影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
早产儿生后即面临营养的挑战,一系列并发症增加了早产儿对营养的需求,同时因其短期内不能耐受全肠道喂养,因此,肠外营养支持成为肠内营养的重要补充,甚至成为其营养的全部来源。肠外营养的主要成分之一是脂肪乳。脂肪乳剂的组成因生产厂家而不同。本研究中的脂肪乳剂分别是中长链混合型脂肪乳(商品名:力保肪宁,Lipofundin)和由大豆油、中链甘油三酯、橄榄油、鱼油组成的多种油脂肪乳(商品名:合文,SMOF lipid)。前者的组成成分以1∶1大豆油及中链甘油三酯为基础,并添加蛋卵磷脂与甘油。后者则含有30%中链甘油三酯、30%大豆油、25%橄榄油、15%鱼油以及维生素E等抗氧化剂,大豆油含有丰富的亚油酸及亚麻酸,其ω-6多不饱和脂肪酸(ω-6 PUFA)与ω-3多不饱和脂肪酸(ω-3 PUFA)比例为7∶1[1],而SMOF lipid因添加了一定比例的鱼油,大大提高ω-3 PUFA的比例,使ω-6 PUFA与ω-3 PUFA脂肪酸比例接近2.5∶1。ω-3 PUFA具有一定的抗炎及肝脏保护作用[2,3],因而SMOF lipid逐渐取代Lipofundin成为新生儿肠外营养的选择。本研究回顾性分析比较两种脂肪乳对早产儿肠外营养相关性胆汁淤积(parenteral nutrition-associated cholestasis,PNAC)等并发症的影响。
回顾性分析2018年1月至2019年12月上海市儿童医院新生儿重症监护病房收治的早产儿。入选标准:出生胎龄≤34周,出生体重≤2 000 g,肠外营养使用时间≥14 d。排除严重先天性畸形、代谢异常、严重窒息、围生期感染及死亡病例。按时期与使用脂肪乳种类分为2018年1~12月使用Lipofundin组和2019年1~12月使用SMOF lipid组。
于出生24 h后经中心静脉给予全合一肠外营养。脂肪乳初始量1.0 g/(kg·d),每天增加0.5~1.0 g/(kg·d),最大量不超过3.0 g/(kg·d);葡萄糖初始量4~6 mg/(kg·min),每天增加1~2 mg/(kg·min),最大量不超过11~14 mg/(kg·min);氨基酸初始量1.5~2.0 g/(kg·d),每天增加0.5~1.0 g/(kg·d),最大量3.5~4.0 g/(kg·d)。
(1)PNAC、新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、早产儿视网膜病(retinopathy of prematurity,ROP),脑室周围-脑室内出血(periventricular-intraventricular hemorrhage,PVH-IVH)、晚发型败血症发生率;(2)生后第1周至生后第6周每周监测血直接胆红素(DBil)、总胆红素(TBil)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、总胆汁酸(TBA);(3)住院期间恢复至出生体重时间、达到全肠道所需时间、机械通气时间,脂肪乳累积用量(生后首次使用脂肪乳至达到全肠内营养时累积使用的脂肪乳量)。
PNAC诊断标准:接受肠外营养≥14 d,且连续2次监测DBil≥34.2 μmol/L,排除其他原因引起的胆汁淤积性疾病[4]。
应用SPSS 23.0统计软件进行数据分析。符合正态分布的计量资料以均值±标准差(Mean±SD)表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-WhitneyU检验;计数资料以例(%)表示,组间比较采用卡方检验。采用多因素Logistic回归分析明确PNAC与影响因素的关系。P<0.05为差异有统计学意义。
研究期间共收治早产儿361例,符合入选标准137例,排除严重围生期感染9例、重度窒息5例、死亡3例、先天性畸形2例、先天性代谢疾病1例,最终纳入分析117例。Lipofundin组56例,SMOF lipid组61例。两组早产儿性别、胎龄、出生体重、分娩方式、窒息、小于胎龄儿、胎膜早破、母亲妊娠期高血压情况、脂肪乳总量比较,差异均无统计学意义(P>0.05),见表1。
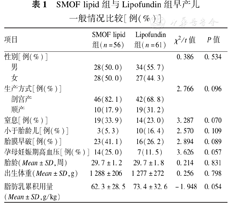
SMOF lipid组与Lipofundin组早产儿一般情况比较[例(%)]
SMOF lipid组与Lipofundin组早产儿一般情况比较[例(%)]
| 项目 | SMOF lipid组(n=56) | Lipofundin组(n=61) | χ2/t值 | P值 | |
|---|---|---|---|---|---|
| 性别[例(%)] | 0.386 | 0.534 | |||
| 男 | 28(50.0) | 34(55.7) | |||
| 女 | 28(50.0) | 27(44.3) | |||
| 生产方式[例(%)] | 2.766 | 0.096 | |||
| 剖宫产 | 46(82.1) | 42(68.8) | |||
| 顺产 | 10(17.9) | 19(31.2) | |||
| 窒息[例(%)] | 19(33.9) | 14(23.0) | 3.287 | 0.070 | |
| 小于胎龄儿[例(%)] | 3(5.3) | 10(16.4) | 2.570 | 0.109 | |
| 胎膜早破[例(%)] | 23(41.1) | 16(26.2) | 2.894 | 0.089 | |
| 孕母妊娠期高血压[例(%)] | 14(25.0) | 7(11.5) | 3.626 | 0.057 | |
| 胎龄(Mean±SD,周) | 29.7±1.2 | 29.7±1.8 | 0.214 | 0.831 | |
| 出生体重(Mean±SD,g) | 1 288±206 | 1 277±272 | 0.256 | 0.798 | |
| 脂肪乳累积用量(Mean±SD,g/kg) | 62.3±28.5 | 73.4±32.6 | -1.948 | 0.054 | |
对表1相关因素进行Logistic回归分析,脂肪乳累积用量是PNAC发生的危险因素(OR=1.041,P<0.001),见表2。
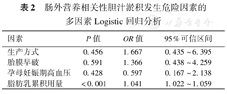
肠外营养相关性胆汁淤积发生危险因素的多因素Logistic回归分析
肠外营养相关性胆汁淤积发生危险因素的多因素Logistic回归分析
| 因素 | P值 | OR值 | 95%可信区间 |
|---|---|---|---|
| 生产方式 | 0.456 | 1.667 | 0.435~6.395 |
| 胎膜早破 | 0.591 | 1.366 | 0.438~4.259 |
| 孕母妊娠期高血压 | 0.428 | 0.597 | 0.167~2.138 |
| 脂肪乳累积用量 | <0.001 | 1.041 | 1.022~1.059 |
SMOF lipid组ALT、AST水平低于Lipofundin组,达到全肠道喂养时间短于Lipofundin组,差异有统计学意义(P<0.05);两组患儿DBil、TBil、TBA、GGT、ALP、恢复至出生体重时间及机械通气时间比较,差异无统计学意义(P>0.05),见表3。
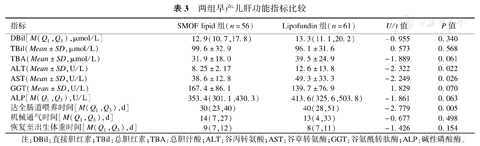
两组早产儿肝功能指标比较
两组早产儿肝功能指标比较
| 指标 | SMOF lipid组(n=56) | Lipofundin组(n=61) | U/t值 | P值 |
|---|---|---|---|---|
| DBil[M(Q1,Q3),μmol/L] | 12.9(10.7,17.8) | 13.3(11.1,20.2) | -0.955 | 0.340 |
| TBil(Mean±SD,μmol/L) | 99.6±32.9 | 96.1±31.6 | 0.573 | 0.568 |
| TBA(Mean±SD,μmol/L) | 31.9±18.0 | 39.5±24.9 | -1.889 | 0.061 |
| ALT(Mean±SD,U/L) | 8.25±2.17 | 12.6±13.8 | -2.322 | 0.022 |
| AST(Mean±SD,U/L) | 38.6±12.8 | 49.3±33.3 | -2.249 | 0.026 |
| GGT(Mean±SD,U/L) | 167.4±86.1 | 139.7±76.9 | 1.829 | 0.070 |
| ALP[M(Q1,Q3),U/L] | 353.4(301.1,430.3) | 413.6(325.6,503.8) | -1.861 | 0.063 |
| 达全肠道喂养时间[M(Q1,Q3),d] | 30(23,40) | 40(28,51) | -2.779 | 0.005 |
| 机械通气时间[M(Q1,Q3),d] | 14(7,27) | 13(4,33) | -0.677 | 0.498 |
| 恢复至出生体重时间[M(Q1,Q3),d] | 9(7,12) | 8(7,11) | -1.426 | 0.154 |
注:DBil:直接胆红素;TBil:总胆红素;TBA:总胆汁酸;ALT:谷丙转氨酸;AST:谷草转氨酶;GGT:谷氨酰转肽酶;ALP:碱性磷酸酶。
SMOF lipid组PNAC发生率明显低于Lipofundin组,差异有统计学意义(P<0.05);两组患儿晚发型败血症、化脓性脑膜炎、PVH-IVH、BPD、ROP、NEC发生率比较,差异均无统计学意义(P>0.05),见表4。
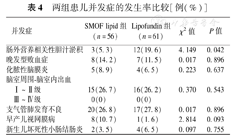
两组患儿并发症的发生率比较[例(%)]
两组患儿并发症的发生率比较[例(%)]
| 并发症 | SMOF lipid组(n=56) | Lipofundin组(n=61) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 肠外营养相关性胆汁淤积 | 3(5.3) | 12(19.6) | 4.149 | 0.042 | |
| 晚发型败血症 | 8(14.2) | 7(11.5) | 0.017 | 0.896 | |
| 化脓性脑膜炎 | 5(8.9) | 4(6.5) | 0.223 | 0.637 | |
| 脑室周围-脑室内出血 | |||||
| Ⅰ~Ⅱ级 | 15(26.7) | 16(26.2) | 0.370 | 0.543 | |
| Ⅲ~Ⅳ级 | 0(0) | 0(0) | |||
| 支气管肺发育不良 | 20(26.8) | 17(27.8) | 0.017 | 0.896 | |
| 早产儿视网膜病 | 8(10.7) | 1(1.6) | 2.814 | 0.093 | |
| 新生儿坏死性小肠结肠炎 | 2(3.5) | 4(6.5) | 0.097 | 0.755 | |
本研究结果显示,SMOF lipid组PNAC的发生率明显低于Lipofundin组,这与Diamond等[5]进行的一项多中心随机对照研究结果相符,该研究比较了24例接受植物油为基础的脂肪乳、SMOF lipid的儿童肠衰竭性肝病的发生率及肝功能指标,发现SMOF lipid可减少肠衰竭性肝病的发生。另一项回顾性研究比较了36例接受多种油脂肪乳及Lipofundin患儿的PNAC发生率,结果表明SMOF lipid组PNAC发生率明显降低[6]。本研究中SMOF lipid的优势在于提高了ω-3 PUFA的比例,ω-3 PUFA可通过多种途径抑制炎症反应[7]。早期研究表明,ω-3 PUFA可降低NF-κB激活,从而减少TNF-α产生[8];此外,研究显示ω-3 PUFA可减少炎性启动子释放,促进抑制性炎症因子IL-10产生[9],鱼油中的阿尔法-生育酚及橄榄油中的甾醇均有较强的抗氧化作用,可减少肝细胞的脂质堆积、炎症反应[10]。研究表明健康人类饮食中补充鱼油可使嗜中性粒细胞和单核细胞的趋化性降低[11]。细胞培养及动物实验表明ω-3 PUFA可使白细胞及被细胞因子激活的内皮细胞表面黏附分子表达降低,从而减弱白细胞与内皮细胞的黏附,抑制炎症反应[12,13,14]。而使用鱼油补充剂数周或数月后,前列腺素E2、白三烯-4明显降低[15,16]。本研究所涉及的胆汁淤积性肝病与炎症反应的过度激活密切相关,肝细胞炎症的本质为多种因素诱发的巨噬细胞与T细胞活化,炎症因子产生增加所导致的肝损害及肝功能障碍。此外,本研究SMOF lipid组患儿的ALT水平较Lipofundin组明显降低,这一结果可以用以上理论进行解释,与Schmöecker等[17]的动物实验结果相符,其研究发现增加ω-3 PUFA的比例可减轻小鼠的炎症性肝损伤,血清ALT水平及病理学表现均较对照组减轻。Ali和Rifaai[2]的研究也表明ω-3 PUFA通过对应激大鼠的抗氧化、抗炎和抗凋亡作用,减轻了应激性肝损伤。
本研究发现,NEC、败血症及化脓性脑膜炎等感染性疾病的发生率确有降低,但结果并无显著差异,有荟萃分析提到补充ω-3 PUFA可减少ICU患者的住院时间和机械通气时间,但在治疗败血症中的证据质量偏低[18]。为评估ω-3 PUFA在早产儿NEC发生中的作用,需进行更大规模的多中心临床研究。尽管NEC发生率无显著降低,但是SMOF lipid组患儿达到全肠道喂养时间明显缩短,SMOF lipid在提高早产儿肠道耐受能力方面可能有一定优势。
本研究将BPD作为观察结果,主要基于多项研究表明ω-3 PUFA可减轻高氧所致肺损伤,且可提高肺表面活性物质浓度[19,20,21]。此外,Uberos等[22]的一项回顾性分析表明鱼油为基础的脂肪乳可显著降低BPD的发生率[22]。但在本研究中,并未发现两组患儿的BPD发生率有显著差异,这与Collins等[23]的一项大型临床试验结论相符,该试验将1 205例患儿分为两组,对其中1组使用足剂量的ω-3 PUFA并观察BPD的发生率,结果BPD发生率并无显著降低。
血清脂联素与ROP发生呈负相关,有临床试验证明增加ω-3 PUFA的浓度可刺激血清脂联素生成,从而降低ROP的发生[24]。由于SMOF lipid增加了ω-3 PUFA的比例,因此我们预测脂肪乳SMOF lipid组患儿的ROP发生率应该会降低,但研究结果与预期相反。除本研究以外,亦有多项回顾性分析并未发现SMOF lipid的使用可减少ROP的发生[25,26],ω-3 PUFA对ROP发生率的影响可能存在一定争议,还需扩大样本量进一步研究。
目前国内主要研究了不同脂肪乳对成人及儿童患者的临床影响,而对于早产儿这一特殊群体研究较少。本研究的特色在于比较了两种不同脂肪乳对早产儿并发症的影响,局限性在于两组患儿分别处于两个不同时期,这两个时期在治疗策略上可能存在细微的差别,且研究对象平均胎龄及出生体重较大,尚不能完全反映极早早产儿的临床结局,这可能需要设计试验进一步探讨SMOF lipid对极早早产儿临床结局的影响。
综上所述,SMOF lipid的使用可降低早产儿PNAC的发病率,同时降低血清ALT与AST的水平。但仍需进行多中心的随机对照试验进一步明确SMOF lipid与BPD、NEC、ROP、PVH-IVH等疾病发生的关系。
所有作者均声明不存在利益冲突



























