
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
恶性高热(malignant hyperthermia,MH)是一种临床罕见、病情凶险的家族遗传性应激综合征,与骨骼肌钙代谢遗传缺陷相关,由挥发性麻醉药物或去极化肌松药-琥珀胆碱诱发的骨骼肌异常高代谢状态[1,2]。MH一旦发病,可短期内出现高碳酸血症、全身肌肉痉挛、体温急剧升高等临床危重症。一般的临床降温治疗措施难以有效地控制病情进展,最终患者可出现多器官功能衰竭而死亡,病死率可高达60%~90%[3,4]。因此,早期识别、诊断和治疗对于改善本病患儿的预后尤为重要。本文报道吉林大学第一医院小儿重症监护病房收治的1例MH患儿的诊疗经过,以期提高儿科医生对于该病的认识及诊治水平。
患儿,男,2个月,因"喉中痰鸣1月余、加重伴呼吸困难6 d"为主诉入院。患儿生后不久因喉中痰鸣于当地医院确诊为"先天性喉软骨软化",平素口服维生素D 400 IU/d,但患儿喉中痰鸣症状无改善,近日进乳呛咳频繁。入院前6 d患儿哭闹后出现吸气困难,安静状态下吸气性喉鸣明显。患儿无前驱感染史。患儿父母体健,无麻醉相关不良事件史。入院初期患儿查体:体温36.9 ℃,心率135次/min,血压(下肢袖带)82/53 mmHg(1 mmHg=0.133 kPa),呼吸频率42次/min,(未吸氧)经皮血氧饱和度94%~96%。活力状态可,吸气性喉鸣,胸骨上窝凹陷,脐部突出一肿物,约3 cm×2 cm,可还纳。余查体无阳性体征。实验室检查及肺部影像学检查均无异常。患儿喉软骨软化程度重,影响进乳,入院第2天按计划行全麻下(吸入七氟烷)钬激光会厌成型术,手术过程持续约10 min。返回病房初期患儿生命体征平稳,但1 h后患儿逐渐出现四肢肌肉强直、呼吸促、心率增快及顽固高热,心电监护示心率波动于200~220次/min,呼吸频率60~68次/min,经皮血氧饱和度93%~95%,体温(腋下)38.9 ℃。咪达唑伦镇静、CPAP辅助通气、药物及持续冰毯降温等均无法有效改善患儿上述症状,患儿体温1 h升至39.9 ℃,3 h后患儿体温达40.2 ℃。查体:患儿体温(腋下)40.2 ℃,脉搏216次/min,血压(下肢袖带)89/50 mmHg,呼吸频率60次/min,经皮血氧饱和度92%~95%,一般状态及反应差,全身皮肤苍白,吸气性三凹征阳性,双肺呼吸音粗,心率216次/min,律齐,心音有力,脐部肿物可还纳,四肢肌张力增高,强直、伴抖动。辅助检查:B型钠尿肽835 pg/mL;心肌损伤标志物:CK-MB 19.70 ng/mL,肌钙蛋白I 0.179 ng/mL,肌红蛋白192.9 ng/mL;血气分析(术后3 h):pH 7.26,PO2 67 mmHg,PCO2 50 mmHg, K+ 6.2 mmol/L,Ca2+ 1.12 mmol/L,BE -8.7 mmol/L,Lac 4.0 mmol/L,Glu 7.7 mmol/L,Hb 99 g/L。尿常规及肾功能未见明显异常,心电图示窦性心动过速。紧急与麻醉科医生沟通会诊,结合上述临床表现、实验室检查结果及Clinical高热评分,考虑患儿存在MH。故于术后4 h行气管插管呼吸机辅助通气并连续性血液净化治疗(continuous blood purification,CBP)。治疗期间密切监测患儿体温波动情况、尿量及肌酸激酶、肾功能等实验室结果(表1、表2)。患儿肢体强直、体温和内环境紊乱方面短期内改善。经过72 h的积极治疗,患儿各项指标趋于平稳,逐步停止上述治疗。患儿住院第7天,连续监测脏器损伤相关指标及血气分析等无异常,故准予出院。出院后分别于2周、1个月于门诊随访,患儿生长发育良好,无不良后遗症发生。
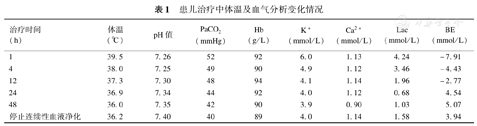
患儿治疗中体温及血气分析变化情况
患儿治疗中体温及血气分析变化情况
| 治疗时间(h) | 体温(℃) | pH值 | PaCO2(mmHg) | Hb(g/L) | K+(mmol/L) | Ca2+(mmol/L) | Lac(mmol/L) | BE(mmol/L) |
|---|---|---|---|---|---|---|---|---|
| 1 | 39.5 | 7.26 | 52 | 92 | 6.0 | 1.13 | 4.24 | -7.91 |
| 4 | 38.0 | 7.25 | 49 | 90 | 4.9 | 1.12 | 3.46 | -4.43 |
| 12 | 37.3 | 7.30 | 48 | 94 | 4.1 | 1.14 | 1.96 | -2.77 |
| 24 | 36.9 | 7.34 | 44 | 92 | 4.0 | 1.12 | 0.68 | 4.54 |
| 48 | 36.0 | 7.35 | 42 | 90 | 3.9 | 0.90 | 1.03 | 5.07 |
| 停止连续性血液净化 | 36.2 | 7.40 | 40 | 89 | 4.0 | 1.14 | 1.58 | 3.94 |
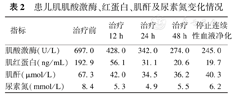
患儿肌肌酸激酶、红蛋白、肌酐及尿素氮变化情况
患儿肌肌酸激酶、红蛋白、肌酐及尿素氮变化情况
| 指标 | 治疗前 | 治疗12 h | 治疗24 h | 治疗48 h | 停止连续性血液净化 |
|---|---|---|---|---|---|
| 肌酸激酶(U/L) | 697.0 | 428.0 | 342.0 | 274.0 | 245.0 |
| 肌红蛋白(ng/mL) | 192.9 | 56.1 | 31.1 | 20.6 | 19.7 |
| 肌酐(μmol/L) | 67.3 | 42.0 | 34.5 | 36.2 | 40.3 |
| 尿素氮(mmol/L) | 8.4 | 5.3 | 4.9 | 5.5 | 6.2 |
MH是全身麻醉过程中遇到的一种罕见却可危及生命的疾病。有报道在麻醉过程中,MH的发生率为1/10 000~1/250 000,男性多于女性[4,5],儿童发病率高于成人(达1/15 000)[1,6,7]。但MH发病率的统计仍有一定误差,因为大约有一半的患者曾经历过1次或几次的麻醉操作而并未发生MH[8]。一些先天性疾病如特发性脊柱侧弯、斜视、脐疝、腹股沟斜疝等患儿往往具有MH易感性[7]。当具有MH易感性的机体暴露于特异性麻醉药物时,就会诱发本病。诱发MH最常见的麻醉药物包括氟烷和琥珀酰胆碱,此外,七氟醚、乙醚、氯胺酮、环丙烷等也可以触发MH[9,10]。
MH是一种常染色体显性遗传的亚临床肌肉病。目前大量研究证实,19号染色体上编码骨骼肌肌浆网通道蛋白蓝尼定受体-1(ryanodine receptors,RYR1)基因突变是大部分MH发生的分子生物学基础[1,2,6,11,12,13]。现认为RYR1介导的钙离子浓度失控性增高是MH发生的主要机制[12]:当该类患者暴露于诱发药物后,大量的钙离子从肌浆网释放到细胞质,远远超过肌浆网上钙泵回收能力,导致细胞内钙超载,触发骨骼肌持续强直性收缩,导致一系列临床表现:机体热量产生显著增加,骨骼肌耗能增加。当储备的能量耗竭时,发生横纹肌溶解,进而发生高钾血症、肌红蛋白尿,甚至弥散性血管内凝血。同时,其他遗传位点被证实的还有CACNAS1S基因、CASQ1基因等[2,14,15]。本例患儿亦进行了全外显子基因测序,结果回报2号染色体上ERBB4基因突变,目前报道此基因突变相关疾病为肌萎缩侧索硬化症19型,暂无本基因突变所致的MH报道。
MH的临床表现差异很大。2018年《中国防治恶性高热专家共识》中将MH分为爆发型、咬肌痉挛型、晚发作型和单一型横纹肌溶解4型[7]。其中爆发型具有MH典型的临床表现,表现为突发的高碳酸血症、酸中毒、高钾血症、心动过速和肌肉强直,短期内体温可急剧升高。但爆发型发作也有部分患者不是在麻醉诱导阶段发生,而是在术中或者手术结束后。同时多数MH患者起始症状不典型,可能早期出现咬肌痉挛,短期内不是以高热为主要症状,或在全身麻醉后几小时内出现典型症状[16],致使本病早期确诊困难。本例患儿暴露于吸入性麻醉时间仅持续10 min,术后1 h开始发作,具有典型的"一紧两高"临床表现,即四肢强直,体温增高和高碳酸血症,且很快出现血钾和肌红蛋白明显增高。结合其临床典型症状和辅助检查异常变化速度,仍考虑为爆发型MH。虽不是在术中发生,我们考虑与患儿体重低、肌容积低有关。
MH的诊断需综合多方面因素,根据应用诱发药物后出现1种或多种与MH相关的典型临床表现而做推定性诊断,但仍需与许多疾病进行鉴别。目前诊断MH的金标准为咖啡因氟烷离体骨骼肌收缩实验[17],但此实验在临床可行性极低,且假阳性率高达20%[2]。故目前临床诊断标准采用Clinical高热评分,总分在50分以上时临床可基本确诊MH[15]。本例患儿存在四肢肌肉强直伴抖动、呼吸促、体温迅速增高、心动过速及血气分析及肌红蛋白异常改变等症状,评分56分,可明确诊断本病。诊断的同时需与过敏性休克、输血反应、甲状腺危象、中枢神经系统损伤等进行鉴别诊断。
治疗上,及时识别患儿症状、早期开始干预治疗。手术过程中及时停止使用诱导药物,采用其他静脉麻醉药物维持麻醉状态。若患儿已手术结束,进入观察监护病房,需改善通气、稳定内环境及代谢情况、降温、缓解肌肉强直、监测有无肌红蛋白尿发生。目前,丹曲林是公认治疗MH的特效药物,其机制可能是稳定RYR1受体内结构域之间的相互作用,在骨骼肌兴奋-收缩耦联水平上发挥作用,使骨骼肌松弛[18]。但国内尚未批准该药,故需寻找其他能有效治疗MH的手段。参考国外应用ECMO和体外循环治疗等体外循环辅助治疗经验[19,20,21]并结合我们自身条件,我们应用了呼吸机辅助通气(SIMV模式)及CBP治疗,CBP模式选择连续性血液透析滤过。血液净化的治疗优势在于可以控制体温、酸中毒及高钾等紊乱的内环境,同时控制液体出入量,可减轻肾脏损伤、减轻心脏前负荷;并辅以右美托咪定、咪达唑仑的持续泵入,可同步降低机体代谢状态,减弱高热的感性反应。本例患儿经上述治疗后,病情明显好转。
在接受全身麻醉前对MH易感性的确定及制定合适的麻醉方案可有效预防MH的发生。当有明确MH阳性家族史(或者家族内有既往不明原因术后死亡史)的患儿,接受麻醉之前需进行详尽的询问,避免应用吸入全身麻醉,可选择静脉麻醉药或局部麻醉,同时围手术期体温监测尤为重要。对于有再生育需要的家庭,家系基因检测有一定的意义,但需注意的是,基因检测有很高的假阴性率[2],并不是所有引起MH的突变都可以被检测出来。
综上,MH为罕见的麻醉并发症,且仅有少数病例为术后于病房中发作,故儿科临床医生对于本病了解甚少,患儿得到有效治疗时机可能延迟,死亡风险高。治疗方面,由于国内缺乏特效药物,临床医生需不断探索经济适宜的治疗药物及方案。
所有作者均声明不存在利益冲突


























