
分析儿童人巨细胞病毒(HCMV)肺炎的临床特征、治疗和预后特点,评价荧光定量PCR方法检测支气管肺泡灌洗液(BALF)HCMV DNA拷贝数对HCMV肺炎的诊断价值。
在2015年1月至2019年12月中国医科大学附属盛京医院住院患儿中,收集荧光定量PCR方法检测BALF HCMV DNA阳性的58例0~7岁患儿临床资料进行回顾性分析。根据是否存在HCMV肺部活动性感染将研究对象分为HCMV活动感染组(22例)和HCMV潜伏感染组(36例),对HCMV肺炎的临床症状和体征、治疗及预后进行比较分析;绘制受试者工作特征(ROC)曲线评价BALF HCMV DNA定量检测对HCMV肺炎的诊断意义并确定诊断阈值。
(1)与HCMV潜伏感染组比较,HCMV活动感染组发病年龄更小、男性婴幼儿多见、平均住院时间延长(P<0.05)。HCMV活动感染组中,肺部湿啰音、低氧血症发生率更高(P<0.05);血清谷草转氨酶、乳酸脱氢酶、肌酸激酶均高于HCMV潜伏感染组(P<0.05);HCMV活动感染组BALF HCMV DNA拷贝数显著高于HCMV潜伏感染组(P<0.01)。HCMV活动感染组的治疗措施中额外给氧或机械通气、全身激素治疗比例高于HCMV潜伏感染组(P<0.05);HCMV活动感染组治疗结局好转出院率更低(P<0.05)。(2)ROC曲线分析结果显示,荧光定量PCR方法检测BALF HCMV DNA诊断儿童HCMV肺炎的ROC曲线下面积是0.708,诊断阈值为8.83×103 copies/mL,敏感度为77.27%,特异度为58.33%。
HCMV肺部的活动性感染即HCMV肺炎较潜伏感染更多见于男性婴幼儿,年龄更小,临床表现更严重,好转出院率较低。BALF HCMV DNA定量检测结果作为HCMV肺炎的实验室诊断指标具有临床诊断价值,诊断阈值为8.83×103 copies/mL。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人巨细胞病毒(human cytomegalovirus,HCMV)属于β疱疹病毒[1],是世界范围内人类呼吸道感染的重要病原体。健康人群的HCMV原发感染多呈无症状的隐性感染,而后病毒可以长期潜伏在体内,机体处于HCMV潜伏感染状态而无任何临床表现。免疫系统未发育成熟或免疫功能低下时,潜伏的病毒被激活,大量复制导致HCMV活动性感染,出现相应临床症状和体征[2]。新生儿及婴幼儿时期的感染可累及多个脏器或组织,HCMV肺炎可能造成支气管肺发育不良[3,4],同时也是引起造血干细胞移植、实质器官移植等免疫抑制患者死亡的重要病因[5,6]。
HCMV肺炎的诊断需要结合呼吸道症状、体征和相应的影像学表现以及病毒学检测。成人HCMV肺炎诊断已有成熟的规范[7],但儿童HCMV肺炎的明确诊断标准至今未能达成一致[8]。实时荧光定量PCR(real-time PCR)检测取材于病变部位的支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中HCMV DNA,被越来越多地用于HCMV感染的诊断,但BALF HCMV DNA阳性并不能确诊HCMV肺炎。儿童时期,特别是婴幼儿时期区分HCMV的潜伏感染和活动性感染是诊断HCMV肺炎的难点。本研究回顾性分析了BALF HCMV DNA检测阳性患儿的临床资料,通过比较分析HCMV肺炎患儿的临床特征,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,评估BALF HCMV DNA定量检测在HCMV肺炎诊断中的效用,确定诊断阈值,为其作为HCMV肺炎诊断的实验室指标提供依据。
2015年1月至2019年12月在中国医科大学附属盛京医院住院且进行BALF HCMV DNA检测阳性的患儿,阳性标本60份,来自58例患儿(其中1例患儿有3份标本检测结果阳性)。
依据中华医学会儿科学分会感染学组2012年4月制定的《儿童巨细胞病毒性疾病诊断和防治的建议》[9],临床诊断标准:具备活动性感染的病毒学证据,临床上又具有HCMV性疾病相关表现,排除现症疾病的其他常见病因后可做出临床诊断。实时荧光定量PCR法检测病毒特异性DNA载量是诊断的直接病毒学证据。根据是否存在HCMV活动性感染分为HCMV活动性感染组和潜伏感染组。
HCMV活动性感染的诊断标准:满足BALF HCMV DNA阳性和条件(1)至(5)中至少2条者:(1)除肺部疾病体征外,合并肺外器官HCMV受累症状,如肝损伤、脑干诱发电位提示听力受损、严重贫血、生长发育迟缓等;(2)肺部影像学检查显示肺间质病变;(3)血清HCMV IgM阳性;(4)长期糖皮质激素治疗、人类免疫缺陷病毒感染、器官移植后等免疫抑制或免疫缺陷者;(5)经过抗生素、平喘、对症等治疗后效果欠佳。
HCMV潜伏感染组:除外入组HCMV活动性感染组的病例后,所有BALF HCMV DNA阳性病例。
HCMV IgM检测:在知情同意的情况下,采集被检验者静脉血2 mL,2 000 g离心5 min分离血清,4 ℃保存,24 h内采用化学发光免疫分析法(TORCH试剂盒,意大利SORIN诊断医疗设备有限公司)进行HCMV IgM抗体检测。参考范围是18~22 AU/mL,>22 AU/mL判断为阳性。
HCMV DNA检测:根据病情需要,由主管医师进行纤维支气管镜检查及支气管肺泡灌洗术,取1 mL BALF进行检测;对气管插管、机械通气的早产儿进行非支气管镜支气管肺泡灌洗术收集BALF(non-bronchoscopic bronchoalveolar lavage fluid,NBBALF)。尿液样本取自清洁中段尿。所得样本均于24 h内提取核酸,采用实时荧光定量PCR方法(HCMV核酸定量测定试剂盒,上海之江生物科技股份有限公司)进行检测。结果判定以HCMV DNA拷贝数≥1 000 copies/mL为阳性,HCMV DNA拷贝数<1 000 copies/mL为阴性。
查阅病例的归档病案资料,收集一般资料,包括临床表现、体征、实验室检查结果、影像学检查结果和临床结局等。
采用SPSS 26.0软件进行分析。非正态分布计量资料以中位数(四分位数)[M(P25,P75)]表示;两组间比较采用曼-惠特尼U检验。计数资料采用例(%)表示,采用卡方检验或Fisher确切概率法,以P<0.05为差异有统计学意义。
若HCMV活动感染组与HCMV潜伏感染组的BALF HCMV DNA拷贝数差异有统计学意义,则建立ROC曲线,计算ROC曲线下面积(即AUC值)。AUC<0.5时无诊断价值,AUC为0.5~0.7时为诊断准确性低,AUC 0.7~0.9表示诊断准确性好,AUC>0.9表示诊断准确性高。计算约登指数(约登指数=敏感度+特异度-1),取约登指数最大值时的BALF HCMV DNA拷贝数作为诊断HCMV肺炎的阈值。
HCMV活动感染组22例,发病中位年龄3.5个月,包括4例早产儿,其中1例为超低出生体重儿,2例为极低出生体重儿,1例低出生体重儿。HCMV潜伏感染组36例,发病中位年龄12个月,无新生儿。两组间发病年龄(P<0.01)和性别(P<0.05)差异均有统计学意义,HCMV活动感染组发病月龄更小,且男性比例明显高于女性。HCMV活动感染组患儿合并先天性心脏病比例高于HCMV潜伏感染组(P<0.05)。
HCMV活动感染组与HCMV潜伏感染组患儿入院前病程的差异无统计学意义(P>0.05)。HCMV活动感染组患儿平均住院时间明显长于HCMV潜伏感染组,差异有统计学意义(P<0.01),见表1。
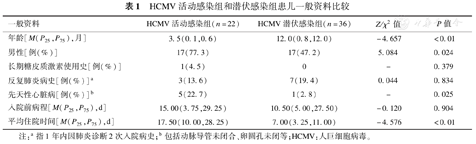
HCMV活动感染组和潜伏感染组患儿一般资料比较
HCMV活动感染组和潜伏感染组患儿一般资料比较
| 一般资料 | HCMV活动感染组(n=22) | HCMV潜伏感染组(n=36) | Z/χ2值 | P值 |
|---|---|---|---|---|
| 年龄[M(P25,P75),月] | 3.5(0.1,0.6) | 12.0(0.8,12.0) | -4.657 | <0.01 |
| 男性[例(%)] | 17(77.3) | 17(47.2) | 5.084 | 0.024 |
| 长期糖皮质激素使用史[例(%)] | 1(4.5) | 0 | - | 0.379 |
| 反复肺炎病史[例(%)]a | 3(13.6) | 7(19.4) | 0.044 | 0.834 |
| 先天性心脏病[例(%)]b | 5(22.7) | 1(2.8) | - | 0.025 |
| 入院前病程[M(P25,P75),d] | 15.00(3.75,29.25) | 10.50(5.00,27.50) | -0.120 | 0.904 |
| 平均住院时间[M(P25,P75),d] | 17.50(10.00,28.25) | 7.00(3.25,11.00) | -4.576 | <0.01 |
注:a指1年内因肺炎诊断2次入院病史;b包括动脉导管未闭合、卵圆孔未闭等;HCMV:人巨细胞病毒。
HCMV活动感染组与HCMV潜伏感染组患儿均有发热、咳嗽、咳痰、喘息症状,两组比较差异无统计学意义(P>0.05)。HCMV活动感染组患儿肺部湿啰音和低氧血症的发生率更高(P<0.05),见表2。
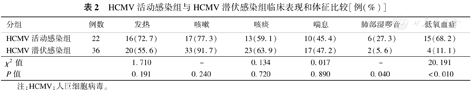
HCMV活动感染组与HCMV潜伏感染组临床表现和体征比较[例(%)]
HCMV活动感染组与HCMV潜伏感染组临床表现和体征比较[例(%)]
| 分组 | 例数 | 发热 | 咳嗽 | 咳痰 | 喘息 | 肺部湿啰音 | 低氧血症 |
|---|---|---|---|---|---|---|---|
| HCMV活动感染组 | 22 | 16(72.7) | 17(77.3) | 13(59.1) | 10(45.4) | 6(27.3) | 15(68.2) |
| HCMV潜伏感染组 | 36 | 20(55.6) | 33(91.7) | 23(63.9) | 17(47.2) | 2(5.6) | 4(11.1) |
| χ2值 | 1.710 | - | 0.134 | 0.017 | - | 20.191 | |
| P值 | 0.191 | 0.240 | 0.720 | 0.890 | 0.040 | <0.010 |
注:HCMV:人巨细胞病毒。
HCMV活动感染组与HCMV潜伏感染组患儿入院血常规检查白细胞计数、中性粒细胞比例、淋巴细胞比例、中性粒细胞计数、C-反应蛋白差异均无统计学意义(P>0.05)。HCMV活动感染组患儿血清谷草转氨酶、乳酸脱氢酶、肌酸激酶高于HCMV潜伏感染组,差异有统计学意义(P<0.05),见表3。
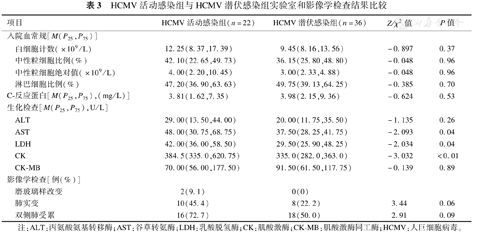
HCMV活动感染组与HCMV潜伏感染组实验室和影像学检查结果比较
HCMV活动感染组与HCMV潜伏感染组实验室和影像学检查结果比较
| 项目 | HCMV活动感染组(n=22) | HCMV潜伏感染组(n=36) | Z/χ2值 | P值 | |
|---|---|---|---|---|---|
| 入院血常规[M(P25,P75)] | |||||
| 白细胞计数(×109/L) | 12.25(8.37,17.39) | 9.45(8.16,13.56) | -0.897 | 0.37 | |
| 中性粒细胞比例(%) | 42.10(22.65,49.73) | 36.15(25.80,48.80) | -0.048 | 0.96 | |
| 中性粒细胞绝对值(×109/L) | 4.00(2.20,10.45) | 3.00(2.33,4.88) | -0.048 | 0.96 | |
| 淋巴细胞比例(%) | 47.20(36.90,63.63) | 49.75(39.13,64.25) | -0.385 | 0.70 | |
| C-反应蛋白[M(P25,P75)(mg/L)] | 3.81(1.62,7.35) | 3.98(2.15,9.36) | -0.624 | 0.53 | |
| 生化检查[M(P25,P75),U/L] | |||||
| ALT | 29.00(13.50,44.00) | 20.00(11.75,35.50) | -1.135 | 0.26 | |
| AST | 48.00(30.75,68.75) | 37.50(28.25,41.75) | -2.093 | 0.04 | |
| LDH | 42.00(36.00,58.50) | 29.50(25.90,48.25) | -2.034 | 0.04 | |
| CK | 384.5(335.0,620.75) | 335.0(282.0,363.0) | -3.032 | <0.01 | |
| CK-MB | 70.00(56.00,177.50) | 91.50(61.50,117.75) | -0.139 | 0.89 | |
| 影像学检查[例(%)] | |||||
| 磨玻璃样改变 | 2(9.1) | 0(0) | |||
| 肺实变 | 10(45.4) | 8(22.2) | 3.44 | 0.06 | |
| 双侧肺受累 | 16(72.7) | 18(50.0) | 2.91 | 0.09 | |
注:ALT:丙氨酸氨基转移酶;AST:谷草转氨酶;LDH:乳酸脱氢酶;CK:肌酸激酶;CK-MB:肌酸激酶同工酶;HCMV:人巨细胞病毒。
58例患儿均收集到影像学资料。HCMV活动感染组22例患儿中,17例行胸部CT平扫,5例行胸部DR检查;HCMV潜伏感染组36例患儿中,32例行胸部CT平扫,4例行胸部DR检查。胸部CT检查结果显示,HCMV活动感染组患儿肺部有磨玻璃样改变2例,HCMV潜伏感染组无;HCMV活动感染组与HCMV潜伏感染组患儿的肺实变及是否双肺累及的影像学表现差异无统计学意义(P>0.05),见表3。
BALF HCMV DNA定量检测结果显示,HCMV活动感染组患儿BALF HCMV DNA拷贝数明显高于HCMV潜伏感染组(P<0.01);尿液HCMV DNA的阳性率差异无统计学意义(P>0.05)。见表4。
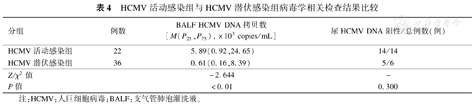
HCMV活动感染组与HCMV潜伏感染组病毒学相关检查结果比较
HCMV活动感染组与HCMV潜伏感染组病毒学相关检查结果比较
| 分组 | 例数 | BALF HCMV DNA拷贝数[M(P25,P75),×103 copies/mL] | 尿HCMV DNA阳性/总例数(例) |
|---|---|---|---|
| HCMV活动感染组 | 22 | 5.89(0.92,24.65) | 14/14 |
| HCMV潜伏感染组 | 36 | 0.61(0.16,8.39) | 5/6 |
| Z/χ2值 | -2.644 | - | |
| P值 | <0.01 | 0.300 |
注:HCMV:人巨细胞病毒;BALF:支气管肺泡灌洗液。
HCMV活动感染组患儿因低氧血症需要氧气治疗的比例明显高于HCMV潜伏感染组,其中包括4例早产儿在内的5例患儿需要机械通气治疗,差异有统计学意义(P<0.01)。为了缓解患儿感染中毒和呼吸道阻塞症状,改善脏器功能,HCMV活动感染组患儿静脉使用肾上腺皮质激素治疗比例高于HCMV潜伏感染组,两组比较差异有统计学意义(P<0.01)。两组给予丙种球蛋白免疫支持治疗的比例差异无统计学意义(P>0.05)。经过治疗后,HCMV活动感染组中16例(72.7%)患儿症状、体征好转出院,3例持续机械通气,治疗效果仍不明显,家属要求自动退院,2例症状无缓解转院治疗;1例肺部症状缓解,但肝酶持续升高,建议继续完善检查明确诊断并治疗,家属拒绝签字出院。在HCMV潜伏感染组中,36例(100%)患儿均好转出院;HCMV活动感染组好转出院率低于HCMV潜伏感染组,差异有统计学意义(P<0.01)。见表5。

HCMV活动感染组与HCMV潜伏感染组治疗措施和预后比较[例(%)]
HCMV活动感染组与HCMV潜伏感染组治疗措施和预后比较[例(%)]
| 分组 | 例数 | 吸氧或机械通气 | 全身激素治疗 | 丙种球蛋白应用 | 好转出院 |
|---|---|---|---|---|---|
| HCMV活动感染组 | 22 | 15(68.2) | 12(54.6) | 11(50.0) | 16(77.3) |
| HCMV潜伏感染组 | 36 | 5(13.9) | 8(22.2) | 9(25.0) | 36(100.0) |
| χ2值 | 17.817 | 6.315 | 3.778 | - | |
| P值 | <0.01 | <0.05 | 0.052 | <0.01 |
注:HCMV:人巨细胞病毒。
HCMV活动感染组中21例(95.4%)患儿检出合并其他病原体感染,36例HCMV潜伏感染组患儿中29例(80.6%)检出合并其他病原感染,均以细菌和支原体为主,见表6。
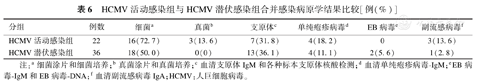
HCMV活动感染组与HCMV潜伏感染组合并感染病原学结果比较[例(%)]
HCMV活动感染组与HCMV潜伏感染组合并感染病原学结果比较[例(%)]
| 分组 | 例数 | 细菌a | 真菌b | 支原体c | 单纯疱疹病毒d | EB病毒e | 副流感病毒f |
|---|---|---|---|---|---|---|---|
| HCMV活动感染组 | 22 | 16(72.7) | 3(13.6) | 7(31.8) | 4(18.2) | 0 | 3(13.6) |
| HCMV潜伏感染组 | 36 | 18(50.0) | 0(0) | 13(36.1) | 4(11.1) | 2(5.6) | 1(2.8) |
注:a细菌涂片和细菌培养;b真菌涂片和真菌培养;c血清支原体IgM和各种标本支原体核酸检测;d血清单纯疱疹病毒-IgM;eEB病毒-IgM和EB病毒-DNA;f血清副流感病毒IgA;HCMV:人巨细胞病毒。
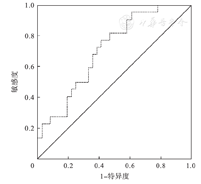
绘制ROC曲线如图1所示,BALF HCMV DNA拷贝数作为诊断HCMV活动性感染即HCMV肺炎的AUC值为0.708,诊断阈值8.83×103 copies/mL的敏感度、特异度分别为77.27%和58.33%,阳性预测值53.13%,阴性预测值80.77%。

本研究结果显示,HCMV活动感染组患儿年龄≤6个月占81.8%,提示6个月以内的婴儿是HCMV感染致病的主要人群,与报道一致[10]。HCMV有广泛的嗜组织性,感染后可能引起多种并发症,如神经系统发育异常、血小板减少、肝功能损害、耳聋等[9]。
HCMV肺炎诊断需要结合呼吸道症状、体征、影像学表现以及HCMV病毒检测等方面综合判断,并排除其他常见病原体引起的肺炎[11],难点在于儿童,特别是婴幼儿时期如何区分HCMV的潜伏感染和活动性感染。
病毒分离及培养是诊断HCMV活动性感染的有效手段,但检测周期长且易污染,不适宜作为临床快速检测方法,主要用于科学研究[10]。随着分子生物学的快速发展,HCMV DNA PCR检测因敏感度高、特异度强、快速、简便、可以定量等优点,近年来已成为HCMV感染的首选诊断方法。采用real-time PCR方法检测取材于病变部位的BALF中的HCMV DNA,对于HCMV肺炎的诊断更具有指导意义[12]。
然而,即使HCMV潜伏感染时,儿童也有较高的病毒血症和尿液病毒阳性率,且肺部是免疫抑制患者HCMV再激活的重要器官,因此BALF中HCMV DNA阳性并不足以证明HCMV在肺组织的活动性感染[5],但BALF中高水平的HCMV DNA拷贝数与HCMV肺炎有更好的相关性[13]。因此,确定阈值是BALF HCMV DNA定量检测作为诊断HCMV肺炎实验室指标的关键因素。
本研究中,BALF HCMV DNA拷贝数预测HCMV肺炎的AUC值为0.708,具有诊断价值,诊断阈值为8.83×103 copies/mL。国外相关研究得出的BALF HCMV DNA检测对HCMV肺炎的诊断阈值和诊断价值与本研究结果不尽相同[12,14,15]。2012年Kitchin等[15]的研究认为NBBALF HCMV DNA>104copies/mL需要更昔洛韦抗病毒治疗;2017年Govender等[12]的研究中NBBALF HCMV DNA诊断HCMV肺部活动性感染的阈值是4.03log IU/mL,AUC值为0.834。分析可能的原因,除了试剂的不同生产厂家、不同检测基因、不同扩增引物导致PCR扩增效率的不同外,样本采集、处理流程的不一致以及样本误差和偏倚等因素也影响阈值的判定。另外,HCMV在不同地区和国家的人群感染水平不同,导致基础DNA拷贝数存在差异也是重要的影响因素之一。针对上述原因,结合经济性、实用性和可行性考量,如何建立适合本地区人群诊断HCMV肺炎的BALF HCMV DNA定量检测阈值需要更多的研究和探索。
另外,国外多项回顾性研究均证实,HCMV活动性感染多发生于免疫抑制或免疫缺陷人群,本研究中,除1例患儿既往使用糖皮质激素长期治疗,可能对患儿的免疫系统产生抑制作用外,余HCMV肺炎患儿未见明确免疫缺陷或免疫抑制状态。分析可能的原因:一是HCMV肺炎的发病率受社会经济水平及地域等诸多因素影响;我国人口多,且农村人口比例大,卫生条件、健康意识及预防保健措施等相对落后,因此HCMV感染基数明显高于欧美发达国家[16];婴幼儿可能由于垂直传播或哺乳而感染HCMV。二是HCMV活动感染组中病例年龄小,不排除某些免疫失调综合征未被发现[17,18]。因此,如果病史中未发现免疫缺陷或免疫失调,一旦高度怀疑或诊断HCMV肺炎,应尽早评估免疫功能[8]。除了前文所述引起免疫缺陷或免疫抑制的病因外,对于继发性免疫缺陷和原发性免疫缺陷的筛查也应该考虑,例如任何原发性T细胞缺陷[19]以及干扰素产生或信号传导缺陷[20]疾病。早产后严重HCMV感染应及时筛查重症联合免疫缺陷和其他联合免疫缺陷症[20,21]。
综上所述,HCMV肺炎多见于男性婴幼儿,年龄更小,临床症状和体征表现更严重,出现不良预后概率较高。BALF HCMV DNA定量检测结果作为HCMV肺炎的实验室诊断指标具有临床诊断价值,诊断阈值为8.83×103 copies/mL。
所有作者均声明不存在利益冲突



























