
神经肌肉病是指主要累及脊髓前角运动细胞、周围神经、神经肌肉接头和骨骼肌等的一类先天性或后天性疾病,常见的症状和体征包括呼吸衰竭、骨骼畸形、关节挛缩、步态异常及移动障碍等。对于PICU的神经肌肉病患儿,病情更危重。早期进行系统性、规范性和个体化的康复训练,可以促进神经肌肉功能的恢复,预防或减少并发症,降低后期肢体功能障碍的发生率与严重程度,提高患儿远期生活质量。本文将对PICU中神经肌肉病患儿的康复训练进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
NMD是一组严重的异质性谱系疾病。从解剖结构上看,病变主要累及脊髓前角运动细胞、周围神经、神经肌肉接头和骨骼肌等[1]。如脊髓性肌萎缩症(spinal muscular atrophy,SMA)损害脊髓前角运动神经元,吉兰-巴雷综合征(Guillain Barre syndrome,GBS)损害周围神经,重症肌无力(myasthenia gravis,MG)是神经肌肉接头功能障碍,肌营养不良(muscular dystrophy,MD)为骨骼肌纤维化病变。从病因上来看,主要分为先天性(遗传性)和后天性(获得性)病变两类。先天性(遗传性)NMD如SMA、MD和先天性肌病等。后天性(获得性)NMD则包括MG、GBS、自身免疫性肌炎等类型。NMD临床上主要表现为肌张力低下和肌无力。常见的症状和体征包括呼吸衰竭、骨骼畸形、关节挛缩、步态异常等运动和移动障碍。一般来说,先天性(遗传性)NMD表现为进展性的肌无力和肌萎缩,继发性损害主要是关节挛缩和畸形、姿势不良、呼吸功能障碍等;病变具有缓慢进展的特点,预后相对较差。而后天性(获得性)NMD在病变急性期过后,神经肌肉功能会不同程度的恢复好转,预后相对较好。总体上看,大部分PICU中的NMD患儿远期都会遗留不同程度的运动、感知觉或社会适应功能障碍,严重影响患儿的社会回归和生活融入,对今后的健康成长造成严重的影响。
因此,在充分评估NMD患儿病情后,有必要在早期进行系统性、规范性和个体化的康复训练,以促进神经肌肉功能的恢复,预防或减少并发症的发生,降低后期肢体功能障碍的发生率与严重程度,提高患儿远期生活质量。与其他疾病的重症康复相同,PICU中NMD重症患儿的康复也强调重症医学科、神经内科和康复科的多学科合作,关注患儿的整体康复质量。
当NMD患儿因严重神经肌肉功能障碍而累及呼吸功能,出现不同程度呼吸衰竭时,就必须考虑收入PICU进行治疗。不同NMD病变收入PICU治疗的比例不同,重庆医科大学附属儿童医院PICU从2002年1月1日至2022年12月31日,20年间收入PICU治疗的NMD病例统计资料如表1所示。下面以PICU中常见的SMA、GBS重型、重症肌无力危象(myasthenic crisis,MC)等NMD疾病为例进行阐述。
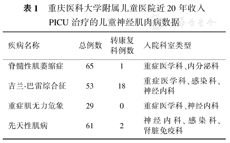
重庆医科大学附属儿童医院近20年收入PICU治疗的儿童神经肌肉病数据
重庆医科大学附属儿童医院近20年收入PICU治疗的儿童神经肌肉病数据
| 疾病名称 | 总例数 | 转康复科例数 | 入院科室类型 |
|---|---|---|---|
| 脊髓性肌萎缩症 | 65 | 1 | 重症医学科、内分泌科 |
| 吉兰-巴雷综合征 | 53 | 18 | 重症医学科、感染科、神经内科 |
| 重症肌无力危象 | 29 | 0 | 重症医学科、神经内科 |
| 先天性肌病 | 61 | 2 | 神经内科、感染科、肾脏免疫科 |
SMA是一种常染色体隐性运动神经元病变,主要是脊髓前角运动神经元进行性丧失而导致的进行性无力。SMA也是婴儿最常见的遗传性疾病死亡原因[2]。目前该病的分子机制已经基本阐明[3,4],主要是5号染色体长臂上SMN基因功能缺失突变,引起运动神经元进行性变性。SMN基因分为SMN1和SMN2两种,其中SMN2拷贝数与疾病严重程度呈负相关。临床上根据起病年龄、临床运动能力障碍严重程度将SMA分为5种类型,见表2[5]。

脊髓性肌萎缩症病变类型[5]
脊髓性肌萎缩症病变类型[5]
| 类型 | 起病年龄 | 最高成就的运动里程碑 | 预期寿命a | 脊髓性肌萎缩症患者比例 | SMN2基因拷贝数 |
|---|---|---|---|---|---|
| 0型 | 出生 | 无法独坐 | <6个月 | <1% | 1 |
| Ⅰ型 | <6个月 | 无法独坐 | 8~24个月 | 50%~60% | 2~3 |
| Ⅱ型 | 6~18个月 | 可以独坐 | 20~30岁 | 30% | 2~4 |
| Ⅲ型 | 18个月~30岁 | 可以行走 | 正常 | 10% | 3~5 |
| Ⅳ型 | >30岁 | 可以行走 | 正常 | 5% | 3~5 |
注:a未经药物或机械通气治疗情况下。
虽然目前已经研制出具有针对性的基因治疗药物[6],但由于价格、可及性等多方面原因,仍有大量的SMAⅠ型患儿不能得到及时的治疗。患儿在病程晚期,当病变累及呼吸肌,出现严重呼吸衰竭时,需要进入PICU治疗。
GBS是一种自身免疫介导的神经损伤,以快速进行性和对称性上升无力的急性发作为特征。目前,GBS是一种多神经根神经病综合征,包括急性炎性脱髓鞘性多神经根神经病变、急性运动轴突神经病、急性感觉轴突神经病变和Miller Fisher综合征。目前该病病因尚未完全清楚,可能与多种病原感染有关,包括巨细胞病毒、爱泼斯坦-巴尔病毒、单纯疱疹病毒、支原体、流感和空肠弯曲杆菌[6]。寨卡病毒最近与几个国家GBS发病率的增加有关[7,8]。
GBS的主要临床特征是两侧肢体对称性无力、反射减少或丧失。颅神经可能受到影响,肌无力主要影响面部和口咽肌肉。临床上GBS患者病情进展和严重程度差异较大,一般不需要收入ICU治疗。但是出现如呼吸肌在内的肌无力情况快速进展、延髓功能障碍和双侧面瘫、自主神经功能障碍,以及心律失常和心动过缓等表现,则提示为GBS重型,通常需要进入ICU进行通气支持治疗[9]。
MG是一种以神经肌肉接头功能障碍为特征的自身免疫性疾病。最常见的原因是抗体对抗突触后乙酰胆碱受体(AChR)。按针对突触后膜不同成分的抗体,分为抗AChR、抗肌肉特异性酪氨酸激酶(MuSK)和抗脂蛋白受体相关蛋白4(LRP4)三种类型。大约85%的抗体针对AChR,其中AChR血清阴性的MG患者中有50%的体内存在针对MuSK的抗体,而MuSK通常与延髓和呼吸肌活动有关[10,11]。
疲劳性虚弱是MG的特征。所有肌肉群都会受到影响。患者可能因持续仰视而导致上睑下垂。眼炎很常见。眼外肌的无力很少是对称的,而肢体无力与近端优势对称。MG危象是MG患者入住ICU的最常见原因。大约20%的患者在诊断的第1年内会出现危象,通常是由诱发因素引发的。ICU常见的诱发MG危象药物包括氨基糖苷类、喹诺酮类、锂和钙通道阻滞剂、氯丙嗪、头孢菌素和青霉素。虽然MG危象少见,但患者常因呼吸功能障碍而入住ICU。
根据《神经重症康复中国专家共识》提出的建议[12,13,14],儿童NMD重症康复的开展也可采用这两种工作模式:一是由康复科重症康复医师进驻PICU或神经重症监护病房,或者请康复科专家会诊,制定康复方案并负责在PICU中实施;二是在康复科内部建立神经重症康复病房/床,称之为神经重症康复过渡病房[15]。PICU请康复科会诊评估患儿转科风险,允许的话则转入康复科进行治疗,必要时包括带呼吸机转入。这也是我院目前实行的运行模式。
对于第一种工作模式,由于重症康复专家受PICU或神经重症监护病房的邀请,在PICU或神经重症监护病房的病房内对NMD重症患者进行早期康复管理,面临的医疗风险、工作难度相对较小。但是由于在PICU或神经重症监护病房开展康复项目的条件有限,会对康复治疗的效果产生一定影响。后期患儿病情改善,需在临床监护及处置基础上转入康复科的神经重症康复病房,进行进一步的康复治疗。这种方式虽然风险相对较小,但是会占用ICU或神经重症监护病房病床,造成医疗资源的浪费,增加了患儿家庭和社会的经济负担。
对于第二种工作模式,其优缺点与第一种模式正好相反,因为康复病房生命支持的条件有限,当患儿出现病情加重或面临生命危险时,难以得到完善的生命支持服务,存在的医疗风险相对较大。
需要注意的是,各个医院开展NMD重症康复治疗时,并不意味着只能选择上述两种模式中的一种。应该根据自身具体的条件出发,灵活选择。例如对于病情不平稳,但有必要早期康复介入,以获得更好远期收益的患儿,可以在PICU中开展康复治疗活动。而对于早期康复相对要求不是非常迫切的,可以待其病情完全稳定后,再转入康复病房开展康复治疗。总而言之,对于NMD重症患儿,需要PICU医生、神经内科医生和康复科医生开展多学科会诊评估,在保证患儿医疗安全、合适的经济负担条件下,尽早开展重症康复工作。
如前所述,NMD为谱系性疾病,不论是先天性还是获得性NMD,其临床表现都类似,主要表现为四肢或躯干肌肉的肌张力低下、肌无力,以及继发的关节畸形和关节挛缩等。尽管SMA、GBS、MC在致病机制上存在差异,但这3种疾病的重症类型在临床表现上均相似,都表现为周围性呼吸衰竭。因此,重症NMD患儿的康复训练原则、思路和采用的技术都大体相同,都是针对患儿通气功能障碍为主进行康复训练,只是在具体病例的康复治疗上,则需根据其临床特点,在技术选择上有所侧重。临床上根据NMD疾病临床表现和可能发生的并发症,常采用以下技术进行康复训练:物理治疗、运动治疗、心理治疗、康复护理等。
如前所述,SMA病变的临床严重程度与其类型密切相关,0型、Ⅰ型和Ⅱ型病变较为严重,后期常累及呼吸肌导致呼吸功能障碍及呼吸系统感染等并发症,常需收入PICU治疗。因此,这3种SMA类型患儿是PICU中需要进行早期康复治疗的对象。而Ⅲ型和Ⅳ型SMA因为起病及发病进展缓慢,临床表现相对较轻,一般不需要收入PICU治疗。
由于收入PICU中的SMA病例往往累及呼吸功能障碍,容易发生呼吸道感染,故康复治疗的重点应放在呼吸道的管理和呼吸功能障碍的治疗上。主要原则包括:
(1)患儿出现呼吸障碍应行辅助通气治疗,保持换气功能达到正常水平。对于症状相对较轻的病例,可以尝试使用无创呼吸机。但小年龄患儿咳嗽、吞咽、呼吸功能都不好,需要特别谨慎。大多数严重患儿在PICU都需要气管插管、有创呼吸机机械通气。采用的通气模式没有固定的方案,A/C模式下定压通气或定容通气;或间隙指令通气+压力支持通气都可以,重点是要能保证通气效果。同时加强气道管理,通过机械吸/呼动作帮助痰液排出,减少气道感染机率。合并肺炎时注意听诊是否有痰鸣音,当SpO2突然降至90%以下、咳嗽次数增多、呼吸频率加快、气道内压力明显增高、气管切开套透明管内见痰液喷出、心率增快为吸痰指标[15]。调节吸气压力80~100 mmHg(1 mmHg=0.133 kPa),一般选择8F吸痰管,吸痰时间最好控制在10~15 s内,吸痰管植入气道后需旋转提拉,以便尽量吸出黏稠痰液。吸痰中严格无菌操作,注意更换吸痰管。患儿口腔分泌物多,则给予35 mmHg压力口腔持续低负压吸引[16]。呼吸机面板每天要进行消毒,予湿巾擦拭,一次性管道保持1周更换1次。
(2)物理治疗上鼓励患儿运动、活动,增强肌肉力量和灵活性,维持气道换气功能正常。同时注意康复运动的强度,预防脊柱变形和关节挛缩。
对于0型SMA,由于起病早,患儿年龄幼小,病变进展快,预后极差。因此,不提倡积极高强度的物理康复训练,应根据病情,综合衡量患儿康复训练承受能力、康复获益和经济承受能力,采用适当的康复方案治疗。对于Ⅰ型SMA,面临的主要问题是起病急,进展快,肌肉无力程度重,不能抬头、独坐和行走,故治疗的原则应以被动关节活动度训练为主,尽量保持肌肉张力和关节活动度。对于Ⅱ型SMA,患儿可独坐,但不能站立行走,故治疗重点是提高躯干和四肢肌肉力量,促进独坐位抗重力训练,完善平衡能力,达到坐位时独立活动的能力。故主要应采用核心稳定性训练和坐位平衡训练。
(3)作业治疗上以促进肢体功能恢复,改善日常生活能力,如吸吮进食能力训练等为主。由于进食功能是人类生存的基本功能,越早获得进食能力,对其日后的生长发育具有较大影响。所以不管患儿年龄大小,均应早期开始指导训练。
(4)在心理康复及护理康复治疗上,因患儿年龄偏小,与父母处于分离状态,且面临频繁机械通气、吸痰、静脉注射、采血等侵袭性操作带来的疼痛和不适,故心理治疗主要以分散转移注意力为主,使用不同色彩的图片、图画书、手机和平板电脑等,降低患儿对环境和医护人员的恐惧心理。也可辅助使用身体语言、微笑的表情消除其抵触心理,稳定其情绪。同时康复护理上要着重呼吸道的管理:采用徒手或机械胸部物理治疗移动分泌物;摆放适当体位,坚持体位引流;必要时可每2~4小时进行1次机械吸痰操作,尽量避免呼吸道感染的发生。
收入PICU的GBS患儿一般为病变累及延髓和引起呼吸肌麻痹而危及生命的病例。临床常表现为颅神经、感觉神经障碍和呼吸肌麻痹等。其中颅神经损害常以Ⅶ、Ⅸ、Ⅹ、Ⅺ、Ⅻ对病变为主,导致面瘫、语音低微、吞咽困难、饮食呛咳等。感觉神经障碍表现为神经根痛、四肢肌肉压痛、皮肤感觉过敏、手套状及袜套状感觉障碍。呼吸肌麻痹表现为胸闷、气短、咳嗽无力、胸式或腹式呼吸减弱,严重者出现缺氧和呼吸道并发症。由于GBS病程上分为急性期和恢复期,而收入PICU的病例一般均处于病程的急性期,故以下康复训练内容以急性期康复治疗为主。
GBS重型康复治疗的原则为:在糖皮质激素、丙种球蛋白、血浆置换和辅助呼吸等对症治疗基础上,针对延髓麻痹、呼吸肌麻痹引起的上呼吸道功能障碍、膈肌和肋间肌无力,进行适当的呼吸功能训练,有效阻止患儿因肌力减退所致的肺功能损害。
(1)在物理治疗上,对于急性期或亚急性期肺功能降低,呼吸无力、咳嗽排痰无力者,着重指导其进行呼吸训练,包括腹式呼吸训练、咳嗽呼吸训练。腹式呼吸训练根据患儿情况可采取仰卧位、半卧位或坐位,让患儿一只手放在腹部,感觉腹式呼吸活动。另一只手放在胸部,感觉上胸及肋间呼吸肌的活动,经鼻腔做深呼吸,吸气时向上隆起腹部使胸廓保持最小。呼气时腹肌和手同时下压腹腔,增加腹内压,膈肌上抬。咳嗽呼吸训练则是让患儿处坐位或半卧位,稍向前弯腰,手置于剑突下,深吸气并保持闭气2~4 s,再爆发性用力咳嗽,以助于痰液排出。
除了针对呼吸和咳嗽功能的物理治疗外,还应该早期针对并发症进行康复治疗。GBS症状高峰期常出现在起病后2周内,早期进入康复治疗可有效预防肌肉萎缩、关节强直和畸形等并发症,还可预防压疮、局部神经压迫和深静脉血栓的发生。早期运动康复包括良姿势体位摆放,穿弹力袜和对受累肢体关节进行全关节范围各轴向被动活动。此外,还可以同时采用物理因子治疗技术,包括电刺激减轻肌肉萎缩,温热疗法改善血液循环,促进感觉和随意运动功能的恢复。
(2)疼痛的康复治疗:GBS病程中常伴随有强烈的神经根和肌肉疼痛,甚至可能以疼痛为临床的主要表现。可综合采用心理治疗、运动疗法和物理因子治疗等方法来有效减轻疼痛感受。其中运动治疗还有助于增加关节活动范围,提高肌肉力量。中高频电刺激、经皮电刺激等疗法有助于减轻局部炎症,改善血液循环,降低血栓发生可能。
(3)心理康复治疗:由于GBS患儿年龄范围广,从婴幼儿到学龄前期、学龄期均可罹患该病,因此对于不同年龄段儿童,应该采用不同的心理康复方法。对于低龄GBS重型患儿,与0型、Ⅰ型、Ⅱ型SMA患儿都表现为运动功能、呼吸功能障碍,不能自由活动,且所处的ICU环境也类似,故造成的心理创伤、心理障碍差异不大,所以两者心理康复的处理原则和方法也不同小异,在此不再赘述。对于年龄较大的GBS重型患儿,如学龄前、学龄期儿童和青少年,因为具有较好的语言表达和交流能力,医护人员可以用微笑的态度,反复讲解、宣教、适当的鼓励等方式,减少其抗拒心理,满足其心理需要,顺利配合治疗的实施。
MG发生前常有一定的征象,如复视、肢体无力加重、竖颈无力、构音障碍、吞咽障碍、咳嗽咳痰困难、球部肌肉无力、说话鼻音等[16,17]。而收入PICU的患儿MG危象主要表现为呼吸肌群麻痹,出现呼吸困难加重、反常腹式呼吸、辅助呼吸肌参与的"三凹征",并伴有语音低微、呼吸无力等呼吸窘迫体征,部分患儿因无法清除喉头分泌物,导致误吸、喉头堵塞、窒息等表现。根据以上MG危象的表现,MG的康复原则是在使用胆碱酯酶抑制剂、激素、大剂量免疫球蛋白和胸腺切除治疗的基础上,进行适当的包括神经肌肉药物、物理治疗和呼吸治疗在内的多学科联合康复治疗方案。在康复治疗介入时间的选择上,应坚持在患儿生命体征恢复平稳的情况下,尽早进行康复训练。物理治疗主要进行呼吸肌训练,提高和改善肌力,分级强化训练帮助患儿尽可能保持功能。作业治疗有助于患儿利用节能和补偿技术进行日常生活的新方式。语言治疗有利于患儿吞咽困难和构音障碍功能的恢复。由于MG患儿多数存在焦虑、抑郁、失眠等心理障碍,且部分患儿MG危象的诱发也有心理因素的参与,故必要时,还需采取心理康复措施来应对疾病的发生发展。如早期心理应激干预,加强MG危象诱发因素的宣传教育等。对咽喉肌受累的MG危象患儿,应及时给予饮食指导,鼓励患儿多参加康复活动,尽早恢复患儿战胜疾病的信心。在康复护理方面,应加强患儿气道分泌物管理,多注意休息、保暖,避免疲劳、受凉、感冒、情绪波动等,以利于症状缓解和病情控制。
儿童与成人康复最大的区别就在于儿童处于生长发育的阶段,早期康复介入治疗,能够获得比成人更理想的康复效果。而且NMD一般都仅累及周围神经及以下的神经肌肉结构,患儿的智力一般不会受到影响,因此,PICU中的重症NMD患儿更有必要早期进行康复训练,减少残障的发生或减轻残障程度,对儿童本身、整个家庭和社会生活参与度乃至整个社会都有积极的意义。当然在重症NMD的康复过程中,应该根据儿童生长发育不同阶段的特点,病因性质和病情的轻重程度,灵活选择康复治疗策略,争取达到最佳的康复治疗效果。
所有作者均声明不存在利益冲突



























