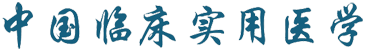
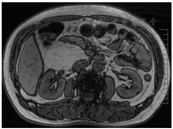
患者男,57岁,因"上腹痛10余d"于2021年12月27日就诊于安徽中医药大学附属芜湖市中医医院专硕研究生培养基地外三科。疼痛呈持续性隐痛,伴后背部胀痛,前倾位疼痛缓解,大便次数增多,每日4次,否认黏液便及血便,近3个月体质量下降约2 kg,既往有高血压、高血脂病史2年余,否认饮酒、吸烟史,否认肿瘤相关疾病家族史。入院体格检查:神志清晰,全身皮肤巩膜无黄染,浅表淋巴结未触及明显肿大,腹平软,肝脾肋下未触及,右上腹部及剑突下深压痛(+),反跳痛(-),右中上腹部可触及一界限不清肿块,质地中等,活动度欠佳。上腹部平扫+增强CT检查提示:肝脏与胰头间腹膜后脂肪源性肿块,胃窦壁稍厚。上腹部上腹部磁共振成像(magnetic resonance imaging,MRI)检查提示:胰头、右肾、下腔静脉之间异常信号包块,T1WI及T2WI呈高信号,抑脂信号减弱,周围组织可见推压征象,考虑脂肪瘤,高分化脂肪肉瘤不除外(图1)。血液癌胚抗原、甲胎蛋白、糖类抗原CA-125、糖类抗原CA-199、总前列腺特异性抗原、游离前列腺特异性抗原等肿瘤标志物检查均在正常参考值范围。血常规、肝肾功能及胰腺内外分泌功能检测等均未见异常。患者于2022年1月10日在全身麻醉下行"腹腔镜腹膜后肿瘤切除术",术中见肝胆胰脾及胃肠道、盆腔无异常,肝下十二指肠右侧接近右肾门处有一大小约9 cm×8 cm×6 cm类圆形包块,有完整包膜,质地中等,肿块内侧与十二指肠及胰头有粘连,有一定活动度,完整游离肿块,处理肿块与胰腺之间粘连,结扎血管,切除肿块,冲洗腹腔,右肝下腹膜后置引流管,关腹。术后予以预防感染、抑酸、抑酶、补液等治疗。术后第1、3、5、8天腹腔引流液分别为470 ml、200 ml、50 ml、20 ml,腹腔引流液淀粉酶分别为14 065 U/L、560 U/L、80 U/L、10 U/L,血淀粉酶分别为1 314.8 U/L、450.0 U/L、112.9 U/L、20.6 U/L,手术切口甲级愈合,术后10 d复查CT提示肝肾隐窝有少量积液,于2022年1月22日带管出院。2022年2月10日门诊随访,一般情况尚可,饮食及二便正常,B超复查未见异常,予以拔管。2022年5月30日门诊随访,患者情况尚好。术后病理检查:大体观灰黄色肿瘤,大小约8 cm×8 cm×6 cm,类圆形,分叶状,包膜完整,包膜周围未见粘连的其他脏器组织,切面质嫩灰黄色,中心部分区域可见少许似海星样灰白色纤维样组织。镜下检查见肿瘤表面为完整的纤维性包膜,肿瘤组织主要由大量成熟的脂肪组织、纤维结缔组织、大小不等的厚壁和薄壁血管、少量成熟的淋巴组织、周围神经组织组成,其内混杂的纤维结缔组织中可见形态良好的腺泡细胞和导管,细胞无异型性(图2)。免疫组化检查结果示管状腺体CK7(+),CK20(-), CDX2(+),SMAD4(+),腺泡细胞trypsin(+),syn(-)。S-100脂肪细胞(+),梭形细胞少许(+),CD34脂肪细胞(+),血管内皮(+),Vim梭形细胞(+),脂肪细胞(+),平滑肌肌动蛋白(-),肌细胞生成素(-),B淋巴细胞瘤-2基因少许梭形细胞,CD10部分脂肪细胞、梭形细胞(+),细胞增殖抗原标记物(-),增殖细胞核抗原腺上皮(+),淋巴细胞(+),脂肪细胞梭形细胞(少许+),Des部分梭形细胞,CK7(-),CK5腺泡、导管上皮(+)。病理诊断:腹膜后胰腺错构瘤(pancreatic hamartoma,PH)。患者术后有少量胰漏发生,经通畅引流治愈,术后随访6个月情况良好。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,57岁,因"上腹痛10余d"于2021年12月27日就诊于安徽中医药大学附属芜湖市中医医院专硕研究生培养基地外三科。疼痛呈持续性隐痛,伴后背部胀痛,前倾位疼痛缓解,大便次数增多,每日4次,否认黏液便及血便,近3个月体质量下降约2 kg,既往有高血压、高血脂病史2年余,否认饮酒、吸烟史,否认肿瘤相关疾病家族史。入院体格检查:神志清晰,全身皮肤巩膜无黄染,浅表淋巴结未触及明显肿大,腹平软,肝脾肋下未触及,右上腹部及剑突下深压痛(+),反跳痛(-),右中上腹部可触及一界限不清肿块,质地中等,活动度欠佳。上腹部平扫+增强CT检查提示:肝脏与胰头间腹膜后脂肪源性肿块,胃窦壁稍厚。上腹部上腹部磁共振成像(magnetic resonance imaging,MRI)检查提示:胰头、右肾、下腔静脉之间异常信号包块,T1WI及T2WI呈高信号,抑脂信号减弱,周围组织可见推压征象,考虑脂肪瘤,高分化脂肪肉瘤不除外(图1)。血液癌胚抗原、甲胎蛋白、糖类抗原CA-125、糖类抗原CA-199、总前列腺特异性抗原、游离前列腺特异性抗原等肿瘤标志物检查均在正常参考值范围。血常规、肝肾功能及胰腺内外分泌功能检测等均未见异常。患者于2022年1月10日在全身麻醉下行"腹腔镜腹膜后肿瘤切除术",术中见肝胆胰脾及胃肠道、盆腔无异常,肝下十二指肠右侧接近右肾门处有一大小约9 cm×8 cm×6 cm类圆形包块,有完整包膜,质地中等,肿块内侧与十二指肠及胰头有粘连,有一定活动度,完整游离肿块,处理肿块与胰腺之间粘连,结扎血管,切除肿块,冲洗腹腔,右肝下腹膜后置引流管,关腹。术后予以预防感染、抑酸、抑酶、补液等治疗。术后第1、3、5、8天腹腔引流液分别为470 ml、200 ml、50 ml、20 ml,腹腔引流液淀粉酶分别为14 065 U/L、560 U/L、80 U/L、10 U/L,血淀粉酶分别为1 314.8 U/L、450.0 U/L、112.9 U/L、20.6 U/L,手术切口甲级愈合,术后10 d复查CT提示肝肾隐窝有少量积液,于2022年1月22日带管出院。2022年2月10日门诊随访,一般情况尚可,饮食及二便正常,B超复查未见异常,予以拔管。2022年5月30日门诊随访,患者情况尚好。术后病理检查:大体观灰黄色肿瘤,大小约8 cm×8 cm×6 cm,类圆形,分叶状,包膜完整,包膜周围未见粘连的其他脏器组织,切面质嫩灰黄色,中心部分区域可见少许似海星样灰白色纤维样组织。镜下检查见肿瘤表面为完整的纤维性包膜,肿瘤组织主要由大量成熟的脂肪组织、纤维结缔组织、大小不等的厚壁和薄壁血管、少量成熟的淋巴组织、周围神经组织组成,其内混杂的纤维结缔组织中可见形态良好的腺泡细胞和导管,细胞无异型性(图2)。免疫组化检查结果示管状腺体CK7(+),CK20(-), CDX2(+),SMAD4(+),腺泡细胞trypsin(+),syn(-)。S-100脂肪细胞(+),梭形细胞少许(+),CD34脂肪细胞(+),血管内皮(+),Vim梭形细胞(+),脂肪细胞(+),平滑肌肌动蛋白(-),肌细胞生成素(-),B淋巴细胞瘤-2基因少许梭形细胞,CD10部分脂肪细胞、梭形细胞(+),细胞增殖抗原标记物(-),增殖细胞核抗原腺上皮(+),淋巴细胞(+),脂肪细胞梭形细胞(少许+),Des部分梭形细胞,CK7(-),CK5腺泡、导管上皮(+)。病理诊断:腹膜后胰腺错构瘤(pancreatic hamartoma,PH)。患者术后有少量胰漏发生,经通畅引流治愈,术后随访6个月情况良好。

注:MRI为磁共振成像

"错构瘤"首先由德国病理学家E Albrecht于1904年提出,通常可发生在肺、肝、肾、脾或其他血管器官,发生在胰腺处的较少。目前认为错构瘤是一种表现为所涉及器官的正常组织成分的异常混合,即受影响部位的正常细胞和组织无序生长所形成的类瘤样畸形[1,2]。PH可为实性或囊实混合性,单发或多发,可分布在胰腺各个部位,但以胰腺头部多见,体尾部相对少见[1,3]。临床上PH可无特异性表现,可有疼痛、腹部不适、消化不良和体质量减轻,也有在体检时偶然发现[2]。PH实验室检查多无异常,血清肿瘤标志物正常。CT多表现为边境清晰的等密度或低密度团块,部分内部可见脂肪密度[4]。MRI检查T2WI边境清晰,内部强度稍不均匀,T1WI显示低强度,T2WI显示等至高强度,弥散加权成像显示等强度[5]。国建林等[6]认为,MRI检查为长T1、长T2信号,常伴囊性改变,弥散加权成像呈等或高信号。有研究表明,渐进性明显强化是PH影像学检查的显著特点[5,6,7,8]。方旭等[7]认为,该强化方式的病理基础是由于病变含有错排的腺泡、导管和内分泌细胞成分,增强后均有一定程度的强化,加之大量纤维成分富含毛细血管,表现出渐进性明显强化。PH的确诊依赖于病理学检查。由于多为个案报道,目前尚缺乏统一的组织学诊断标准,目前比较支持Pauser等提出的组织学诊断标准:(1)肿块界限清楚;(2)由成熟的腺泡和结构扭曲的导管组成;(3)缺乏分化良好的胰岛[3]。
PH虽系良性类瘤样病变,但很难通过影像学检查予以确诊,且胰腺位于腹膜后间隙,部位深,周边组织结构复杂,难以通过非手术方法获取病理学检查标本,大多数患者接受手术治疗[5,9]。由于PH临床生物学行为属良性病变,对术前考虑PH的患者,在术中快速病理排除了胰腺肿瘤性病变后,可沿肿块包膜完整切除,确保切缘无病变组织残留即可,不应随意扩大手术切除范围。对与正常胰腺之间的纤维组织粘连要妥善处理,予以确切的缝扎,以免引起胰漏等并发症的发生。术后应保持腹腔引流通畅,需观察引流量及引流液淀粉酶变化。
所有作者声明无利益冲突


























