
总结自身免疫性胰腺炎(AIP)的CT及MRI影像学特征,探讨其诊断与鉴别诊断要点。
采用回顾性描述性研究方法。收集2012年2月至2015年2月内蒙古医科大学附属医院收治的21例AIP患者的临床资料。患者行CT平扫及增强扫描、MRI平扫及增强扫描、MRCP检查,完善检查后行激素治疗。选取同一时期行MRI检查并确诊的胰腺癌及正常胰腺受试者各11例,分别测量其表观弥散系数(ADC)值进行比较。观察指标:(1)影像学检查情况:①胰腺表现:胰腺密度和信号,胰腺萎缩和钙化,胰腺增大,胰管改变。②胰腺外表现:胆道系统及肾脏改变。③弥散加权成像(DWI)及ADC值:比较AIP、胰腺癌和正常胰腺ADC值。(2)诊断情况。(3)治疗及随访情况。采用门诊及电话随访,随访内容为患者的临床症状及体征,随访时间截至2016年2月。正态分布的计量资料以 ±s表示,多组间比较采用单因素方差分析。两两比较采用Dunnett′ T3法检验。
±s表示,多组间比较采用单因素方差分析。两两比较采用Dunnett′ T3法检验。
(1)影像学检查情况:21例患者中,17例行CT检查,11例行MRI检查(其中7例联合行CT检查)。①胰腺表现:胰腺密度和信号MRI检查示胰腺弥漫性增大14例,边缘饱满,呈"腊肠样"改变。CT平扫呈均匀等密度影,增强扫描动脉期强化程度减低,门静脉期及延迟期逐渐均匀强化,边缘未见强化。MRI平扫病灶T1加权成像呈稍低信号,T2加权成像呈稍高信号,DWI呈高信号,增强扫描呈延迟强化;病灶边缘T1、T2加权成像均呈稍低信号,增强未见强化。胰腺萎缩和钙化:3例胰腺实质萎缩,内见散在钙化。胰腺增大:4例胰腺局限性增大呈"假肿瘤样"改变,其中胰头部局限性增大2例。胰管改变:MRCP检查示4例表现为胰管弥漫性狭窄,3例表现为局限性狭窄,1例局限性扩张。②胰腺外表现:MRCP检查示11例患者表现为胆道系统改变,可见肝内胆管及胆总管扩张,部分狭窄,胆管壁广泛增厚,MRI增强扫描检查示胆管壁呈明显强化。4例患者行MRCP检查可见胆总管末段呈"鸟嘴样"狭窄。3例患者表现为肾脏改变,CT增强扫描检查动脉期可见肾脏斑片状低密度影,延迟期斑片状低密度影均匀强化,MRI平扫T1抑脂序列图像示肾脏病灶呈等信号,T2抑脂序列图像呈斑片状低信号。实质期及延迟期病灶逐渐均匀强化。③DWI及ADC值:AIP患者及胰腺癌患者DWI(b=1 000 s/mm2)示病灶相对于邻近组织(未受累的胰腺或正常胰腺实质)呈高信号,AIP患者、胰腺癌患者、正常人群胰腺ADC值分别为(0.001 30±0.000 35)mm2/s、(0.000 80±0.000 14)mm2/s、(0.001 60±0.000 24)mm2/s,3者比较,差异有统计学意义(F=30.409,P<0.05)。胰腺癌患者分别与AIP患者和正常人群比较,胰腺ADC值差异均有统计学意义(P<0.05),AIP患者与正常人群比较,差异无统计学意义(P>0.05)。(2)诊断情况:CT检查确诊11例,诊断准确率为11/17。MRI检查确诊8例,诊断准确率为8/11。1例患者CT及MRI检查均误诊为胰头癌,1例MRI检查误诊为胆总管下段癌。(3)治疗及随访情况:21例患者常规接受激素治疗,每日口服泼尼松龙40 mg,持续3~4周后逐步减量,每周5 mg,直至症状完全缓解。21例患者全部获得随访,随访时间为12~45个月。17例腹痛、腹胀患者中,7例症状消失,10例症状减轻偶尔发作;10例伴有黄疸的患者中,7例黄疸消失,2例减轻,1例消退。
胰腺CT和MRI影像学检查表现为"腊肠样""假肿瘤样"改变,非肿瘤性胆胰管狭窄,合并其他器官的IgG4相关疾病是诊断和鉴别诊断AIP的重要影像学依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一种由于自身免疫机制异常导致的特殊类型的慢性胰腺炎,1995年由日本学者首先正式提出该疾病[1]。AIP在世界范围内均有发病,以日本报道最多,多见于老年男性,其发病率约占慢性胰腺炎的6%[2]。在临床工作中,部分患者影像学表现疑似胰腺癌而易被误诊。部分急性发作患者仅满足于急性胰腺炎的诊断,造成病情反复发作。因此,AIP准确诊断的临床意义重大。本研究回顾性分析2012年2月至2015年2月内蒙古医科大学附属医院收治的21例AIP患者的临床资料,旨在总结AIP的CT及MRI影像学特征,探讨其诊断与鉴别诊断要点。
采用回顾性描述性研究方法。收集21例AIP患者的临床资料。其中男13例,女8例;患者年龄32~73岁,平均年龄58岁。21例患者均经临床症状、影像学表现、病理学检查及随访资料确诊为AIP。17例患者临床表现为不同程度腹上区疼痛、腹胀;10例患者伴有黄疸,肝功能异常;1例患者于饮酒及油腻饮食后反复发作,1例肾功能异常。2例患者合并糖尿病。实验室检查:11例患者血清IgG4水平升高(1例IgA、IgG均升高),2例AST/ALT升高,1例GGT水平升高,1例脂多糖升高,3例TBil和(或)DBil水平升高,7例CA19-9水平升高。部分患者可合并多种临床症状及异常实验室指标。本研究通过内蒙古医科大学附属医院伦理委员会审批,批号为2016文(004)。患者及家属均签署检查和治疗知情同意书。
纳入标准:(1)年龄≥16岁。(2)符合AIP亚洲诊断标准[3]。(3)临床资料完整。(4)随访时间>1年。
排除标准:(1)年龄<16岁。(2)合并有胰腺或腹部恶性肿瘤。(3)急性胆源性胰腺炎。(4)病历资料不完整。
设备与药品:GE64层Lightspeed VCT-XT CT机,对比剂为碘伏醇(320 mgI/mL,总量80 mL),采用高压注射器经肘前静脉团注,于注射开始后30、60、180 s行三期增强扫描。扫描范围从膈顶部至肝下缘水平,部分患者还包括盆腔。扫描参数:管电压120 kV,管电流170 mA,层厚、层间距5 mm,软组织窗标准算法重建,重建层厚、层间距1 mm。
MRI检查应用GE 3.0T Signa HDx超导型MRI扫描仪,8通道Torso相控阵表面线圈激发和采集信号。扫描序列包括:(1)轴位抑脂LAVA Flex T1加权成像:TR/TE=3.5/1.5 ms。(2)轴位抑脂T2加权成像:TR/TE=5 400/80 ms。(3)弥散加权成像(diffusion weighted imaging,DWI)序列,轴位SSEPI(单次激发平面回波弥散加权成像):TR/TE为5 000/55 ms,层厚为6 mm、层间距为2 mm,b值分别为500 s/mm2、1 000 s/mm2。(4)MRCP检查:TR 4 000 ms,TE 80 ms。(5)MRI动态增强扫描采用轴位抑脂LAVA Flex T1加权成像,采用MRI专用高压注射器推注对比剂Gd-DTPA 0.1 mmol/kg,流率2.5 mL/s,分别于注药开始后15、70、300 s进行动脉期、门静脉期及延迟期扫描。(6)同反相位BH AX 3D IN/OUT PHASE。
DWI图像传送至ADW4.4工作站,应用Function tool软件对病灶进行分析,在胰腺病灶最大层面放置感兴趣区(region of interest,ROI),进行表观弥散系数(apparent diffusion coefficient,ADC)值测量(面积>50 mm2)。选取同一时期行MRI检查并确诊的胰腺癌及正常胰腺受试者各11例,分别测量其ADC值进行比较。
影像学图像由2位主治以上影像学诊断医师独立阅片评价,意见不统一时2位医师协商后统一结果。评价内容包括:胰实质形态、大小、胰管狭窄、增厚信号特征、强化特征以及有无其他器官受累和淋巴结肿大。AIP的诊断采用亚洲诊断标准[3]。
(1)影像学检查情况:①胰腺表现:胰腺密度和信号,胰腺萎缩和钙化,胰腺增大,胰管改变。②胰腺外表现:胆道系统及肾脏改变。③DWI及ADC值:比较AIP、胰腺癌和正常胰腺ADC值。(2)诊断情况。(3)治疗及随访情况。
对于符合诊断标准的AIP患者,常规接受激素治疗,每日口服泼尼松龙40 mg,持续3~4周后逐步减量,每周5 mg,直至症状完全缓解。采用门诊及电话方式进行随访,半年内每3个月随访1次,之后每6个月随访1次。随访内容为患者的临床症状与体征。随访时间截至2016年2月。
应用SPSS 18.0统计软件进行分析。正态分布的计量资料以 ±s表示,多组间比较采用单因素方差分析。两两比较采用Dunnett′ T3法检验。P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析。两两比较采用Dunnett′ T3法检验。P<0.05为差异有统计学意义。
21例患者中,17例行CT检查,11例行MRI检查(其中7例联合行CT检查)。胰腺表现:(1)胰腺密度和信号:MRI检查示胰腺弥漫性增大14例,胰腺正常羽毛状结构及花边消失,边缘饱满,呈"腊肠样"改变(图1)。CT平扫呈均匀等密度影,增强扫描动脉期强化程度减低,门静脉期及延迟期逐渐均匀强化,边缘未见强化。MRI平扫病灶T1加权成像呈稍低信号,T2加权成像呈稍高信号,DWI呈高信号,增强扫描呈延迟强化,病灶边缘T1、T2加权成像均呈稍低信号,增强未见强化(图2,图3,图4,图5)。(2)胰腺萎缩和钙化:3例胰腺实质萎缩,内见散在钙化(图6)。(3)胰腺增大:4例胰腺局限性增大呈"假肿瘤样"改变,其中胰头部局限性增大2例(图7,图8)。(4)胰管改变:MRCP检查示4例表现为胰管弥漫性狭窄,3例表现为局限性狭窄,1例局限性扩张(图6)。
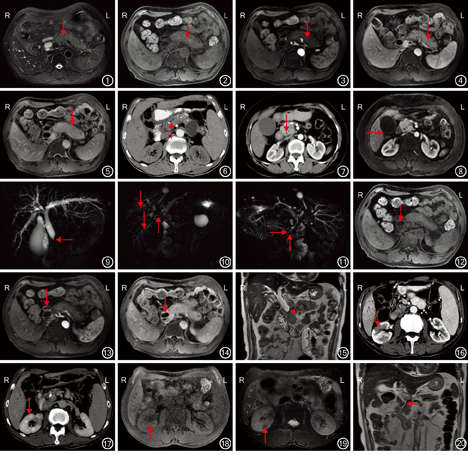

胰腺外表现:MRCP检查示11例患者表现为胆道系统改变,可见肝内胆管及胆总管扩张,部分狭窄,胆管壁广泛增厚(图9,图10,图11),MRI增强扫描检查示胆管壁呈明显强化(图12,图13,图14)。4例患者行MRCP检查可见胆总管末段呈"鸟嘴样"狭窄(图15)。3例患者表现为肾脏改变,CT增强扫描检查动脉期可见肾脏斑片状低密度影(图16),延迟期斑片状低密度影均匀强化(图17),MRI平扫T1抑脂序列图像示肾脏病灶呈等信号(图18),T2抑脂序列图像呈斑片状低信号(图19)。实质期及延迟期病灶逐渐均匀强化。
DWI及ADC值:AIP患者及胰腺癌患者DWI(b=1 000 s/mm2)示病灶相对于邻近组织(未受累的胰腺或正常胰腺实质)呈高信号,AIP患者、胰腺癌患者、正常人群胰腺ADC值分别为(0.001 30±0.000 35)mm2/s、(0.000 80±0.000 14)mm2/s、(0.001 60±0.000 24)mm2/s,3者比较,差异有统计学意义(F=30.409,P<0.05)。胰腺癌患者分别与AIP患者和正常人群比较,胰腺ADC值差异均有统计学意义(P<0.05),AIP患者与正常人群比较,差异无统计学意义(P>0.05)。
CT检查确诊11例,诊断准确率为11/17。MRI检查确诊8例,诊断准确率为8/11。1例患者CT及MRI检查均误诊为胰头癌(图7,图8),1例MRI检查误诊为胆总管下段癌(图20)。
21例患者常规接受激素治疗,每日口服泼尼松龙40 mg,持续3~4周后逐步减量,每周5 mg,直至症状完全缓解。21例患者全部获得随访,随访时间为12~45个月。17例腹痛、腹胀患者中,7例症状消失,10例症状减轻偶尔发作;10例伴有黄疸的患者中,7例黄疸消失,2例减轻,1例消退。
AIP是由于自身免疫机制异常所致的特殊类型的慢性胰腺炎。2008年日本和韩国共同提出了AIP的亚洲诊断标准[3],其主要诊断原则是:(1)影像学表现。(2)血清学检查。(3)组织学活组织检查。(4)对激素治疗的反应。另外,经手术病理学检查证实的胰腺标本表现为淋巴细胞、浆细胞浸润的硬化性胰腺炎时,也可诊断为AIP。AIP分为Ⅰ型与Ⅱ型[4]。Ⅰ型以血清IgG4水平升高为特征性表现,是系统性的IgG4相关性疾病在胰腺的局部表现,常合并其他器官受累[5]。其组织病理学特征为淋巴浆细胞广泛浸润、席纹状纤维化及闭塞性静脉炎。AIP Ⅰ型在亚洲国家约占96%,在欧美国家>80%[6]。Ⅱ型即原发性导管中心性胰腺炎,以欧美国家报道为主,无IgG4相关性,组织病理学可见粒细胞性上皮损害和导管破坏等特征[7,8,9]。本研究未发现通过病理学确诊的AIP Ⅱ型患者。
AIP从形态上分为弥漫型和局灶型[10]。弥漫型最常见,胰腺小叶轮廓消失,沿长轴方向不同程度弥漫性肿胀、增粗,呈典型的"腊肠状"改变,边界清楚;局灶型表现为局灶性肿块,以胰头部常见,表现类似胰腺癌,病灶边界多清晰。无论弥漫型还是局灶型,胰腺实质病变区在CT检查图片上表现为等或低密度改变,在T1加权成像上信号减低,T2加权成像上信号稍增高。病变区增强扫描显示在动、静脉期CT密度和MRI信号较正常胰腺降低,平衡期和延迟期呈轻中度逐渐强化,CT密度和MRI信号高于同层正常胰腺组织,延迟强化是AIP的一个特征性表现[11,12,13,14,15]。胰腺病变周围"包鞘样"改变,其病理学基础为胰腺周围组织淋巴细胞及浆细胞浸润和纤维化改变。CT扫描常呈低密度,MRI检查T1、T2加权成像均为低信号,增强后无强化或轻中度延迟强化。在显示"包鞘样"改变方面,MRI检查优于CT检查。普通的慢性胰腺炎及胰腺癌罕见类似"包鞘样"改变。本研究中1例患者CT及MRI检查均误诊为胰头癌,其原因为典型的梗阻性黄疸及其双管征误导了临床医师。胰头癌扩张的双管远端不连续为其鉴别要点。
AIP及胰腺癌患者DWI图像上,病灶相对于邻近正常组织均呈高信号。ADC值主要反映水分子扩散的幅度,DWI信号越高,而相应的ADC值越低[16]。但是两者病灶的形态及累及范围存在差异。AIP患者主要表现为弥漫性低信号,形态呈"腊肠"样;而胰腺癌患者主要表现为局限性(病灶区域)低信号。关于AIP患者的ADC值文献报道不尽相同,但均低于正常对照组[17,18,19]。本组研究结果显示:AIP患者的ADC值低于正常人群,但差异无统计学意义。这与文献报道不符,究其原因可能是本研究样本量较少,或是部分患者炎症反应促进水分子扩散,导致ADC值升高。本研究中AIP患者ADC值明显高于胰腺癌患者,这与文献报道一致[20,21,22,23]。胰腺癌患者以局部纤维基质沉积为特点,癌细胞同时刺激大量结缔组织增生,导致水分子扩散运动受限,ADC值下降。这提示ADC值有助于AIP与胰腺癌的鉴别诊断。熊美连等[24]对9例AIP及10例胰腺癌患者的对照研究中,将ADC阈值设为0.001 051 mm2/s时,相应的敏感度为88.9%,特异度为100.0%。限于不同的MRI设备及不同的b值设定,利用ADC阈值鉴别两者,仍需大样本量研究验证。
AIPⅠ型患者88%合并IgG4相关硬化性胆管炎,33%患者合并肾脏硬化性病变[25,26]。本研究结果证实:AIP患者合并胆管炎和肾脏的病变。AIP合并胆管炎与胆管细胞癌的鉴别要点包括:(1)疾病发生部位存在差异,胆管癌分为肝内胆管癌、肝门部胆管癌及肝外胆管癌,AIP肝内外胆管均可累及,管壁增厚常为弥漫性。(2)胆管癌所致胆管壁增厚常于相应区域发生管腔狭窄或其上方胆管显著扩张;AIP管壁增厚部位与管腔狭窄部位相对独立并不一致,且管腔未见闭塞。(3)胆管癌多表现为肝转移及周围淋巴结转移;AIP累及胆道系统,通常合并其他IgG4相关疾病。本研究中1例胆总管下端呈鸟嘴样狭窄患者MRI检查误诊为胆总管癌,其原因可能为MRI增强,其信号时间强化程度不显著所致。
AIP对激素治疗敏感,在激素治疗有效的情况下,不仅胰腺本身的病变获得显著改善,胆管梗阻解除、黄疸减轻,血清检查自身抗体和IgG4水平会明显下降;胰腺外受累及的脏器也会明显好转。大部分患者在症状好转后可逐步停用激素,但部分患者需要每日给予维持剂量的激素。对于复发患者的治疗,临床医师多采用重复皮质醇合并免疫抑制剂如硫唑嘌呤治疗。如果激素治疗无效,则应高度怀疑胰腺癌的可能。由于缺乏大样本病例研究和长期的随访资料,目前对AIP的自然病程了解还不够深入。Hirano等[27]将23例接受激素治疗与19例未接受激素治疗的AIP患者进行比较,激素治疗组6例患者停用激素后预后不佳(间质性肺炎、梗阻性黄疸);非激素治疗组16例预后不佳。但是否所有患者需要激素维持治疗,治疗时间目前尚无一致意见。本研究结果显示:患者运用激素治疗的疗效较为理想。
综上所述,AIP影像改变具有以下特点:胰腺弥漫性或局灶性肿大,呈延迟渐进性强化,DWI呈高信号;主胰管及胆管不规则狭窄;胰周"包鞘样"改变;合并胆管炎或胰腺外IgG4相关性病变;钙化、假囊肿、胰腺萎缩相对少见。CT检查对于胰腺形态及钙化的诊断具有一定优势,而MRCP检查对于胆胰管改变的诊断有着独特优势,不断开发的一些新序列诸如ADC值测量有望为AIP的诊断与鉴别诊断开辟新思路。



 ±s. Comparisons among groups were done using one-way ANOVA. Pairwise comparison was analyzed by Dunnett′ T3 test.
±s. Comparisons among groups were done using one-way ANOVA. Pairwise comparison was analyzed by Dunnett′ T3 test.























