
探讨经"肝脏四扇门"入路在腹腔镜解剖性肝切除术中的应用价值。
采用回顾性描述性研究方法。收集2018年9月至2019年9月四川大学华西医院收治的52例肝癌患者的临床病理资料;男36例,女16例;年龄为(53±16)岁,年龄范围为35~78岁。患者经"肝脏四扇门"入路行腹腔镜解剖性肝切除术。观察指标:(1)手术情况。(2)术后情况。(3)随访和生存情况。采用门诊或电话方式进行随访,了解患者体能状态、肝脏功能和肝癌复发情况。随访时间截至2020年3月。正态分布的计量资料以 ±s表示,偏态分布的计量资料以M(范围)表示。计数资料以绝对数或百分比表示。
±s表示,偏态分布的计量资料以M(范围)表示。计数资料以绝对数或百分比表示。
(1)手术情况:52例患者均顺利行腹腔镜解剖性肝切除术,无围术期死亡患者。经打开"肝脏第一扇门"行腹腔镜左半肝切除术和右半肝切除术各8例患者的手术时间分别为(151±31)min、(190±43)min,出血量分别为(151±20)mL、(361±51)mL;经打开"肝脏第二扇门"行腹腔镜肝左内叶切除术和肝左外叶切除术各8例患者的手术时间分别为(171±41)min、(90±26)min,出血量分别为(221±31)mL、(111±21)mL;经打开"肝脏第三扇门"行腹腔镜肝右后叶切除术和肝右前叶切除术各8例患者的手术时间分别为(172±29)min、(220±40)min,出血量分别为(351±41)mL、(451±47)mL;经打开"肝脏第四扇门"行腹腔镜肝尾状叶切除术4例患者的手术时间为(246±36)min,出血量为(261±31)mL。52例患者均未输血。(2)术后情况:52例患者术后恢复良好,无出血、胆瘘、感染、肝衰竭等并发症。患者术后住院时间为(7±4)d。(3)随访和生存情况:52例患者均获得随访。随访时间为6~17个月,中位随访时间为10个月。52例患者术后6个月体能状态均达到美国东部肿瘤协作组活动状态1级,肝功能Child-Pugh A级,未见肿瘤复发,总体生存率为100%(52/52)。
经"肝脏四扇门"入路行腹腔镜解剖性肝切除术安全、可行。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前肝切除术是治疗可切除性肝癌的首选方法[1,2]。解剖性肝切除术可在达到肝癌R0切除的基础上最大限度保留功能性剩余肝脏体积(future liver remnant,FLR),进一步降低肝癌切除术后并发症发生率和肿瘤复发率,是获得近、远期较好预后的一种手术治疗方式[3,4,5,6,7]。该手术方式可有效降低合并微血管侵犯肝癌患者的早期复发率[8,9]。解剖性肝切除术后并发症发生率、生存率、复发率等方面均优于非解剖性肝切除术[10,11,12,13,14]。肝脏是解剖结构复杂的实体器官,顺利开展解剖性肝切除术对术者的解剖理论和操作技能等要求较高,特别是通过腹腔镜微创技术完成该手术。本研究回顾性分析2018年9月至2019年9月我科收治的52例肝癌患者的临床病理资料,探讨经"肝脏四扇门"入路在腹腔镜解剖性肝切除术中的应用价值。
采用回顾性描述性研究方法。收集52例肝癌患者的临床病理资料;男36例,女16例;年龄为(53±16)岁,年龄范围为35~78岁。患者可经"肝脏第一扇门"入路行腹腔镜左半肝切除术和腹腔镜右半肝切除术,经"肝脏第二扇门"入路行腹腔镜肝左内叶切除术和腹腔镜肝左外叶切除术,经"肝脏第三扇门"入路行腹腔镜肝右后叶切除术和腹腔镜肝右前叶切除术,经"肝脏第四扇门"入路行腹腔镜肝尾状叶切除术。本研究通过我院医学伦理委员会审批,批号为2017(192)。患者及家属均签署知情同意书。
纳入标准:(1)诊断为原发性肝癌,肿瘤直径<10 cm(肝尾状叶肿瘤直径<5 cm)。(2)术前体能状态美国东部肿瘤协作组活动状态(ECOG PS)0~1级,肝功能Child-Pugh A~B级,肝脏储备功能ICG R15<10%,FLR可以耐受手术。(3)一般状况较好,心、肺、肾等重要器官功能可以耐受手术。(4)临床病理资料完整。
排除标准:(1)肝癌合并大血管或胆管癌栓,或侵犯周围及远处器官等。(2)门静脉高压症,处于肝硬化失代偿期。(3)功能性FLR不足,难以耐受手术。(4)一般状况差,心、肺、肾等重要器官功能障碍,不能耐受手术。(5)临床病理资料缺失。
患者全身麻醉、常规气管插管成功后,取仰卧、分腿位。主刀医师站于患者右侧,一助站于患者左侧,扶镜手站于患者两腿之间,采用"5孔法"进行手术:肚脐上缘打孔建立CO2气腹,压力为12~14 mmHg(1 mmHg=0.133 kPa),置入10 mm Trocar作为观察孔,右锁骨中线平脐上约2 cm和左锁骨中线肋缘下或正中线上置入12 mm Trocar作为主操作孔,右腋前线肋缘下、左锁骨中线平脐上2 cm分别置入5 mm Trocar作为辅助操作孔。Trocar具体布局位置应根据拟切除肝叶(或段)的需求进行适度调整。探查腹腔、盆腔及毗邻器官有无肿瘤侵犯、转移等。采用腹腔镜超声或联合荧光显像技术对肿瘤位置进行精确定位[15]。
通过解剖主门静脉裂区域打开"肝脏第一扇门"(图1),控制肝脏左、右叶Glisson蒂,为行腹腔镜解剖性左半肝或右半肝切除术奠定基础。打开"肝脏第一扇门",降低肝门板是关键。通常肝门板与胆管壁间没有重要血管,可采用超声刀或电钩等能量器械沿Glisson鞘和肝方叶的包膜之间进行游离,显露约2 cm的肝外胆管。解剖过程中术区创面渗血会影响手术视野,可采用能量器械或止血纤丝等控制出血,使手术视野更清楚;也可以预先采用Pringle法阻断第一肝门入肝血流,减少解剖过程中出血。由于肝门板与胆囊板相互延续,预先切除胆囊有利于解剖右侧肝门结构。肝中动脉或肝左内叶动脉跨过左肝管横部以及肝右动脉走行于肝总管前方时降低肝门板应避免损伤。
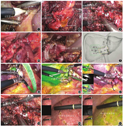

在肝脏Ⅱ、Ⅲ段与Ⅳ段之间有脐裂静脉,脐裂区域被认为是"肝脏第二扇门"(图2),肝左叶肝段区域支均从此处开始。经肝圆韧带入路可以打开"肝脏第二扇门",其解剖区域主要显露于肝外。"肝脏第二扇门"可分为前门与后门:打开前门显现肝脏Ⅳ段入口,进而控制肝脏Ⅳa、Ⅳb段的Glisson蒂,缺血线显现后行腹腔镜肝左内叶(或段)切除术;打开后门显现肝脏Ⅱ、Ⅲ段入口,控制肝脏Ⅱ、Ⅲ段的Glisson蒂,缺血线显现后行腹腔镜肝左外叶(或段)切除术。经肝圆韧带入路腹腔镜肝切除术还可应用于左半肝切除、左三肝切除,也可应用于右三肝切除、中肝切除等[13]。对于有肝门部手术史的患者,直接打开"肝脏第一扇门"通常较困难,如经肝圆韧带入路预先打开"肝脏第二扇门"则更有优势。处理好肝圆韧带后便于降低肝门板,有助于处理右侧的Glisson蒂,避免切肝时对第一肝门重要管道的副损伤。
在右门静脉裂与主门静脉裂之间的纵门静脉裂,该脉裂区域的前裂将肝右前叶分为前背段和前腹段,相当于肝左叶的脐裂。该脉裂位于胆囊板右侧,斜行于后段左侧的卢比沟。打开前裂区域,可以到达肝脏右侧Glisson蒂的各级分支,即打开"肝脏第三扇门"(图3)。
"肝脏第三扇门"的解剖区域主要位于肝实质内,需切开部分肝实质后才能良好显露。该门亦可分为前门和后门:打开前门显现肝脏Ⅴ、Ⅷ段入口后控制肝脏Ⅴ、Ⅷ段的Glisson蒂,缺血线显现后行肝右前叶(或段)切除术(根据前裂静脉走行还可分为前腹侧段和前背侧段的肝亚段切除术);打开后门显现肝脏Ⅵ、Ⅶ段入口后控制肝脏Ⅵ、Ⅶ段的Glisson蒂,缺血线显现后行肝右后叶(或段)切除术。"肝脏第三扇门"分支较多,且位于肝实质内,显露较困难,手术过程中应掌握解剖层次和方向。如采用超声刀分离解剖肝实质,应采取"小口蚕食,逐层推进"的方法,在凝闭、切割肝组织的同时,配合使用刀头进行破碎、钳夹、分离、推拨,超声刀刀头的金属工作面应始终处于可见区域,尽量避免盲目插入肝实质内造成血管或胆管副损伤。对于"肝脏第三扇门"的Glisson蒂分支,要充分解剖游离,确认其管径大小、走行及其与肿瘤的位置关系,再予以结扎、离断。当"肝脏第三扇门"部分位于肝实质外(右肝蒂2~3 cm外露走行)时,则相对容易解剖显露。
肝脏的"门短静脉"由门静脉主干、汇合部及其左右分支发出(图4A),直接进入肝实质的多个肝段,主要汇入肝尾状叶[16]。门短静脉在入肝区域分布上,个体差异较大,汇入肝脏Ⅱ段、Ⅳ段、Ⅴ段及Ⅶ段较多见,但是汇入肝脏Ⅰ段(肝尾状叶)最常见(100%) [17]。发至肝尾状叶的"门短静脉"区域称为"肝脏第四扇门",即到肝尾状叶的入口(图4B)。肝尾状叶大致呈圆锥形,处在肝脏深面,直径<5 cm的肝尾状叶肿瘤可优先考虑行腹腔镜切除术,采用左侧入路、右侧入路或左右侧结合入路打开"肝脏第四扇门",显露至肝尾状叶入口,控制肝尾状叶的Glisson蒂,采用"挖隧道"方式行腹腔镜解剖性肝尾状叶切除术安全、可行[18,19]。"肝脏第四扇门"解剖空间狭小、结构复杂,术中容易损伤管壁菲薄的细小门静脉分支,极易导致难以控制的出血,进而影响手术视野。故打开"肝脏第四扇门"时,应尽量避免损伤门短静脉。
"肝脏四扇门"的区域分布示意图见图5。
经"肝脏四扇门"入路行腹腔镜解剖性肝叶(或段)切除术时,肝表面断肝线清晰,肝实质离断一般采用由浅入深、由下往上的足侧入路,肝内重要管道结构能够得到良好显示,但在断肝过程中,肝实质内部的叶(或段)边界不清晰,可能导致断肝面误差。随着吲哚菁绿荧光染色示踪技术逐渐被应用于临床,对肝切除术起到了导航作用[20,21,22,23,24,25,26,27,28]。通过术中"肝脏四扇门"入路解剖目标肝蒂,采用丝线结扎不完全阻断拟切除肝叶(或段)的肝蒂后进行门静脉注射吲哚菁绿(正染法、图6),或丝线结扎完全阻断拟切除肝叶(或段)的肝蒂后进行外周静脉注射吲哚菁绿(反染法、图7),提升肝叶(或段)的表面断肝线和肝实质内部的断肝面可视化,进一步提高腹腔镜解剖性肝切除术的精准性[29,30,31,32]。
观察指标:(1)手术情况包括手术方式、手术时间、出血量、输血情况。(2)术后情况:并发症、住院时间。(3)随访和生存情况:获得随访患者例数、随访时间、生存状况。
采用门诊或电话方式进行随访,了解患者体能状态、肝脏功能和肝癌复发情况。随访时间截至2020年3月。
应用SPSS 22.0统计软件进行分析。正态分布的计量资料以 ±s表示,偏态分布的计量资料以M(范围)表示。计数资料以绝对数或百分比表示。
±s表示,偏态分布的计量资料以M(范围)表示。计数资料以绝对数或百分比表示。
52例患者均顺利行腹腔镜解剖性肝切除术,无围术期死亡患者。经打开"肝脏第一扇门"行腹腔镜左半肝切除术和右半肝切除术各8例患者的手术时间分别为(151±31)min、(190±43)min,出血量分别为(151±20)mL、(361±51)mL;经打开"肝脏第二扇门"行腹腔镜肝左内叶切除术和肝左外叶切除术各8例患者的手术时间分别为(171±41)min、(90±26)min,出血量分别为(221±31)mL、(111±21)mL;经打开"肝脏第三扇门"行腹腔镜肝右后叶切除术和肝右前叶切除术各8例患者的手术时间分别为(172±29)min、(220±40)min,出血量分别为(351±41)mL、(451±47)mL;经打开"肝脏第四扇门"行腹腔镜肝尾状叶切除术4例患者的手术时间为(246±36)min,出血量为(261±31)mL。52例患者均未输血。
52例患者术后恢复良好,无出血、胆瘘、感染、肝衰竭等并发症。患者术后住院时间为(7±4)d。
52例患者均获得随访。随访时间为6~17个月,中位随访时间为10个月。52例患者术后6个月体能状态均达到ECOG PS 1级,肝功能Child-Pugh A级,未见肿瘤复发,总体生存率为100%(52/52)。
医学解剖学中的"门",是指血管或神经等脉管进入或离开器官的区域。肝脏属于双血供器官,入肝血流主要由门静脉和肝动脉组成。"肝脏四扇门"是指沿门静脉系统(Glisson系统)进入肝脏各叶(或段)的四扇主要入口区域。以临床解剖学角度,由前向后、由尾侧向头侧看"肝脏四扇门",门静脉系统(Glisson系统)均呈扇形发散状分布。通过解剖主门静脉裂区域打开"肝脏第一扇门",分辨左、右门静脉(Glisson蒂)分支,到达肝左、右叶入口;通过肝圆韧带入路解剖脐裂区域打开"肝脏第二扇门",到达肝左叶Ⅱ、Ⅲ、Ⅳ段入口;通过解剖前裂区域,打开"肝脏第三扇门",到达肝右叶Ⅴ、Ⅵ、Ⅶ、Ⅷ段入口;门静脉主干、汇合部及其左右分支有发至肝尾状叶(肝脏Ⅰ段)的门短静脉,解剖该区域打开"肝脏第四扇门",到达肝尾状叶入口。
笔者团队提出"肝脏四扇门"入路的理论,结合临床实践,发现其更有助于腹腔镜精准解剖性肝叶(或段)切除术的开展。解剖性肝切除术技术优先处理预切除肝脏的入肝血流,有利于术中控制出血,根据缺血线寻找正常解剖层面,减少出血量[33,34]。肝脏肿瘤易通过门静脉转移形成卫星灶,而这些卫星灶多与肿瘤位于同一肝叶(或段),完整切除肿瘤所在肝叶(或段),可同时切除邻近可能存在的卫星灶,进而提高患者术后无瘤生存率。通过此手术策略不仅可以最大限度地保留功能性FLR,还可以降低术后并发症发生率,符合肿瘤根治原则,降低肿瘤复发率,延长首次复发时间,改善远期预后[35,36]。
综上,经"肝脏四扇门"入路行腹腔镜解剖性肝切除术安全、可行,能够更加清晰地显露肝内重要管道结构(包括血管和胆管),提高手术解剖精准性。
所有作者均声明不存在利益冲突



























