
腹腔镜解剖性肝切除术已被临床证实安全、有效,逐渐成为腹腔镜肝切除术的主流手术方式。笔者通过对Laennec capsule重新认识,发现其与肝蒂及肝静脉间存在天然解剖间隙,提示Laennec capsule可作为腹腔镜解剖性肝切除术的解剖入路。肝脏的左叶、右前叶、右后叶各有1个独立的肝蒂,在不破坏肝实质的前提下可经Laennec capsule入路在肝外行Glisson蒂横断式肝叶切除术。离断平面上肝静脉的显露同样可以经此入路实现,此操作安全、可靠、方便,具有高度可重复性。Laennec capsule入路为腹腔镜解剖性肝叶切除术提供了新思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自1991年首次报道应用腹腔镜行肝切除术以来,腹腔镜肝切除技术得到快速发展。近些年,随着对肝脏解剖认识的深入、腹腔镜设备器械的改良以及外科技术的进步,腹腔镜解剖性肝切除术逐渐成为肝脏外科的主流手术方式。目前,半肝、肝叶、肝段甚至亚肝段等解剖范围的切除均可以通过腹腔镜的方式实现[1, 2, 3, 4]。在手术入路的选择上,腹腔镜解剖性肝切除术可分为“肝实质优先法”和“肝蒂优先法”[5, 6, 7]。前者利用Pringle手法行全入肝血流阻断,沿预切除平面进行较大范围肝实质离断后,充分暴露目标肝蒂并予以离断。后者又可分为鞘内解剖法和鞘外解剖法,其中鞘外解剖法主要以Takasaki教授提出的Glisson蒂横断式肝切除为理论依据,因其简便、易行,目前已被广泛用于腹腔镜解剖性肝切除术中[8, 9, 10, 11, 12]。
近些年,腹腔镜外科模式下的高清放大手术视野使外科医师对肝脏的精细解剖有了进一步理解。特别是对Laennec capsule结构的重新认识,为外科医师在不破坏肝实质的前提下,进入肝实质和肝蒂之间的潜在解剖间隙提供解剖学理论基础,使肝外解剖处理肝蒂更安全、更便利[13, 14, 15]。笔者团队在充分利用Laennec capsule解剖结构的基础上鞘外解剖显露并处理通往各肝叶的肝蒂,按照阻断入肝血流后形成实际缺血线准确标记进行肝叶切除,取得良好手术效果,证实这种方法在腹腔镜手术中具有简便快捷、准确有效的优点,且可重复性强。笔者结合团队经验及国内外相关文献报道,探讨Laennec capsule入路在腹腔镜解剖性肝叶切除术中的应用体会。
Glisson鞘解剖结构最早于1640年由Johannis Walaeus发现,1654年由Francis Glisson描述,从而被外科医师所认知。Glisson鞘在肝门部包绕肝动脉、门静脉、胆管,形成Glisson蒂(也称肝蒂),即门管三联结构,并将这种结构向肝脏实质内部延续形成了肝内的Glisson树状结构。肝门板的概念首先于1957年由Couinaud提出,肝门板是指肝门处胆管和血管周围的Glisson鞘结缔组织相互融合增厚形成的解剖结构[16]。肝门板上面无重要的胆管或血管分支穿过,仅少数病例在肝门板和肝脏之间出现细小血管和胆管,这是其作为手术入路的解剖学基础。肝门板是手术时从肝外进入肝内的重要解剖结构,在肝切除手术,尤其是解剖性肝切除术的入肝血流阻断或处理过程中,常以此为标志或界线下降或分离肝门板,可以相对安全地显露肝门部的管道结构,避免发生组织损伤、出血和胆汁漏。随着解剖学研究的深入,现在公认肝门板只是肝板系统的一部分,此外肝板系统还包括右侧胆囊板、左侧Glisson蒂上方的脐板及与之连续的Arantius板[17]。肝板系统在肝内与Glisson鞘相连续,在肝外与肝被膜和肝十二指肠韧带系膜相连。
既往的肝脏解剖学提示肝脏表面、胆囊、肝门部Glisson鞘覆盖脏层腹膜,但在肝脏裸区、右肾上腺、肝后腔静脉周边没有脏层腹膜覆盖。1802 年,法国医师Laennec首次描述Laennec capsule这一解剖结构,认为其不同于脏层腹膜,并提出Laennec capsule与Glisson鞘并不连续,是两个相互独立的系统[18]。但是这一发现当时并未得到肝脏外科医师的广泛重视。此后,Couinaud证明Laennec capsule与Glisson鞘不连续[19]。2008年Hayashi等[20]通过对尸体肝脏进行组织学研究发现Laennec capsule不仅覆盖整个肝脏表面,而且在肝内与Glisson 鞘和肝静脉并行并延伸至末梢,这为其后续应用及研究提供了有力依据。Sugioka等[13]于2017年明确提出Laennec capsule为Glisson蒂分离的具体层次。Hu等[14]发现并总结肝脏不同部位的Laennec capsule与相邻组织之间的自然间隙为20~50 μm,这为肝脏游离、Glisson蒂分离、肝静脉分离以及肝后分离提供了解剖学理论依据。
基于上述理论,越来越多的肝脏外科医师认识到Laennec capsule的存在可以作为解剖性肝切除术的标记和入路,即术者在不解剖破坏肝实质的情况下,可以将出入肝管道和Laennec capsule分离。这不仅适用于肝门分叉部左右支的肝蒂,也适用于肝叶或肝段的肝蒂。此外,循肝静脉离断肝实质的过程中,也可以利用其将肝实质与静脉进行有效分离。
Healey和Schroy建立了现代肝脏解剖分段的基本概念,将肝脏分为左外侧、内侧、前和后4个区,1954年Couinaud在此基础上提出Couinaud分段,按Glisson肝蒂一级分支将肝脏分为左、右半肝;二级分支将右半肝分为右前区和右后区,左半肝分为内侧区和外侧区;三级分支到各个肝段。
1986年,Takasaki[8]报道Glisson蒂横断式肝切除术,该技术是基于肝门板分离和主要(左、右)肝蒂的鞘外解剖。1998年Takasaki系统阐述该技术的理论和解剖基础,他认为肝脏Glisson系统的3个二级分支经由独立的开口进入肝脏,因此,肝脏被分为3部分:左段(相当于Couinaud Ⅱ、Ⅲ、Ⅳ),中段(相当于Couinaud Ⅴ、Ⅷ)及右段(相当于Couinaud Ⅵ、Ⅶ)。这3个肝段的体积几乎相同,各约占肝脏总体积的30%,剩余的10%为肝尾状叶,直接受一级分支支配。肝中静脉及肝右静脉主干则是相邻两个肝段之间的解剖界限,肝左静脉则可以看作是肝中静脉的一个粗大分支。同时他还提出了“锥形单元”概念,即3个肝段依据Glisson系统三级分支的分布而被区分为更小的区域,每个Takasaki肝段由6~8个锥形单元组成,可分别通过各自的肝蒂分支进行确认,从而实现解剖性亚肝段切除术[8,21]。
各种不同的分段方法都是以门静脉解剖为基础,在门静脉二级分支(叶)层面来讲本质其实是一致的,只是在三级分支(段)甚至四级分支(亚段)层面有所差异。通常,左侧独立肝蒂的存在是恒定的,常规暴露于第一肝门处。右前和右后肝蒂在第一肝门处单独发出,或在此处形成共干后分别发出,但即使有共干也较短。因此,从第一肝门处分别控制肝左叶、右前叶及右后叶的入肝血流是有解剖学理论基础的。
基于上述理论基础,笔者团队认识到肝左叶、右前叶、右后叶肝蒂的鞘外解剖,均可以沿Laennec capsule进行解剖,因此,既往关于下降肝门板操作,可以在不破坏肝实质的情况下实现。见图1,2。阻断相应肝叶区域的入肝血流后,根据实际缺血线可行解剖性肝叶切除术。
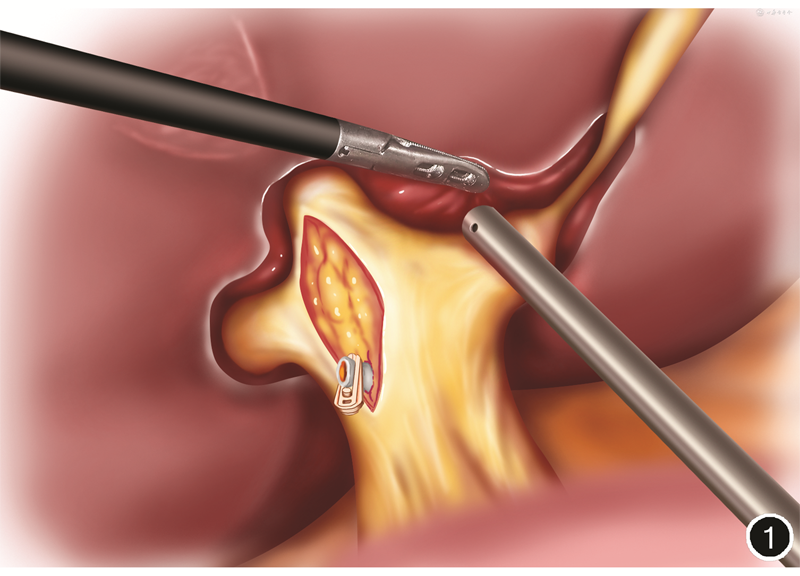

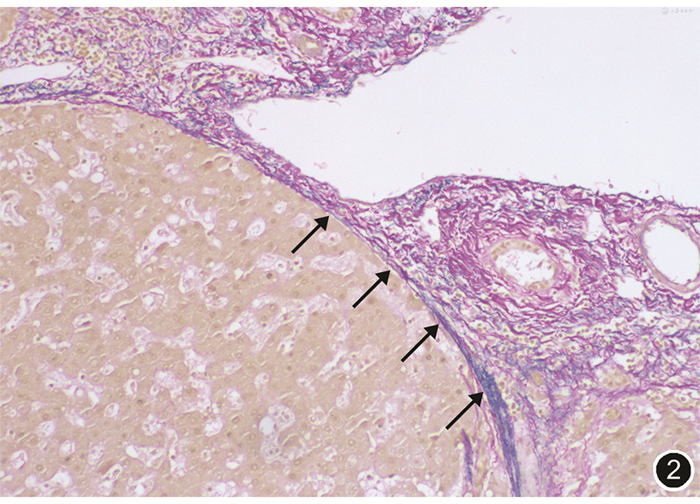

腹腔镜肝切除术特有的足侧视角、放大精细解剖的手术视野及“足侧到头侧”的手术方式,加深了手术医师对肝脏外科解剖的认识和理解,促进了手术理念的改变。这也正是Laennec capsule这一解剖结构虽然被发现200余年而直至近来才被外科医师关注和利用的重要原因之一。传统的开腹手术由于腹侧视角的原因,优先处理肝蒂常会遇到较多困难,而腹腔镜下优先处理肝蒂则更从容。利用腹腔镜的优势,配合术中仔细操作,可以实现经Laennec capsule入路的Glisson蒂横断式肝叶切除术。
笔者团队采用此入路顺利完成多例腹腔镜解剖性肝叶切除术,涵盖肝左叶、右前叶及右后叶的全部肝叶,其中包括原发性肝癌、肝内胆管结石、转移性肝癌等多种疾病,均在不破坏肝实质前提下经此入路实现各叶肝蒂的解剖分离及处理(图3, 4, 5)。随后按照Takasaki教授的理念进行Glisson蒂横断式肝切除术,初步证明该入路有非常高的可行性及可重复性。
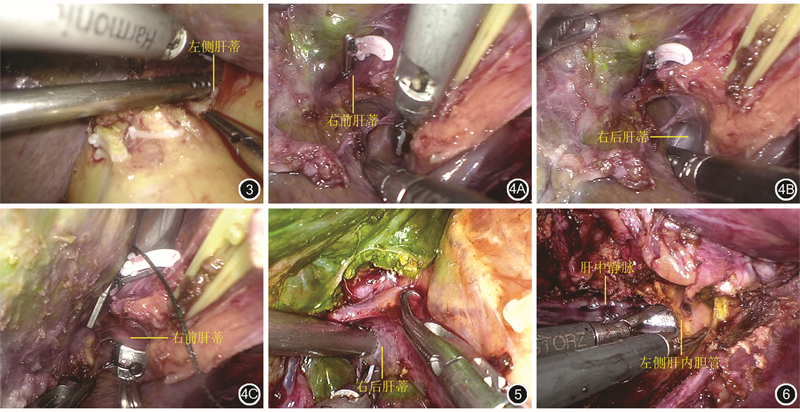

结合临床经验,笔者团队总结以下应用体会:(1)分离辨认Laennec capsule结构时应在阻断第一肝门的前提下进行,减少分离过程中创面周围渗血,干净清爽的手术创面是保证分离层次正确的重要条件。(2)无论分离解剖任何一支肝蒂,最开始的解剖位置均推荐在肝方叶与下方肝门板的移行部位进行,即传统下降肝门板操作的位置。从此位置开始的解剖有多种优点:首先是该位置相对恒定易于辨认;其次是经该位置向左可清楚辨识左肝蒂,向右可清楚辨识右前肝蒂,不易因肝门部解剖变异而误判;最后是右前与右后肝蒂的汇合方式多样,在确认保护右前肝蒂的前提下分离解剖右后肝蒂有时候是必要的。(3)沿此入路分离下降肝门板的过程中,常有部分细小分支进入肝脏方叶及尾状叶腔静脉旁部,建议靠近肝蒂一侧用血管夹夹闭或者细线结扎,防止直接超声刀离断后发生出血及胆汁漏。(4)解剖右前及右后肝蒂均需要在胆囊板与肝门板移行部位离断胆囊板,从而实现辨认右前肝蒂,以利于精确解剖游离或者保护。(5)左侧肝蒂的解剖与游离可通过腹腔镜下60°弯钳或“金手指”实现,右前及右后肝蒂由于位置角度的原因,更加推荐金手指或者直角弯钳进行解剖与游离。(6)约有50%的病人路氏沟解剖表现为隐匿型,外观上难以直接发现,对于这部分病人,推荐先通过前述方法辨认右前肝蒂后向背侧游离寻找右后肝蒂,这样能提高该入路的成功率。(7)右后肝蒂的根部经常有通往右后叶下段的分支发出,解剖与游离右后肝蒂时可先行将其离断,但需仔细进行夹闭或者结扎,该位置是术后胆汁漏的好发部位。(8)右后肝蒂背侧缘的分离位置为尾状突肝蒂(G1c)的右侧。(9)各肝蒂的离断过程需特别关注保留侧的长度,避免因过于靠近拟保留侧而造成胆道狭窄并发症。(10)控制进入肝叶血流后,明确缺血线位置作为断肝平面,此时选择性阻断相邻肝叶的肝蒂亦可以控制肝实质离断过程中出血。典型的应用即是右前叶的切除,这种选择性交替阻断肝蒂的方法尤其适用于严重肝硬化、术前肝功能及肝功能储备不佳者。在行肝左叶和肝右后叶切除术时,此方法同样适用。(11)在进行静脉分离和保护时,可以充分利用Laennec capsule解剖层次进行钝性分离。这在肝内胆管结石行肝叶切除术时尤其适用,此类病人肝脏常伴有萎缩肥大综合征,且反复炎症刺激致肝内Glisson系统与肝静脉之间的距离可能非常接近且关系致密,当以能量器械解剖分离时常不易操作且有较大风险损伤拟保留的肝静脉。此时选择马里兰分离钳顺着静脉走行方向钝性分离通常能够有效帮助寻找并进入Laennec capsule与肝静脉壁之间的间隙(图6),进而进行安全的锐性离断。(12)当有效控制目标肝蒂入肝血流后应用吲哚菁绿外周静脉注射可实现拟保留肝脏的荧光反染,不仅在肝脏表面而且在离断肝实质深入时仍能够有荧光边界作为指引,有助于保持正确的切除界面,实现更加精准的解剖性肝切除。
腹腔镜解剖性肝切除术操作复杂,对手术医师要求高,但可以减少术中出血量,并最大限度保留功能性肝脏体积,术后降低病人并发症的发生率,恢复快,远期临床疗效更明显,尤其针对肝脏肿瘤病人,对延长病人术后生存时间及无瘤生存时间有积极作用[22, 23, 24]。有报道指出Glisson蒂横断式解剖性肝切除术与传统的血流阻断技术比较,可有效避免保留侧肝组织的缺血-再灌注损伤,且早期处理肝蒂可有效降低肿瘤肝内转移的风险[25]。
Sugioka等[13]基于Laennec capsule的解剖层次,指出几乎所有的肝蒂(包括肝尾状叶)均可通过Glisson蒂横断技术分离出来实现解剖性肝切除。笔者团队认为:经Laennec capsule入路应与传统的下降肝门板操作有细节方面的不同,前者更加注重沿两种不同解剖层次之间的自然间隙进行无创分离,不必造成肝实质的损伤,而后者并不强调这一细节,可以在破坏部分肝脏实质的情况下进行。这也正是经Laennec capsule入路的优势,术者可以准确可靠地实现对目标肝蒂的解剖分离控制,且可重复性强。Takasaki的肝脏分段理论尤其适用于解剖性肝叶切除术,控制肝叶的入肝血流后形成的缺血线平面间走行着肝中及肝右静脉的主干,这一点相对恒定。虽然在肝静脉末梢分支有无Laennec capsule尚存在争议,但肝静脉根部或主干周围覆盖着Laennec capsule得到学者们的公认[26, 27, 28]。
结合上述两种解剖理念,经Laennec capsule入路行腹腔镜下Glisson蒂横断式肝叶切除术简便易行,是一种安全、有效的手术方法,且可降低对术前三维重建及术中实时影像学的依赖。此外需要注意的是手术入路的选择尚可以考虑将传统的足侧入路和前入路转为背侧、头侧或者联合入路[29]。
所有作者均声明不存在利益冲突



























