
肝脏是结直肠癌最主要的转移靶器官,近50%结直肠癌病人在病程中发现伴有肝转移,约25%病人发生同时性肝转移,25%病人为异时性肝转移,肝转移是导致病人死亡的主要原因,结直肠癌肝转移的预防与治疗是攻克结直肠癌的关键,积极手术治疗可以给病人带来生存获益。笔者总结并分析昆明医科大学第一附属医院器官移植科收治的1例结肠癌肝转移病人多学科团队治疗过程,探讨该病肝切除术的治疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
病人男,47岁。因结肠癌肝转移(colorectal liver metas-tasis,CRLM)6个月入院。2020年8月病人因大便带血行结肠镜检查发现乙状结肠肿瘤,组织病理学检查为腺癌,入住我院胃肠外科治疗,2021年3月转入我科。既往体健。
体格检查:血压为130/84 mmHg(1 mmHg=0.133 kPa),发育正常,营养好,双肺呼吸音清,无啰音,心率84次/min,律齐,未闻及杂音,双下肢无水肿。直肠指检未扪及包块。
肝胆胰脾MRI检查结果显示:同时性肝转移,全肝多发,最大肿瘤长径为3.9 cm×2.9 cm。CT检查结果显示:乙状结肠癌合并肠管周围多发淋巴结转移,肝脏多发转移灶。肠镜检查结果显示:乙状结肠肿瘤突向腔内,表面充血水肿、溃疡,接触性出血。肠镜取材活组织病理学检查结果显示:中分化腺癌。CEA:294 μg/L。
针对病人的新辅助化疗方案以及肝转移灶行手术是否可达到R0切除开展第一次多学科团队讨论。
胃肠外科医师:病人目前考虑乙状结肠癌合并肝转移[cT3N3M1期(H)],应行新辅助化疗;肝转移灶是否能够达到R0切除需要进一步讨论。
影像科医师:病人肝胆胰脾CT及MRI检查结果均示肝脏多发占位性病变(7处),最大肿瘤长径为3.9 cm×2.9 cm,考虑均为转移灶。
肿瘤内科医师:新辅助化疗选择FOLFOX(奥沙利铂+亚叶酸钙+氟尿嘧啶)+贝伐珠单克隆抗体的化疗方案。
放疗科医师:病人除肝脏无其他器官转移,可考虑新辅助化疗后再评估。
器官移植科住院医师:病人CT、MRI检查结果均提示肝多发转移灶,具有手术指征,但手术时机尚不明确。
器官移植科副主任医师:病人临床危险评分体系(clinical risk scores,CRS)为4分,因肝转移灶数目多,均为可切除病灶,目前手术难度较大,可考虑先新辅助化疗再行手术切除结直肠原发灶及肝转移灶。
器官移植科主任医师:病人全肝多发转移灶,可先行新辅助化疗转化治疗,缩小瘤体及增加剩余肝脏体积后再次评估病人病情选择同期或分期手术切除病灶。
第一次多学科团队讨论确定先行新辅助化疗后再评估病情制订治疗方案。
针对病人新辅助化疗后肝转移灶切除术能否达到R0切除,手术方案选择同期还是分期手术。
胃肠外科医师:予FOLFOX+贝伐珠单克隆抗体的方案新辅助治疗6个月后结直肠原发灶及肝转移灶均明显缩小,可行手术治疗;结直肠原发灶及肝转移灶手术时机需要进一步明确。
影像科医师:CT及MRI检查结果均示肝转移灶较前明显缩小,最大肿瘤长径为2.4 cm×1.8 cm,肝S4段、S7段有2个病灶邻近Glisson鞘。
肿瘤内科医师:病人经新辅助化疗后结直肠原发灶及肝转移灶明显缩小,治疗有效,可继续目前FOLFOX+贝伐珠单克隆抗体的化疗方案。
器官移植科住院医师:病人经新辅助化疗后结直肠原发灶及肝转移灶体积均缩小,可在原发灶手术切除后再行肝转移灶切除术。
器官移植科副主任医师:病人肝转移灶多而分散,无法一次性手术达到R0切除,而病人原发灶经过新辅助治疗明显缩小,短期无梗阻风险,可先行肝转移灶切除术。
器官移植科主任医师:病人肝转移灶多,同期手术时间较长、创伤大,增加手术并发症风险。为了提高病人疗效,可以选择分期手术。先行肝转移灶切除术,术后恢复顺利再行Ⅱ期结直肠原发灶根治性切除术。
多学科团队第二次讨论达成“liver first”策略。
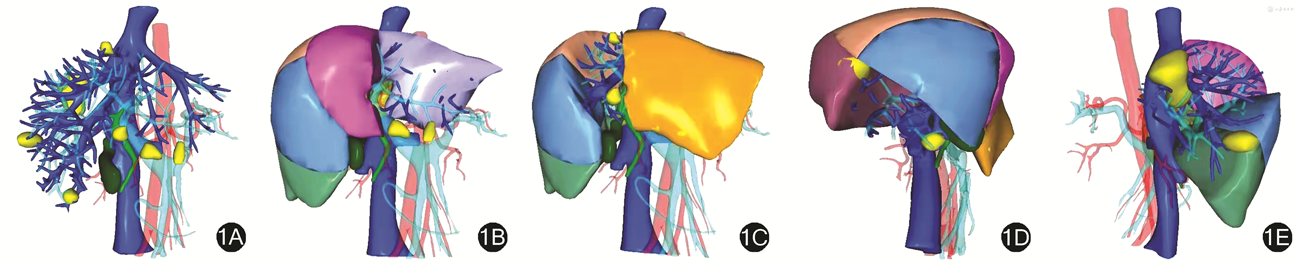
2021年3月病人由器官移植科医师行肝转移灶切除术。术前三维重建结果明确7个肝转移灶位于肝S3、S4、S6、S7段(图1)。术中超声检查扫描全肝探查印证病灶位置,肝S4、S7段2个病灶邻近Glisson鞘,行肝S4、S7段切除术,肝S3、S6肿瘤行局部切除术。切除标本病理学检查结果显示:肝内转移性腺癌伴坏死及钙化。术后复查肝脏原病灶位置未见显示。术后病人返回胃肠外科予FOLFOX+贝伐珠单克隆抗体方案化疗5个疗程,并于2021年6月行结直肠原发灶切除术,术后组织病理学检查结果显示:中分化腺癌,侵及肠壁全层(未突破外膜),清扫18枚肠周淋巴结,1枚阳性,神经侵犯、脉管侵犯阴性基底环切缘未见肿瘤组织。术后予FOLFOX+贝伐珠单克隆抗体方案化疗2个疗程,术后随访至2021年8月未见肿瘤复发转移。

结直肠癌是消化系统常见肿瘤,其新发病例数和肿瘤相关死亡人数在全世界所有肿瘤中均位居第3位[1, 2, 3]。肝脏是结直肠癌血行转移最主要的转移靶器官,50%的病人在病程中发现CRLM,约25%病人发生同时性肝转移,25%病人为异时性肝转移,近1/3的病人是以肝脏为单一转移器官[4, 5, 6, 7, 8, 9, 10]。手术切除CRLM病人和不可切除CRLM病人的5年总体生存率分别为42%和9%,10年总体生存率分别为25%和4%[11]。CRLM病人是否伴有肺转移,总体生存率没有显著区别[12, 13, 14]。CRLM的防治是攻克结直肠癌关键,积极手术治疗可以给病人带来生存获益甚至治愈希望。结肠癌“广泛转移”定义为:转移部位>2个,总体转移数目>5个,两个条件满足其一就符合[15]。广泛转移治疗目标是疾病控制,以全身系统治疗为主。无论肿瘤数目,只要能全部完整切除,剩余足够肝脏体积,即认为“可切除”。肿瘤数目与手术适应证无关,纵使病灶数目≥4个,切除效果与2~3个病灶相比无明显差别[16]。
对于CRLM的手术切除策略包括同期和分期切除,传统上分期手术比例更高,同期切除手术比例也在逐渐增加[17, 18, 19, 20, 21]。但同期切除手术因存在两处创伤,增加并发症风险,其并发症发生率和病死率较分期手术高,并非所有病人都适合同期切除手术[18]。同期切除手术需要多科室协调、围手术期肝功能维护、营养支持。分期切除多数情况是首先切除原发灶再切除肝转移灶。少数是先切除肝脏转移灶“liver first”的策略。
CRLM的生物学行为要比原发性肝癌恶性程度低,目前公认R0为1 mm手术切缘即可[22]。在部分CRLM病人中<1 mm手术切缘(R1)也可接受:化疗有效+RAS野生型,此类病人为R1切除接受[23]。<1 mm手术切缘阳性更常见于RAS突变病人,所以RAS突变型病人需要更大的边缘宽度甚至解剖性肝切除。Iwaki等[22]的研究结果显示:肝肿瘤对门静脉的侵袭较肝静脉更常见,这是肝转移术后局部复发的主要危险因素;此外,手术切除后使用电凝凝固肝创面止血,可以达到深度5 mm的肝实质损毁,灭活可能残留的微小病灶。对于贴近Glisson系统管道的肝转移灶,在剩余肝脏体积足够的前提下联合血管切除;对于邻近肝静脉的肝转移灶,如果剩余肝脏体积不足,保留肝静脉将病灶R1切除而不增加复发风险。
综上,CRLM是肝胆外科常见恶性肿瘤,系统性治疗涉及肝胆外科、胃肠外科、肿瘤内科、放疗科、影像科等多学科。多学科团队合作制订个体化治疗方案,可以减少不完善决策,提高病人生命质量。
所有作者均声明不存在利益冲突



























