
解剖性肝切除旨在对荷瘤门静脉流域进行系统性切除,以提高肝细胞癌手术疗效,但由于传统理论和临床实践存在偏差,其肿瘤学疗效尚存争议。门静脉流域解剖性肝切除(PT-AR)基于真实门静脉流域分析进行手术规划,以荧光染色引导荷瘤门静脉流域切除同时,显露代表性流域间静脉,实现完整切除荷瘤门静脉流域同时可保证剩余肝脏完整功能。PT-AR基于经典解剖性肝切除核心理论,从技术层面修正经典解剖性肝切除理论与临床实践之间的偏差,有望更好实现肝细胞癌肿瘤学疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自20世纪幕内雅敏教授提出解剖性肝切除理论和技术体系,至今已经历近半个世纪的探索与实践[1]。从经典解剖性肝切除到门静脉流域解剖性肝切除(anatomic resection based on portal territory,PT-AR),从开腹门静脉穿刺染色、静脉显露到术前流域分析、腹腔镜下荧光导航,解剖性肝切除作为肝脏外科学史上最具关注与争议的领域,其理论和技术体系的发展从未停止。笔者针对经典解剖性肝切除的本质及PT-AR的起源进行梳理,追本溯源,探讨PT-AR治疗肝细胞癌的理论与技术实践。
肝细胞癌具有高侵袭性,沿门静脉流域(portal territory,PT)播散是其主要病理学传播途径,也是肝细胞癌发生肝内转移及术后局部复发的重要原因之一[2]。20世纪80年代,幕内雅敏教授提出完整切除荷瘤PT的理念,即解剖性肝切除。解剖性肝切除理论体系自提出伊始,就指向肝细胞癌的肿瘤学获益。幕内雅敏教授提出经典解剖性肝切除的本质是以PT肝段或亚段为基本解剖单位,对荷瘤PT进行系统性切除,同时也对PT供应和标记的荷瘤Glisson系统进行完整切除,以获取更好的肿瘤学疗效[2]。
经历40余年的发展和推广,解剖性肝切除虽然获得较为广泛的认同并显示可重复性获益,但质疑和争议也一直伴随。我国大部分学者认同解剖性肝切除理念,但也有部分学者质疑其肿瘤学疗效。临床实践中,解剖性肝切除治疗肝细胞癌的肿瘤学疗效尚存在差异性。有研究结果显示:与非解剖性肝切除比较,解剖性肝切除可为肝细胞癌患者带来围手术期甚至肿瘤学疗效[3, 4, 5, 6, 7, 8, 9, 10]。但也有研究结果显示:解剖性肝切除与非解剖性肝切除治疗肝细胞癌肿瘤学疗效比较,差异无统计学意义[11, 12, 13, 14]。Jung等[15]的研究结果显示:对于低侵袭性肝细胞癌,解剖性肝切除可为患者带来肿瘤学获益。而Hidaka等[16]的研究结果显示:对于高侵袭性肝细胞癌,与非解剖性肝切除比较,解剖性肝切除可降低肿瘤局部复发率,但两者疾病无进展生存时间和总生存时间比较,差异均无统计学意义。由于缺乏高级别循证医学证据支持解剖性肝切除治疗肝细胞癌中长期肿瘤学疗效,笔者认为:相关的质疑可能源自临床实践中技术标准的差异,或者源自经典解剖性肝切除理论和实践的偏差[17]。
经典解剖性肝切除理论标准是切除荷瘤PT以获取肿瘤学疗效,但其技术标准要求完整显露肝静脉主干,理论标准与技术标准存在差异。经典解剖性肝切除理论提出伊始,受制于当时的技术条件,无法在术前规划中准确分析PT,也不能在术中通过美蓝染色法实时、高效显示PT。因此,幕内雅敏教授借助基于Couinaud肝静脉分段的肝静脉主干显露技术,结合美蓝染色法指引肝脏断面,以获得近似的荷瘤PT切除效果。然而,经典解剖性肝切除本质是个体化PT肝段切除,这与Couinaud人为的肝静脉分段不同,PT肝段(或Glisson分段系统)与Couinaud肝静脉分段系统也并非同一概念。
PT间面(或Glisson系统间面)实际上是三维立体的不规则曲面,而并非沿肝静脉主干划分的规则平面[18]。无论是从肝小叶汇管区的组织胚胎微观结构层面(图1),还是从流域肝段或亚段的宏观结构层面,每一级Glisson系统(或PT系统)的流域间面中都有相对应级别的肝静脉走行,即流域间静脉(inter-territory hepatic vein,IHV)。多支IHV走行共同组成的三维立体曲面即为其对应级别的流域间面(包括流域肝叶、区、段、亚段间面)。理论上显露所有IHV即可显示真实流域间面,并获得完整PT。实际操作中,显露的IHV分支越多、级别越高,所获得的曲面越接近真实的流域间面。由此可见,单纯依靠1~2条肝静脉主干走行获取流域间面远远不足,即便左、右肝叶间面也并非单纯沿静脉主干走行所划分的规则平面,更不论区、段、亚段间面。
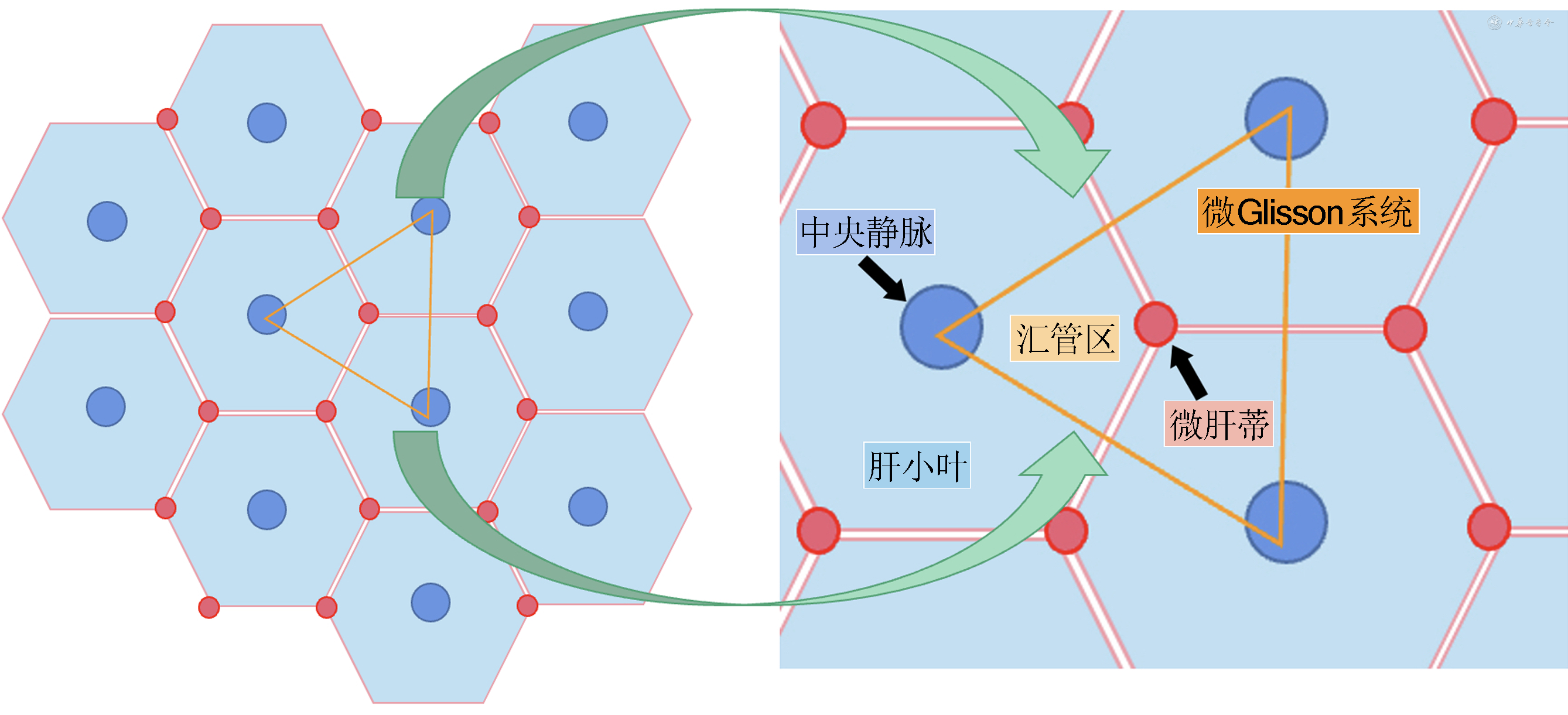

对于左、右肝叶切除,右前或右后肝区切除,或PT分型较为简单的肝S7、S8段切除,Couinaud肝静脉分段仅能在部分患者中近似于PT分段。而对于肝S5、S6段切除,或PT分型较为复杂的肝S7、S8段切除,Couinaud肝静脉分段难以涵盖PT分段。此外,Couinaud肝静脉分段对于肝S5、S8段和肝S6、S7段之间的界限本就模糊。Couinaud肝静脉分段理论上仅明确左、中、右肝静脉主干,近年来有学者提出Couinaud段间静脉,也仅探索肝静脉主干下一级分支,且仍停留在以某一条主要肝静脉以线代面获得的规则平面,并非真实的三维立体流域段间曲面。随着现代精准肝脏外科学理论和技术的发展,肝切除术中涉及亚段(4级肝蒂)解剖的情况越来越多,亚段层面的解剖已完全超出Couinaud肝静脉分段范畴[19]。在肝段或亚段层面实施个体化解剖中,仅依靠显露有限且模糊的静脉小分支走行远不足以确定段间面。此外,目前的Glisson肝蒂分段体系已达到3级,甚至4级肝蒂(亚段肝蒂)水平,并具有实际解剖操作的可行性。4级肝蒂对应的流域亚段,即锥形单位(cone unit),是目前肝脏外科技术水平能达到的最小解剖单位[20, 21]。而Couinaud肝静脉分段体系落后于Glisson肝蒂分段体系,其肝段或亚段间静脉显露技术也尚未达到逐一三维立体显露的要求。
笔者认为:受制于以往的技术条件水平,经典解剖性肝切除理论在实践层面向Couinaud肝静脉分段体系进行妥协。Couinaud肝静脉分段体系是藉由肝静脉主干走行制订的人为分段,并非生理学或肿瘤学意义上真实个体化的PT分段,两者存在偏差。经典解剖性肝切除理论上要求追溯荷瘤PT,实践中却依附Couinaud肝静脉分段体系,这是理论和实践的偏差,更可能是导致解剖性肝切除肿瘤学疗效出现偏差的原因。
精准肝脏外科理论要求在根治性切除肿瘤的同时最大限度保留功能性预留剩余肝脏体积(future liver remnant,FLR)。因此,经典解剖性肝切除技术体系难以满足需求。随着肝脏外科理论和技术的发展,三维重建流域分析系统和吲哚菁绿荧光导航系统等具有代表性的新兴技术在腹腔镜肝切除体系中得以整合[22, 23, 24, 25]。在此基础上,以完整切除肝细胞癌荷瘤PT为目标,以获取更好肿瘤学疗效为目的的PT-AR逐渐被研究者应用于临床实践[26, 27]。
PT-AR旨在术前使用三维重建流域分析获取荷瘤PT的真实区域并据此进行手术规划,术中以PT肝段或亚段为基本解剖单位(图2),使用吲哚菁绿荧光染色导航施行精准荷瘤PT系统(或荷瘤Glisson系统)的完整切除。实际操作中以吲哚菁绿荧光引导解剖荷瘤PT(正染、反染)为主,以显露代表性IHV(包括亚段、段、区、叶的IHV)为辅,沿荷瘤PT间裂(即Glisson系统间裂或生理肝裂)离断肝脏。同时结合肝静脉流域分析,使以往对肝静脉的评估定位从传统肝脏离断平面标志回归其回流的本职功能。
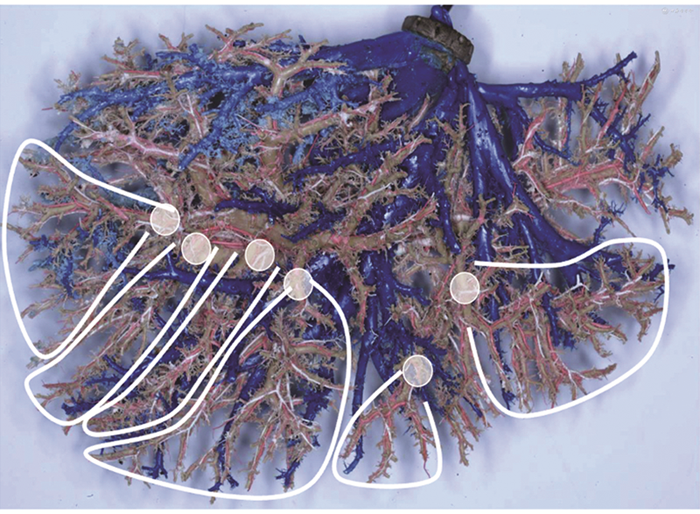

注:白色圆点代表门静脉流域肝段或亚段肝蒂起始部,白色线条范围为对应的门静脉流域肝段或亚段
理论上PT-AR是对以锥形单位为最小解剖单位的各级Glisson系统或组合进行的完整切除,实现完整切除荷瘤Glisson系统同时可保留FLR完整正常Glisson系统,保证FLR功能。已有的研究结果显示:根治性切除和功能性FLR完整保留是肝细胞癌独立预后因素,也是现代精准肝切除理论的要求[28, 29, 30]。因此,肝脏断面的确定将由以往“依托肝静脉走行确定”,转变为“优先依据荷瘤PT确定,辅以显露代表性荷瘤PT间静脉”。
笔者认为:对于解剖性肝切除肿瘤学疗效的质疑,以及经典解剖性肝切除理论和实践所存在的偏差,是PT-AR理论提出的背景。PT-AR基于“完整清除肝细胞癌荷瘤PT”这一解剖性肝切除的经典核心理论,有望从技术层面修正经典解剖性肝切除理论和实践存在的偏差,获取更好的肿瘤学疗效。PT-AR并非对立于经典解剖性肝切除理论体系,而是解剖性肝切除理论真正意义上的完整实践,贯彻其理念并推动发展。
PT-AR以PT肝段或亚段为基本解剖单位,进行PT肝叶、区、段、亚段的单独或联合切除。PT肝段指3级Glisson肝蒂的PT所供应的三维空间区域,是一个具有肿瘤学意义生理性的个体化肝段,同时也是一个独立、完整的Glisson系统。段间面是一个三维立体的曲面而非平面,其中走行以三维立体空间结构排布的多支段间静脉。生理状态下PT系统(或Glisson系统)之间不存在(或极少存在)交通支情况。2022年发表的2篇共识中,Glisson肝蒂分段系统已明确定义3级肝蒂,对应流域肝段[20, 21]。笔者在此基础上,进一步扩展4级肝蒂,对应流域亚段。PT亚段指4级Glisson肝蒂供应的锥形区域(即锥形单位,cone unit),其顶端位于该亚段4级肝蒂的起始部,是可切除的理想最小单位,有部分患者的锥形单位也可为3级肝蒂供应的流域肝段。见图3。PT肝段建立在Glisson肝蒂分段系统基础上,与Couinaud肝静脉分段存在差异。Couinaud肝静脉分段基于肝静脉系统,其理论体系和实际解剖操作技术所能达到的分级水平落后于Glisson肝蒂分段系统。
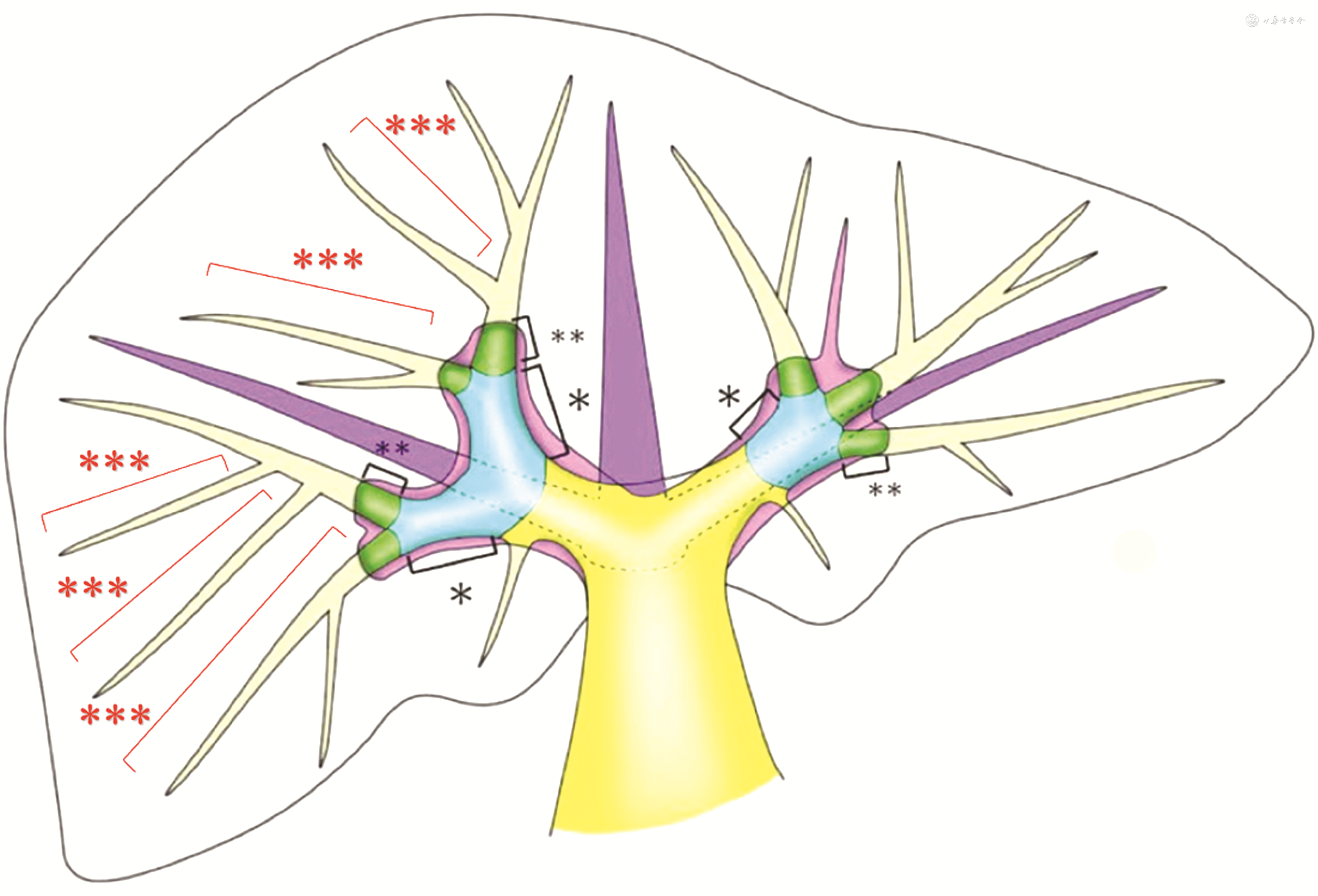

注:*为2级Glisson肝蒂;**为3级Glisson肝蒂;***为4级Glisson肝蒂
荷瘤PT指1、2、3级Glisson肝蒂分别所供应的流域肝叶、肝区和肝段,或以3、4级Glisson肝蒂所对应的流域肝段和亚段为基本解剖单位的组合区域。4级亚段肝蒂所对应的锥形单位是切除的最小单位,也是荷瘤流域规划所纳入的最小解剖单位。1 cm切缘是肝细胞癌目前广泛认可,具有最高循证医学证据的切除要求。荷瘤PT的规划需要兼顾1 cm最小切缘原则。PT-AR中切缘的扩展以PT亚段,即锥形单位为最小解剖单位进行。荷瘤PT的规划以肿瘤为中心,选取与肿瘤邻近的1支或数支肝蒂所属PT进行构建,具体原则包括:(1)PT边缘距肿瘤最小切缘≥1 cm。(2)位于肝叶或肝区的较大肿瘤,在切缘足够前提下行1/2级肝蒂对应PT肝叶或肝区切除。(3)肿瘤位于单独PT肝段内,且切缘足够时,行3级肝蒂对应PT肝段切除。(4)单一3级肝蒂所属流域不能满足1 cm切缘要求或跨PT肝段肿瘤,以最近的4级肝蒂为单位向外进行流域扩展,施行联合PT肝段和亚段切除。(5)以4级肝蒂PT,即锥形单位为最小解剖单位,增加或减少亚段支数量来控制流域范围,单一亚段流域不可分割。(6)行联合亚段切除时,荷瘤肝蒂支可以来源于同一或者相邻肝段,甚至相邻肝叶或肝区。(7)满足最小切缘≥1 cm前提下,需兼顾保留更多的FLR。(8)荷瘤PT间面行走的代表性IHV,在满足切缘要求前提下应主动显露。
需要注意的是PT-AR手术方式规划以荷瘤PT为首要目标,不再是经典解剖性肝切除中以显露某1支或数支肝静脉为目标。若肿瘤位于某一Glisson系统边缘,为满足最小切缘要求而向相邻Glisson系统扩展流域切缘时,会遭遇将相邻主要肝静脉分支甚至大静脉主干纳入荷瘤PT而实施切除的情况,造成FLR回流障碍。此时需对关系密切的主要肝静脉分支进行肝静脉流域分析,并将其纳入荷瘤PT构建的规划考量因素,兼顾切缘的同时尽量减少回流障碍的FLR。
对于中晚期巨大肿瘤压迫引起门静脉分支和流域紊乱,目标肝蒂位于肿瘤或重要保留结构后方,矢状部、右前肝蒂分支繁复,难以在术前或术中获取准确的荷瘤PT时,应在荷瘤PT范围外,以管道(肝蒂、肝静脉)和解剖标志为依托,实施规则性结构定构切除[31]。此时要求结构定构区域应尽量覆盖荷瘤PT,以实现荷瘤PT的完整切除。如巨大肝中叶肿瘤以矢状部、第二肝门、肝门板、右肝静脉腹侧为定构标志实施解剖性切除。结构定构也可与PT的荧光定构依据个体化情况联合使用,两者都可被视为定构切除的组成部分。
PT间面(或Glisson系统间面)为三维立体的不规则曲面,每一级Glisson系统(或PT系统)的流域间面中都有相对应级别的肝静脉,即IHV走行。多支IHV走行共同组成的三维立体曲面即为该对应级别的流域间面(包括流域肝叶、区、段、亚段间面)。PT-AR正是循荷瘤PT间面进行手术规划,使用荧光导航引导沿荷瘤PT间面实施断肝,同时对行走在荷瘤PT间面的三维立体曲面分布的多支IHV进行显露。理论上沿荧光边界解剖,完整追溯PT即可显露三维立体空间上的所有IHV;实际操作中显露的IHV分支越多、级别越高,所获得的曲面越无限接近于真实流域间面。但目前对于肝段或亚段间小静脉的显露技术远未达到对其进行三维立体逐一显露要求,这是目前静脉显露技术客观存在的局限性。因此,代表性IHV被定义为走行于荷瘤PT间,能被目前解剖技术水平所显露的肝静脉主干和主要分支。见图4。目前三维重建系统对肝静脉的重建效果欠佳,能重建的静脉分支数量和级别有限,因此,需要在术前三维重建流域分析中尽可能重建出更多的代表性IHV,并在术中通过解剖技术手段予以显露。综上,以荧光导航荷瘤PT为主,以显露代表性流域间静脉为辅,沿生理肝裂离断肝脏。


PT-AR倡导以PT主导离断肝脏,改变了经典解剖性肝切除中以肝静脉主导断肝的思路,进入荷瘤PT间的肝静脉是需要显露的代表性IHV。肝段或亚段的划分方法也应完全遵从PT分段体系,代替传统的肝静脉分段体系,以PT为导向代替以肝静脉为导向。笔者以前裂和前裂静脉的相互关系为例:前裂是右前区腹背侧之间的生理肝裂,是右前区腹背侧PT肝段之间的流域间面,其间存在右前肝蒂主干和可能的前裂静脉[32]。经典解剖性肝切除是先认定某一条行走在右前区肝中静脉、肝右静脉之间,较为粗大或走行较为理想的静脉,将其定义为前裂静脉,再据其腹、背侧将右前区划分为腹、背侧段。在PT-AR理论指导下,则需优先通过术前流域分析,获得右前区腹、背侧段PT,行走在此流域间面的静脉被命名为前裂静脉(图5),并在涉及右前区腹、背侧段的切除中,将其作为代表性IHV予以显露。


各级PT之间(或各级Glisson系统之间)理论上存在一个肝蒂分支缺乏或较少的“血管裸区”,称之为生理学肝裂,其间走行各级IHV。相邻Glisson系统之间在病理状态下可能形成交通支,但生理状态下极少有交通支存在。不同级别Glisson系统之间的肝裂,对应为PT肝叶、区、段、亚段间面,这是PT-AR理论上的肝脏断面。PT-AR的肝脏断面应走行在荷瘤PT之间(荷瘤Glisson系统之间),走行于生理学肝裂之上。在术前流域分析和术中荧光染色良好情况下,流域荧光边界将稳定、持久、清晰且不会晕染。完全循荧光边界解剖断肝时,理论上不应遭遇来自肝蒂的分支,只可能遭遇来自肝静脉系统的分支。若在荧光边界上发现较大的肝蒂分支,则提示术前的流域分析或术中的荧光染色可能出现错漏。因此,沿生理学肝裂离断肝脏,切除由完整Glisson系统组成的荷瘤PT,保留由完整Glisson系统组成的FLR。在完整切除荷瘤PT同时保留FLR出、入肝血流的完整性,理论上将减少胆瘘、缺血、淤血等术后并发症。
对于传统的“扩大”或“缩小”手术方式,在PT-AR理论指导下手术规划将发生改变。对于因肿瘤紧贴肝右静脉导致右后区切缘不足而施行扩大右后区切除时,传统的手术方式是将肝脏断面移至紧贴肝右静脉左侧或1~2 cm;而对于因FLR临界状态而施行的缩小肝右叶切除,传统的手术方式是将肝脏断面向右侧偏移1~2 cm,不显露肝中静脉。笔者认为:上述传统的“扩大”或“缩小”手术方式并未考虑FLR出、入肝血流的完整性,会导致术后胆瘘、缺血、淤血等并发症发生率升高。以右后区联合右前区背侧段切除代替传统的扩大肝右后叶切除,或保留右前腹侧段或某一亚段施行缩小肝右叶切除,可能是上述“扩大”或“缩小”手术方式的更好选择。
PT-AR在获得荷瘤PT荧光染色前,应尽量避免肝实质离断操作。肝实质一旦劈开,将破坏流域染色的完整性。因此,笔者不建议采用肝实质优先解剖方法。采用荧光反染策略时建议按Takasaki法,优先离断目标肝蒂,完成染色后沿荧光引导离断肝脏[33]。该方法与幕内雅敏教授的理念一致,可获得与荧光正染策略门静脉穿刺染色后再离断肝脏的相同效果。笔者据上述研究衍生出右前肝蒂-右后肝蒂-肝右静脉(anterior pedicle-posterior pedicle-right hepatic vein,APR)三角解剖入路,可在不离断肝实质前提下,获取肝右叶前后区各级肝蒂的控制。
PT-AR最主要的适应证是荷瘤PT完整的较早期中小肝细胞癌,在尽可能清除荷瘤PT同时保证FLR完整功能,从而实现肿瘤学获益。对于中晚期肝细胞癌大范围切除,可以保留功能性流域肝段或亚段,增加有效FLR,降低术后并发症发生率。此外,PT-AR可拓展应用于需要完整切除Glisson系统而获取更好疗效的肝内胆管结石、肝内胆管癌、Kras突变的结肠癌肝转移,或在活体肝移植中尝试对供、受者带来更多功能性FLR[34, 35, 36]。笔者前期的临床实践发现:PT-AR可降低胆瘘、缺血、淤血等术后并发症发生率,提高患者围手术期效果。
综上,PT-AR在术前使用三维重建流域分析获取荷瘤PT并据此进行手术规划,术中以流域肝段或亚段为基本解剖单位,以荧光染色导航为主,以显露代表性IHV为辅,沿生理学肝裂离断肝脏,以实现完整切除荷瘤PV流域并保证FLR完整功能。PT-AR基于经典解剖性肝切除核心理论,有望从技术层面修正经典解剖性肝切除理论和实践存在的偏差,推动解剖性肝切除理论技术体系发展,为肝细胞癌带来更好的肿瘤学疗效。笔者认为:当前需要进一步完善和规范PT-AR理论和技术体系,获取更多高级别循证医学证据,为深入探索该领域存在的科学问题和进行安全、规范的推广奠定基础。
所有作者均声明不存在利益冲突



























