
分子成像历经20余年发展,大量新型技术被提出,但仅有小部分成功实现临床转化,进入临床实践应用并取得显著效果。基于荧光分子成像的术中导航和基于医学影像大数据的定量分析技术,正在开展越来越多的临床试验并逐步赢得广泛认可。这两项技术通过与人工智能的深入融合,在消化系统肿瘤的术前诊断、术中导航和术后预测中取得系列研究成果,为消化系统疾病患者的个体化诊断与治疗提供了医学影像领域的新技术支持。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
荧光分子成像(fluorescence molecular imaging,FMI)作为一种新兴的肿瘤检测技术,凭借成像灵敏度高、空间分辨率高、成像速度快等优势,在促进认知肿瘤演进规律、辅助精准诊断与治疗方面提供了有力支持[1]。经历20余年发展,肿瘤FMI技术从动物水平的验证进入到临床推广新阶段(图1A),在多种肿瘤手术中发挥出“扩展”外科医师视野的重要功能,实现手术决策优化[2]。肿瘤FMI融合人工智能,能够进一步提升肿瘤检测精度、并降低并发症发生率,成为目前热点研究方向。除了术中影像结合人工智能,在更广泛的层面,医学影像大数据定量分析的发展,也得益于人工智能方法和技术的突破性进步,使研究者可以对医学影像进行自动化、全面、多维、高效地定量学习和分析,显著突破影像定性解读的精确度瓶颈。相关研究以“影像组学”的概念提出为标志,历经10余年发展,已被广泛证明可成功辅助临床实施更精准的分类诊断、治疗决策和预后预测。笔者认为:这些技术的发展和临床应用揭示了人工智能和医疗大数据对于精准医学未来走进现实的潜在贡献,为消化系统相关疾病的个体化诊断与治疗提供医学影像领域的新技术支持。
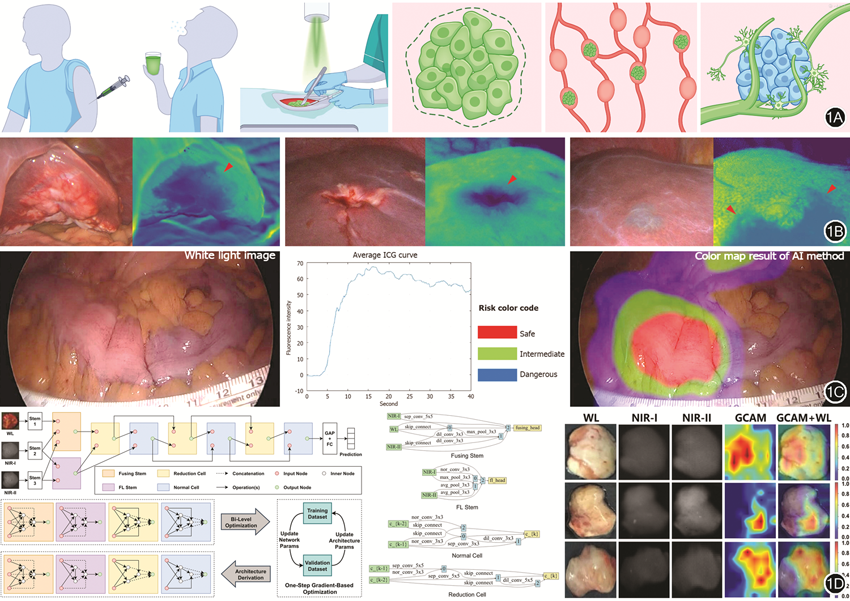

术中FMI结合人工智能已在消化系统肿瘤精准手术领域开展了多种不同的应用研究,并取得满意效果。这包括肿瘤的术中精准检测、减少手术并发症、床旁快速分子病理学检查等。
在实现肿瘤精准检测方面,英国帝国理工学院Nazarian等[3]利用组织的漫反射光谱信息训练了机器学习的智能分类模型,用于术中识别上消化道肿瘤边界。其结果显示:该智能化的术中光学成像方法分辨胃癌组织的准确度达到93.86%、分辨食管癌的准确度为96.22%;智能分析结果能在术中通过床旁显示器实时显示,有效辅助临床医师对上消化道肿瘤手术边界的识别,提升手术精度。在结直肠癌检测中,Cahill等[4]和Hardy等[5]利用有监督的学习框架,将注射吲哚菁绿后结直肠癌与正常组织的视频图像作为训练数据,形成内镜下快速、智能判断结直肠病灶良恶性的诊断方法。此后,该团队还将该技术应用于结直肠癌肝转移的术中识别(图1B),使术中吲哚菁绿荧光成像检测肠癌肝转移病灶的准确度达到97.2%,并能可视化地辅助手术边界判别[6]。该方法有效地克服了吲哚菁绿探针缺少肿瘤特异性的问题,并且具有较高的可推广价值,有望适用于多种肿瘤的荧光手术导航。
人工智能与FMI的融合在降低并发症发生率方面同样展现出显著价值。Park等[7]针对结直肠癌切除术后易发生吻合口瘘等并发症问题,将患者术中使用吲哚菁绿血管灌注获得的荧光影像输入自组织映射神经网络模型中进行训练,得出术中智能化提示吻合口并发症的分析模型(图1C),用于辅助结直肠癌吻合口的选择,降低术后并发症发生几率。
此外,智能化的FMI还能在肿瘤手术中发挥出床旁快速分子病理学检查的作用。Shen等[8]设计一种基于迁移学习的术中肿瘤诊断方法,能对摄取了吲哚菁绿的肿瘤离体组织进行术中快速分析,为切除组织的良恶性鉴别、甚至组织中Ki-67分子的表达水平进行可视化评估。与传统的术中病理学检查比较,新型智能化成像方法能以更快的速度进行更直观的分析。Xiao等[9]采用神经网络架构搜索方法,开展术中肿瘤组织快速分级(耗时仅1 s)的新应用(图1D),不仅能对更大尺寸的组织实现肿瘤手术分级的“提前化”,还有望对多种肿瘤生理信息同时检测,从而克服常规病理学方法检测范围有限、肿瘤分子异质性强的问题,助力肿瘤精准外科的发展。
人工智能结合术中FMI,除应用于以上场景直接提高消化道肿瘤手术实施的精度和效果,人工智能还可实时增强现有FMI系统的可视化性能和图像质量,更方便外科医师的术中观测和决策。研究者通过计算机仿真生成的术中影像大数据和真实的术中FMI数据相结合,训练特殊构建的生成对抗人工智能网络模型,从而在多项性能指标上提高术中FMI的可视化效果,包括实时提高术中成像分辨率和对比度、实时智能调节术中成像的亮度和动态范围,实时去除腔镜手术点光源造成的高光过曝[12, 13, 14]。这些人工智能技术的研发和应用,不仅使得术中FMI系统的综合成像性能得到进一步提高,辅助医师得到更好的动态影像观测效果,还使术中FMI系统操作变得更为简单和智能,降低了外科医师对于这类设备的学习和使用难度。
随着人工智能和大数据技术的发展,CT诊断正在从传统的定性分析转向智能化的定量分析。通过人工智能分析海量数据,为实现消化道肿瘤的精准诊断和治疗带来新机遇。基于CT检查等医学影像的人工智能建模流程如图2所示。其中,图像信息的定量挖掘可分为两个主要方向:(1)采用预定义特征提取和机器学习建模的典型路径。(2)通过深度学习技术,特别是卷积神经网络和Transformer,有针对性地挖掘与临床任务密切相关的深层图像特征,大幅降低推理过程中对人工干预的依赖,近年来已成为研究热点。
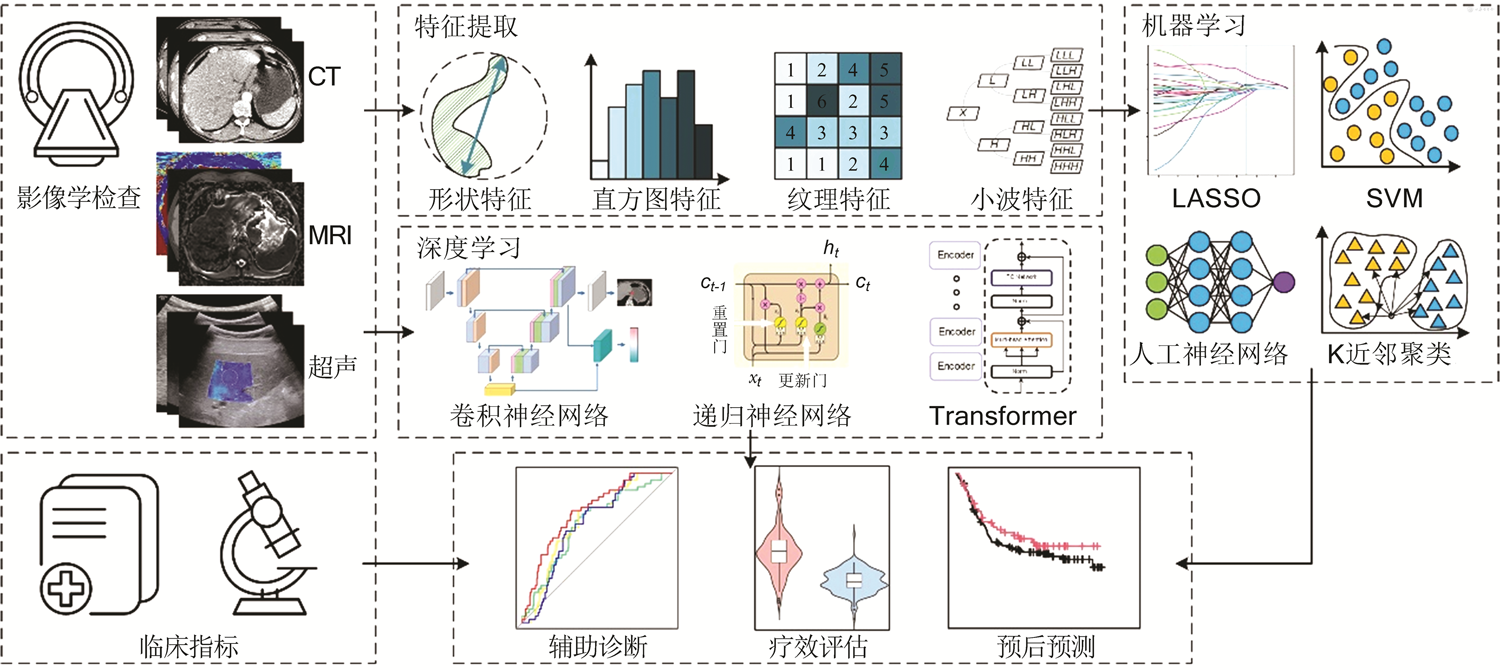

注:LASSO为最小绝对值收缩和选择算子;SVM为支持向量机
2016年Huang等[15]发表1项影像组学预测结直肠癌淋巴结转移的代表性研究,研究者使用最小绝对收缩和选择算子以及Logistic回归筛选特征,并结合影像组学标签、临床指标和医师报告的转移状态构建预测模型,将术前预测转移的受试者工作特征曲线下面积提高至0.778,对临床手术方案有重要帮助。针对淋巴结转移,Gao等[16]基于Faster R-CNN模型构建胃癌CT检查诊断系统,采用基于临床诊断和病理学确诊结果的两阶段模型训练方案,显著提高准确度。Dong等[17]针对胃癌淋巴结转移数目预测任务提出1种基于深度学习的特征提取算法,即通过在特征提取层加入正则项并结合相关性分析筛选出关键的卷积层节点以降低输出特征的冗余度,并使用多种统计学公式评估特征图以增加特征提取的充分性。
基于CT检查的人工智能模型在预测病情发展和疗效方面也展示出巨大潜力。Wang等[18]和Zhang等[19]分别针对食管癌和胃癌研究融合深度学习特征、预定义特征及临床指标的深度学习影像组学模型的预后预测能力。Cui等[20]和Hu等[21]评估了该类模型在胃癌新辅助化疗疗效预测中的性能,结果显示:利用人工智能技术挖掘和量化的CT检查图像特征能够为临床指标带来显著增益。在端-端模型构建方面,Jiang等[22]使用S-net网络结构将多个层次的深度特征进行多尺度整合。Zhang等[23]提出基于多焦点的深度学习网络,用于提取并融合低阶和高阶图像特征,进一步扩大特征提取的层次范围。
日益完善的CT检查成像和图像处理技术也为开发精度更高的预测工具提供有力支持。CT检查灌注成像中,肿瘤的表面通透性与患者治疗反应相关[24]。能谱CT检查图像上的局部衰减率变化曲线和物质分离图像为判定各类组织提供有价值的信息,已被证实具有预测肿瘤分化程度、疾病进展、新辅助化疗效果的潜力[25, 26, 27]。Li等[28]回顾性分析204例胃腺癌患者的术前能谱CT检查图像,采用深度学习方法结合临床信息和能谱CT参数构建淋巴结转移预测模型。该模型在测试集的受试者工作特征曲线下面积达到0.82,优于单能级模型。同时,多平面重建、虚拟胃镜、CT检查血管造影等技术提供了更直观的可视化结果,有助于提高人工智能模型的预测性能和临床适用性[29, 30]。
新辅助疗效的预测对于结直肠癌患者的个性化治疗、医疗资源优化和预后评估具有重要意义,但其高准确性预测面临数据异质性、数据量不足和模型泛化能力不足等挑战。MRI检查和人工智能的结合为解决以上问题提供了支持,提高新辅助治疗效果预测的准确性和泛化能力,从而辅助医师为患者制订更精准和个性化的治疗方案,优化医疗资源的分配,以及更准确地评估患者预后。
Feng等[31]开发并验证放射病理组集成预测系统(RAdioPathomics Integrated preDiction System,RAPIDS),该影像病理组学模型收集了新辅助治疗后行根治术患者的预处理盆腔MRI检查(T2加权成像、增强T1加权成像和弥散加权成像)和HE染色活组织病理学检查切片图像进行注释和特征提取,能准确预测局部晚期直肠癌患者新辅助治疗前的病理学完全缓解。其前瞻性验证研究结果显示:RAPIDS的受试者工作特征曲线下面积为0.812。RAPIDS整合了影像组学和病理组学的多模态特征,从而显著优于单模态预测模型。
Shaish等[32]探讨局部晚期直肠癌和周围直肠系膜治疗前基于MRI检查影像组学模型对于疗效的预测性能。其研究结果显示:相关人工智能模型可以预测行新辅助治疗和全直肠系膜切除术的局部晚期直肠癌患者的病理学完全缓解、新辅助直肠评分和肿瘤消褪等级。尽管MRI检查图像数据极其异质,但基于人工智能的影像组学模型仍具有中等准确性。
Jiang等[33]开发并验证基于MRI检查的深度学习模型,用于根据治疗前MRI检查T2加权成像的分段肿瘤体积预测直肠癌患者的生存率。该模型在研究队列的验证集和外部测试集的一致性指数分别为0.86和0.67。这表明基于术前MRI检查的深度学习模型能够预测直肠癌患者的生存情况,用作术前风险分层工具。
Foersch等[34]利用人工智能确定1 000多例结直肠癌患者的免疫评分的多链深度学习模型,用于预测结直肠癌患者的生存率和治疗反应。其研究结果显示:该模型具有很高的预后预测能力,优于其他基于临床、分子和免疫细胞的模型。该模型还可用于预测直肠癌患者对新辅助治疗的反应。该多链深度学习模型不仅优于其他基于免疫评分的方法,还优于其他相关预后因素(如UICC分期、切除状态和组织病理学分级等)。免疫评分可为临床医师提供基于肿瘤免疫微环境有价值的决策工具。
超声检查由于其无创性、便携性和实时成像等优势,已成为医学诊断和治疗不可或缺的工具。基于人工智能提取和分析影像组学特征(如形状特征、小波特征和纹理特征等)的机器学习算法从医学图像中帮助临床医师诊断和预测疾病预后,吸引了研究者对包括超声检查医学成像领域的研究关注(图2)[35]。消化系统主要涉及食管、胃、肠、肝脏、脾脏、胰腺、胆囊等,人工智能在医学图像中的应用逐渐扩展,尤其是在肝脏、胰腺和胆囊等器官的诊断与治疗中表现出色。
肝硬化患者定期需行腹部超声检查,并被用作占位性病变筛查的首选成像方法。因此,超声检查是评估肝脏疾病和检测新发病灶的主要工具。Bharti等[36]提出人工神经网络模型,利用超声检查图像数据区分肝病的4个阶段,即正常肝脏、慢性肝病、肝硬化和肝细胞癌。该模型的分类准确率可高达96.6%。Wang等[37]针对肝脏超声的二维剪切波弹性成像数据研发了1种基于深度学习策略的影像组学模型(deep learning radiomics of elastography,DLRE)。DLRE可以高精度地无创分析乙型病毒性肝炎患者的肝纤维化进展,其分期精度接近于肝脏穿刺活组织病理学检查获得的病理学金标准。人工智能还被用于超声造影检查以提高其识别癌症特征的能力。Guo等[38]将深度学习应用于超声造影检查3个阶段(肝动脉期、门静脉期和门静脉晚期)检测肝脏病变,提高了检测准确度、灵敏度和特异度。
Kuwahara等[39]纳入50例胰腺导管内黏液乳头状瘤患者,其中23例为恶性,27例为良性,采用3 970张静态EUS图像区分良、恶性导管内黏液乳头状瘤。这些图像使用卷积神经网络进行分析,该系统识别恶性导管内黏液乳头状瘤的准确度、灵敏度、特异度分别为94%、95.7%、92.6%。
近年来,随着医学成像技术的发展,临床获取的患者影像数据越来越丰富,质量也越来越高。随着电子信息技术的发展,计算机的算力得到前所未有的增强,人类获取算力的成本在不断降低。随着人工智能模型和算法的发展,计算机定量分析医学影像大数据的能力和效率也在不断突破。因此,笔者认为:针对消化系统肿瘤等疾病,基于人工智能和医疗大数据的荧光手术导航和量化评估策略必然会有日新月异的发展,并持续和深刻地影响临床诊断与治疗的全流程和规范。相关前沿技术和设备已经在消化系统肿瘤的术中影像导航、术前精准诊断和术后疗效预测等方面展开应用,并取得令人振奋的临床研究效果。当然,这些技术也面临着缺乏大规模前瞻性RCT验证、缺乏生物医学可解释性、缺乏医工人才深入合作和标准化规范等诸多挑战。但是,相关技术发展的潮流和临床转化应用的趋势已然形成。人工智能和医疗大数据正在推动消化系统疾病临床精准诊断和个体化手术治疗的快速发展。
田捷, 王坤, 董迪, 等. 基于人工智能和医疗大数据的肿瘤荧光手术导航与量化评估策略[J]. 中华消化外科杂志, 2024, 23(4): 536-542. DOI: 10.3760/cma.j.cn115610-20240304-24142.
所有作者均声明不存在利益冲突



























